Свойства кислорода
Цель урока.
Обучающие :
- способствовать формированию знаний учащихся о кислороде, его химических свойствах;
- реакция окисления, реакция горения, медленное окисление, оксиды;
- сформировать умения записывать уравнения химических реакций горения простых и сложных веществ в кислороде, давать названия полученным веществам;
Развивающие:
- умений увидеть проблему и найти пути её решения;
- умений применять полученные знания на практике и оценивать результаты выполненных действий;
- продолжить развитие самостоятельности, умения работать в парах и группах.
Воспитательные: способствовать воспитанию добросовестного отношения к труду, положительного отношения к знаниям, способности преодолевать трудности для достижения цели.
Тренировочная работа.
Определить валентность химических элементов с помощью пальцами (водород, алюминий, натрий, кислород, калий )
Работа с карточками : дать название химических формул (хлорид натрия, оксид железа оксид фосфора …)
Тест (групповая работа). (Презентация. Слайд 1)
1. Найдите правую часть уравнения химической реакции 4 Си +О2=
- 2СиО2
- 2Си2О
- СиО2
- Си2О
Ответ (2)
2. Найдите правую часть уравнения химической реакции 2Fe +3CI2 =
1) 2FeCI2
2) Fe2 CI3
3) FeCI3
4) 2FeCI3
Оответ (4)
3. Какое из приведенных уравнений химических реакций относится к реакциям разложения ?
1) 2 AI +6 HCI = 2AICI3+3H2
2) 2Mg +O2 = 2MgO
3) CaCO3 = CaO+CO2
4) Fe+CuCI2 = FeCI2 +Cu
Ответ (3)
4. Какое из приведенных уравнений химических реакций относится к реакциям соединения ?
1) CaCO3 = CaO+CO2
2) 2 AI +6 HCI = 2AICI3+3H2
3) Fe+CuCI2 = FeCI2 +Cu
4) 2Mg +O2 =2MgO
5. Чему равна масса 0, 1 моля алюминия
- 2, 7 г
- 0, 1г
- 260 г
- 540 г
Индивидуальная работа. Задача : При окислении хлором 11, 2 г железа можно получить хлорид железа (III) количеством вещества.
1) 0,2 моль
2) 0, 5 моль
3) 2 моль
4) 0, 1 моль
Дано
m(Fe)=11, 2 г ν= m:М
ν – ? М(Fe)= 56 а.е.м
ν= 11, 2 г : 56 = 0,2 моль Ответ (1)
Объявление темы урока.
Объяснение нового материала.
Запись в тетрадях.
Без газа этого на свете
Не жили б звери и народ.
Его назвать могли бы дети,
Теперь и вам известно – это ….! (кислород )
Демонстрационный опыт (целлофановый мешок, физические свойства )
Кислород О2 в нормальных условиях – газ без цвета и запаха
Характеристика кислорода (устно )
1. Химический знак – О
2. Химическая формула – О2
3. Период – 2
4. Ряд – 2
5. Группа 6а
6. Относительная атомная масса – 16
7. Порядковый номер +8
8. Заряд ядра – 26
9. Число протонов – 26
10. Число электронов – 26
11. Неметалл.
12. Произношение – о
Допишите уравнения химических реакций:
а). + O2 →CuO
б) Fе + O2 →.
в) S +. →SO2
г) CuS +. →SO2 +.
Работа с помощью таблиц (Распространение элементов в природе )
Кислород.
1) в космосе – 92%
2) в земной коре – 1%
3) в виде соединений на земле – 49%:
4) в атмосфере – 0,0005%
1) в воздухе – 21%
2) в земной коре – 92%
3) в гидросфере – 89%
4) в живых организмах – 65%
Джозеф Пристли, Вильгельм Шееле, Антуан Лавуазье.
Они доказали, что в состав воздуха кроме кислорода и азота, входят еще 5 газообразные вещества.
Кислород на Земле – самый распространенный элемент.
Химические свойства.
Кислород взаимодействует с простыми веществами.
Демонстрация опыта (горение спички).
Запишем уравнение реакции:
C + O2 ––> CO2 демонстрационный опыт + порошок древесного угля
S + O2 ––> SO2 демонстрационный опыт + кристаллическая решетка серы
4P + 5O2 ––> 2P2O5 демонстрационный опыт + кристаллическая решетка оксида фосфора.
ОксидАгрегатное состояние (при н. у.)Цвет, Температура плавления, °С Растворимость в воде.
CO2 газообразное, бесцветный.
H2O жидкое, бесцветный.
P2O5 твёрдое, белый.
Cu2O твёрдое, красный.
CaO Твёрдое, белый.
Fe2O3 твёрдое, красно-коричневый.
SiO2 твёрдое, бесцветны.
Реакция окисления – реакция, в результате которой вещество взаимодействует с кислородом
Проблемный вопрос:
– Какие признаки реакции вы наблюдали?
– Правильно, вы назвали признаки реакции горения, а теперь дополните свой конспект ещё одним определением:
Реакция горения – реакция, при которой происходит окисление веществ с выделением теплоты и света.
– Ребята, обратите внимание на химические формулы образовавшихся веществ, что вы можете сказать об их составе?
– Вы правильно определили состав образовавшихся веществ, они действительно состоят из двух элементов, один из которых кислород, такие вещества называют оксидами.
Запишите новое определение в тетрадь:
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород.
Упражнений для пальчиковой гимнастики: Молекула, молекула – 3
Групповая работа по закреплению полученных знаний
Повторение.
Групповая работа по закреплению полученных знаний.
Тест.
Газ без цвета, вкуса и запаха:
А) хлор,
Б)кислород,
В) оксид серы.
Реакция горения – реакция, при которой происходит с выделением … и ….
Реакция окисления – реакция, в результате которой вещество взаимодействует с …
Ответ:
1) кислород,
2) теплота и свет.
3)кислородом.
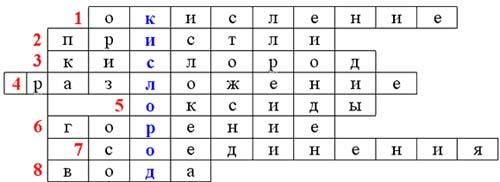
Учащиеся разгадывают кроссворд.
Вопросы.
- Процесс взаимодействия простых и сложных веществ с кислородом.
- Английский ученый открывший кислород.
- Вещество поддерживающее горение.
- Тип реакции 2H2O —> 2H2+O2.
- Вещества, получающиеся при горении.
- Процесс сопровождающийся выделением тепла.
- Тип реакции горения серы.
- Самое распространенное вещество содержащее кислород.
Итог урока.
- Составить кроссворд, ключевое слово которого “кислород”;
- Сочинить сказку, стихи об огне или составить плакат, листовку о вреде пожаров, об осторожном обращении с огнём;
Вывод : Без кислорода беда: ведь он нужен для дыхания и горения, без него нет ни жизни, ни тепла. Это самое главное вещество на Земле.
– Урок завершён, всем спасибо.