Конспект урока по теме
«Соединения щелочноземельных металлов»
Цель: Обобщить знания учащихся и сформировать у них полное разностороннее представление
о природных соединениях щелочноземельных металлов, их свойствах, значении в
природе и использовании человеком
Задачи: 1) обучающие: усвоение учащимися представлений о природных соединениях
щелочноземельных металлов, их значении в природе и использовании
человеком;
2) развивающие: развитие умений составлять формулы веществ по их названиям и
давать названия по химическим формулам; записывать уравнения
химических реакций и рассматривать их с точки зрения
ТЭД и ОВР; отработка навыков проведения химического
эксперимента; показать взаимосвязь химии с другими предметами
(биологией, географией, ИЗО) и областями деятельности человека
(медициной, строительством, сельским хозяйством, архитектурой)
3) воспитывающие: патриотическое, эстетическое воспитание, формирование навыков
ЗОЖ (по предупреждению заболеваний опорно-двигательной
системы)
Оборудование:
Для лабораторных работ: штатив для пробирок, пробирка, растворы гидроксида кальция, сульфата меди(II) и соляной кислоты, фенолфталеин, коллекции природных соединений щелочноземельных металлов в чашках Петри;
Для демонстраций: штатив для пробирок, пробирка, оксид кальция, вода, фенолфталеин, скелет человека, зубы млекопитающих, яйца, упаковки от зубных паст, кораллы, жемчуг, мел, мрамор, известняк; коллекция химических соединений щелочноземельных металлов
Технические средства: компьютер, колонки, медиапроектор, экран.
Структура урока:
Организационный момент
Повторение пройденного материала
Изучение нового материала: 1) Генетические ряды щелочноземельных металлов на примере кальция. Оксид и гидроксид кальция. 2) Соли щелочноземельных металлов. Лабораторная работа «Ознакомление с образцами природных соединений кальция». Применение солей
Закрепление полученных знаний
Домашнее задание
Окончание урока
7. Рефлексия
Ход урока
1. Организационный момент
2. Повторение пройденного материала
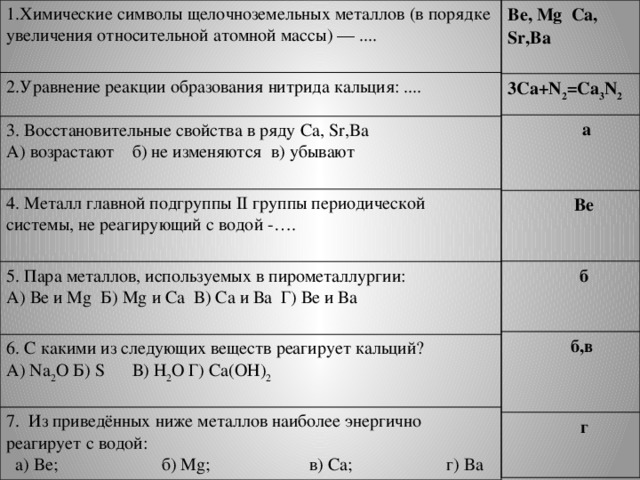
1.Тест по теме «Общая характеристика элементов главной подгруппы II группы»
| 1.Химические символы щелочноземельных металлов (в порядке увеличения относительной атомной массы) — .... | Ве, Мg Са, Sr,Ba |
| 2.Уравнение реакции образования нитрида кальция: .... | 3Са+N2=Са3N2 |
| 3. Восстановительные свойства в ряду Са, Sr,Ba А) возрастают б) не изменяются в) убывают | а |
| 4. Металл главной подгруппы II группы периодической системы, не реагирующий с водой -…. | Ве |
| 5. Пара металлов, используемых в пирометаллургии: А) Ве и Мg Б) Мg и Са В) Са и Ва Г) Ве и Ва | б |
| 6. С какими из следующих веществ реагирует кальций?
А) Na2O Б) S В) Н2О Г) Са(ОН)2 | Б,в |
| 7. Из приведённых ниже металлов наиболее энергично реагирует с водой: а) Be; б) Mg; в) Ca; г) Ba | г |
Ответы и критерии оценивания слайд 2
Актуализация знаний и мотивация, постановка учебной задачи :
Что нам предстоит изучить? (ученики предлагают)
Слайд 3
Какие цели нам необходимо поставить? ( ученики предлагают)
Слайд 4
3.Изучение нового материала
В каком виде щелочноземельные металлы встречаются в природе? Почему?(высокая химическая активность)
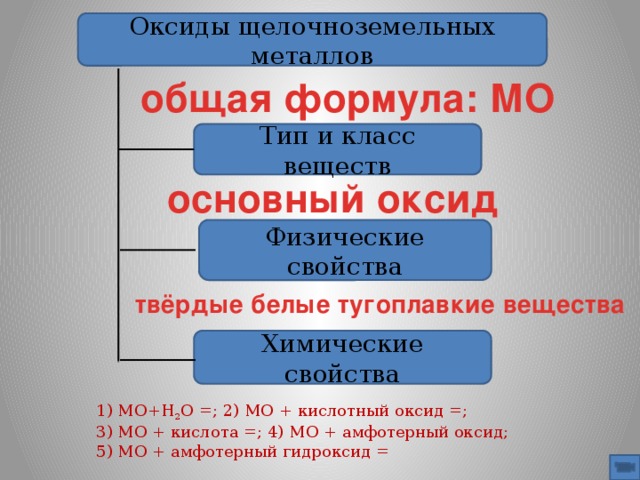
На основании поученных вами знаний, скажите, в виде каких химических соединений встречаются щелочноземельные металлы в природе? (оксиды)
Слайд 5
Какие свойства проявляют оксиды ( основные)
Перечислите физические свойства щелочноземельных оксидов
Какими свойствами обладают щелочноземельные оксиды
Известно, что металлу соответствует основный оксид и основание.
Как получить гидроксид щелочноземельного металла? (взаимодействие оксида щелочноземельного металла)
Слайд 5(опыт гиперссылка)
Гидроксиды щелочноземельных металлов относятся к щелочам. Пользуясь учебником страницы 62-63 заполните таблицу №1 часть 1 в карте нашего урока ( приложение 1)
Слайд 6
Выполнить задания по вариантам 1вар. 2 вар.(приложение 2)
Проверка у доски по 1 человеку от варианта
Для обнаружения углекислого газа используют раствор гидроксида кальция – известковую воду. Почему для этих целей не используют гидроксид натрия?
слайд 6.(опыт гиперссылка)
На демонстрационном столе – склянки с солями (хлорид, нитрат, карбонат, фосфат, сульфат кальция)
Опишите физические свойства представленных солей
Как можно получить соли щелочноземельных металлов ?
опыт( проводит ученик) получение хлорида кальция действием соляной кислоты на мел
Лабораторная работа «Ознакомление с образцами природных соединений кальция»
Задание. Рассмотрите образцы и заполните таблицу №1 часть 2 названия природных соединений кальция(Приложение 1)
На наш урок приглашены специалисты разных областей знаний. В своей работе они не могут обойтись без соединений щелочноземельных металлов.
Задание. По ходу выступлений заполните таблицу 1,часть 2 применение солей щелочноземельных металлов (приложение 1)
Выступление строителя: слайд 7
Самый важный из минералов – известняк (карбонат кальция), без которого не обходится ни одно строительство. Во-первых, он сам является прекрасным строительным камнем. Во-вторых, это сырьё для получения цемента, гашёной и негашёной извести, стекла и др. Известковой щебёнкой укрепляют дороги. Природный мел представляет собой остатки раковин древних животных. Мел применяют для побелки, а также и в школе – школьный мел.
Выступление агронома: слайд 8
Среднего содержания кальция в почвах (1,37%) вполне достаточно для обеспечения физиологических потребностей растений. Тем не менее, соединения кальция вносят в почвы для химической мелиорации: известковым порошком уменьшают кислотность почв, гипсованием устраняют избыточную щёлочность. Нитрат и фосфаты кальция используются как азотные удобрения.
Выступление скульптора: слайд 9
Минерал скульпторов – мрамор (карбонат кальция). Из него создавал свои прекрасные творения Микеланджело.
Сульфат кальция встречается в природе в виде минерала гипса. Его используют для получения слепков. Для этого применяют полуводный гипс – алебастр.
Выступление хирурга: слайд 10, 11
Гипс используем и мы, медики, для наложения фиксирующих гипсовых повязок. Сульфат магния, известный под названием горькая или английская соль, используют в качестве слабительного средства. Он содержится в морской воде и придаёт ей горький вкус. Сульфат бария благодаря нерастворимости и способности задерживать рентгеновские лучи применяют в рентгенодиагностике («баритовая каша») для диагностики заболеваний желудочно-кишечного тракта. Остальные соединения бария токсичны.
Из всех заболеваний подростков на первом месте стоят нарушения опорно-двигательного аппарата. Одна из причин – недостаточное содержание кальция в пище. Замедление поступления кальция в костную ткань вызывает деформацию костей у взрослых и рахит у детей. Человек должен получать в день 1,5г кальция. Наибольшее его количество содержится в сыре, твороге, петрушке, салате. Другой хороший источник пищевого кальция, часто не берущийся в расчет - мягкие кости лосося и сардин, которые мы съедаем при потреблении этой пищи.
Выступление стоматолога: слайд 12
А сколько соединений кальция в составе любой зубной пасты! Из зубной пасты доставляются кальций, фосфор и магний. Кальций и фосфор являются основными строительными элементами эмали зуба. На протяжении всей жизни человека они участвуют в обменных процессах. Необходимость такой добавки обусловлена потребностью зубов в этих элементах при кариесе, и в еще большей степени при некариозных поражениях зубов. Некариозные поражения зубов чаще всего связаны с нарушениями функции щитовидной, поджелудочной, половых желез, заболевания ЖКТ и др., а так же с влиянием внешних неблагоприятных воздействий (ежедневная длительная - более 6 часов - работа с компьютером, экологические влияния) вызывающих заметную убыль минеральных компонентов в тканях зуба, ведущих в начале к повышенной чувствительности зубов, а затем к повреждению в виде кариеса. В связи с этим местное применение паст, содержащих фосфорно-кальциевые добавки, позволяет не только предупредить, но и в известной степени компенсировать потери при наличии заболевания.
Выступление географа: слайд13
В Карелии есть город, на гербе которого изображён жемчужный венок на голубом поле. Это Кемь. Именно кемский жемчуг из рек Керети, Кеми и Куземки очень хвалили специалисты, считали его образцом пресноводного русского жемчуга «по цвету, блеску и форме». Карельский жемчуг цвет имел серебристый, чуть-чуть голубоватый. Конечно же, самые крупные жемчужные зерна превращали в бусы. Кроме того, им расшивали одежду и головные уборы поморских девушек. В них каждая поморка по праздникам выглядела настоящей царевной. Такими нарядами очень дорожили, берегли их и передавали из поколения в поколение. Мелким жемчугом украшали оклады икон в монастырях, расшивали праздничную одежду священников. Во времена его былой популярности много драгоценных зерен продавалось и за границу. Хитрые иностранные купцы охотно скупали поморский жемчуг, а иногда ввозили его снова в Россию под видом более дорогого «восточного». Поморский жемчуг практически перестали добывать в кемских реках почти 100 лет назад: мало стало перловиц, упали цены на эти прекрасные дары кемских рек. Но времена меняются: сегодня по подсчетам специалистов, в одной из рек северной Карелии обитает около 5 миллионов жемчужниц. Значит, старинный герб Кеми имеет не только историческое значение. Современная Кемь украшена по-настоящему богатым жемчужным венком!
Выступление биолога (учитель):
Мы практически ежедневно встречаемся с ещё одним объектом природы, который на 90% образован карбонатом кальция. Отгадайте загадку:
Может и разбиться,
Может и свариться.
Если хочешь, в птенчика
Может превратиться (Яйцо).
Более десяти лет исследований показали, что яичная скорлупа идеальный источник кальция, который легко усваивается организмом.
Готовят скорлупу так. Яйца моют в теплой воде с мылом, хорошо ополаскивают. Белок и желток выливают из яйца, а скорлупу еще раз прополаскивают и на 5 минут помещают в кипящую воду. Скорлупа яиц, сваренных вкрутую чуть менее активна, но зато готова к использованию. Дозировка от 1,5 до 3 г. в зависимости от возраста. Растереть скорлупу в порошок лучше в ступке. Принимать с утренней едой - с творогами или кашей .
Используя учебник стр.64-65 выполните задание в группах( приложение3)
Мы познакомились с основными соединениями металлов 2 группы подгруппы А, подведем итог урока
4.Закрепление полученных знаний
Тест с взаимопроверкой (приложение 4)
5. Рефлексия
Слайд 14
6.Домашнее задание
Слайд 15
Обязательное: § 12 стр. 62-67, ? 1 на стр. 67, закончите конспект урока
Дополнительное: Составьте генетический ряд бария, запишите уравнения химических
реакций переходов
Творческое: Придумайте сказку или задачу с привлечением знаний о щелочноземельных
металлах и их соединений
Источники информации:
1. Габриелян, О.С. Химия. 9 класс: учеб. Для общеобразоват. учреждений / О.С. Габриелян. – М.: Дрофа, 2008. – 270 с.
2. http://ru.wikipedia.org/wiki/ - соединения кальция и их применение
Приложение 1
| Часть 1 Оксиды и гидроксиды щелочноземельных металлов |
| формула | Название вещества | применение |
| MgO |
|
|
| CaO |
|
|
| Ca(OH)2 |
|
|
| Прозрачный раствор Ca(OH)2 |
|
|
| Белая взвесь Ca(OH)2
|
|
|
| Часть 2 Соли щелочноземельных металлов |
| формула | название вещества | применение |
| CaCO3 |
|
|
|
|
|
|
|
|
| CaSO4× 10H2O |
|
|
| MgCO3 |
|
|
| BaSO4 |
|
|
| Ca3(PO4)2 |
|
|
Приложение 2
Вариант 1
1. Известно, что металлам соответствуют основные оксиды. Докажите, что оксид кальция – основной оксид, составив уравнения соответствующих реакций.
2. Разберите одно из уравнений реакции в свете теории ОВР.
Вариант 2
1. Известно что металлам соответствует основной оксид и основание. Докажите, что гидроксид кальция – основание. Составьте уравнения соответствующих реакций, объясните их.
2. Разберите одно из уравнений реакции в свете теории ТЭД.
Приложение 3
Заполните пропуски в тексте, вставив нужные слова:
1) Мел, мрамор и известняк – это минералы в состав которых входит одно и тоже соединение ……..
2)BaSO4 – это………………………….каша
3)В какой минерал входит сульфат кальция-………………………..
4)Какой карбонат применяют в производстве цемента, стекла-…………
5)MgSO4 известен под названием ……………………соль
6)Фосфат кальция входит в состав фосфоритов, апатитов, ……………..
7)Эти соли входят в состав светящихся красок- фосфоров:…………….
Приложение 4
Задание: Какие утверждения верны?
Все элементы II группы главной подгруппы относятся к щелочноземельным металлам
Оксид кальция реагирует с кислотными оксидами и кислотами, образуя соли
Негашёная известь – это гидроксид кальция
Помутнение известковой воды вызывает угарный газ
Карбонат и фосфат кальция - это нерастворимые соли
Алебастр – это полуводный гипс
Внутренний скелет характерен для позвоночных животных
В организме человека 98% кальция содержится в костях
Яичная скорлупа образована фосфатом кальция
Природный мел представляет собой остатки раковин древних животных