| УЭ1 Актуализация знаний по теме прошлого урока | Метапредметные результаты: РегулятивныеУУД: самоконтроль сформированности знаний и умений по теме видеть ошибки и устанавливать причины ошибок Познавательные УУД: - отработка навыков работы по известному плану и алгоритму Коммуникативные УУД: - осуществлять самоконтроль правильности выполнения заданий и формулировки понятий; - слушать и понимать речь других. | Цель: выявление уровня сформированности знаний и умений по теме : общая характеристика металлов Задание 1. Дайте общую характеристику металлам по плану: положение в ПСХЭ, электронное строение, тип связи, физические свойства, химические свойства, примеры, значение Задание 2. Выпишите номер правильного ответа Вариант 1 Простое вещество – металл у элемента 1)Ar; 2) As; 3) C; 4) Ag Нехарактерное свойство для металлов 1)пластичность 2) ковкость 3)хрупкость 4)блеск При комнатной температуре жидкий металл 1)Zn; 2) Al; 3) Ag; 4)Hg Наиболее пластичный металл 1)Fe; 2) Au; 3) Cu; 4) Cr В каком ряду элементов свойства металлов усиливаются? 1)Al, Mg, Na; 2) Sr, Ca, Mg; 3) K, Mn, Rb; 4) Cs, Ba, Al. Вариант 2 Простое вещество – металл у элемента 1)Hg; 2) He; 3) S; 4) Ne Нехарактерное свойство для металлов 1)электропроводность 2)тягучесть 3)теплопроводность 4)прозрачность Наиболее тугоплавкий металл 1)Au; 2) Al; 3) W; 4)Fe Наиболее электропроводный металл 1)Ag; 2) Al; 3) Fe; 4) Zn Электронная формула 1s2 2s 22p6 3s1 1) Fe; 2) Na; 3) Cu; 4) Cr.
|
Отвечают по плану, дают характеристику металлов
Выполняют письменное задание , проверк а в парах |
| УЭ 2 Создание проблемной ситуации
| Метапредметные результаты: Регулятивные УУД: самостоятельно обнаруживать и формулировать учебную проблему, определять цель учебной деятельности (формулировка темы урока). Познавательные УУД: основы активного слушания, анализирование информации Личностные УУД: обладать учебно-познавательной мотивацией и интересом к учению. Коммуникативные УУД: слушать и понимать речь других; уметь с достаточной полнотой и точностью выражать свои мысли. | . Создание проблемной ситуации и формулировка темы урока.
Цель: мотивирование, включение в тему, формулирование темы
«Натрун» - сода, «алкали» - щелочь. «Литос» - камень. В 1860 – 1861г.г. в Германии Р.Бунзен и Г.Кирхгоф открыли рубидий «темно-красный» и цезий «небесно-голубой». В 1939г. во Франции М. Пере открыл радиоактивный элемент франций, который назвал в честь своей страны – Франции. О каких элементах пойдет речь на уроке? Сформулируйте тему урока. Запишите тему урока в тетрадь |
Слушают, анализируют, высказывают предположения, аргументируют их.
Предлагают формулировку темы урока, записывают тему урока в тетрадь |
| УЭ 3 Постановка учебных задач
| Метапредметные результаты: Регулятивные УУД: - самостоятельно обнаруживать и формулировать учебную проблему, определять цель учебной деятельности (формулировка вопроса урока). Познавательные УУД: - фиксирование индивидуального затруднения в пробном учебном действии Личностные УУД: - обладать учебно-познавательной мотивацией и интересом к учению. Коммуникативные УУД: - слушать и понимать речь других; - уметь с достаточной полнотой и точностью выражать свои мысли. | Цель: целеполагание, планирование этапов урока подумайте над вопросами: Какова формула следующих веществ и для чего нужны названные вещества? NaOH – едкий натр, каустическая сода. KOH - едкое кали. Na2CO310H2O –кристаллическая сода. NaHCO3 – пищевая сода. K2CO3 -поташ. Na2SO410H2O – глауберова соль. Используют для очистки нефтепродуктов, производства бумаги, мыла, волокон, стекла, удобрений. Применяют в медицине и фармакологии. Какова биороль К и Na? Почему металлы названы щелочными? Почему металлы боятся воды и воздуха? Как их хранят? Что еще вы хотели бы знать о щелочных металлах?
Сформулируйте цель урока и задачи на каждый этап урока?
|
Слушают вопросы , отвечают, анализируют , аргументируют свои ответы Самые распространенные соединения металлов и их применение
Na+- внутриклеточный ион, содержится в крови и лимфе, создает в клетках осмотическое давление. K+ - внеклеточный ион, поддерживает работу сердца и мышц. Большое количество калия содержится в кураге, сои, фасоли, зеленом горошке, черносливе, изюме.
Выполняют задания, констатируют факт затруднения выполнения задания и отмечают недостаточность имеющихся знаний и умений, высказывают предположения о цели и задачах урока |
| УЭ4 Осмыс-ление, запоминание | Метапредметные результаты:
Познавательные УУД: - давать характеристику процессов , называть их значимость , используя личный опыт - осуществлять анализ ситуаций, применять знания в новой ситуации - работать с текстом, рисунками и таблицами , трансформировать информацию из одной формы в другую, - в ходе работы создавать заданный продукт ( таблицу, схему, уравнение реакции, рисунок) Коммуникативные УУД: - задавать вопросы, необходимые для организации собственной деятельности и сотрудничества с партнёром; - работать в паре — устанавливать рабочие отношения, - работать в группе, эффективно сотрудничать и способствовать продуктивной кооперации - уметь слушать ответы и выделять главное, находить неточности и исправлять их, Личностные УУД: - обладать учебно-познавательной мотивацией и интересом к учению. Предметные УУД: - Знать характеристики металлов 1 А группы уметь делать выводы о роли химических знаний в жизни человека. оперировать основными терминами по теме. | Цель: изучение, осмысление, запоминание новых знаний, отработка новых умений Задание 1. Рассмотрим положение щелочных металлов в ПСХЭ и установим закономерности в строении атомов щелочных металлов: Составьте электронные формулы для щелочных металлов Определите состав атомов щелочных металлов Какова общая формула высших оксидов и водородного соединения для металлов 1 А группы? Закономерности: Сходство внешнего электронного слоя. Увеличение числа электронных слоев в атоме. Увеличение числа электронных слоев в атоме. Радиусы атомов увеличиваются от Li к Cs, следовательно увеличиваются и восстановительные свойства металлов от Li к Cs. Так, атом цезия способен превращаться в положительный ион уже под действием света. Это свойство используют в фотоэлементах. 
Задание 2. Дадим характеристику щелочным металлам как простым веществам по плану Тип и класс веществ Тип химической связи, тип кристаллической решетки, Т кипения и Т плавления Физические свойства СО Окраска пламени катионами металлов Работа с учебником ( стр.115) и справочными материалами свойства : тепло – и электропроводность, т.к. электроны подвижны и способны переносить тепло и направленно двигаться под действием электрического напряжения, пластичность, т.к. электроны подвижны и поэтому при ударе слои атомов – ионов в металле смещаются, как бы скользят без разрыва связей Щелочные металлы мягки (режутся ножом), температуры кипения и плавления уменьшаютсяот Li к Cs. Так цезий плавится на ладони руки. Плотность же возрастает от Li к Cs. (Только есть отступление от этого правила – плотность натрия больше, чем у калия). Li, Na и K легче воды. Степень окисления металлов I группы главной подгруппы в соединениях постоянная и равна +1
Задание 3. Установим химические свойства щелочных Металлов С какими веществами реагируют типичные металлы? щелочные металлы активно взаимодействуют почти со всеми неметаллами, например, с галогенами, серой, фосфором, водородом. Напишите уравнения реакций между литием и серой, натрием и фосфором, калием и хлором.
К какому типу относятся данные реакции? Какой тип связи характерен для соединений – продуктов реакций? Почему гидриды щелочных металлов не занесены в графу водородных соединений ПСХЭ? Назовите продукты реакций?
взаимодействию с кислородом. При этом в обоих случаях атом щелочного металла отдает один электрон, т.е. степень окисления не изменяется, а кислород изменяет свою степень окисления: – 2 в оксидах и – 1 в пероксидах.
взаимодействие их с водой. ак рубидий и цезий реагируют с водой так быстро, что происходит взрыв. Посмотрите, как реагирует с водой, например, натрий. 2 Na + 2 H2O = 2 NaOH + H2 ^
Демонстрация опыта. Напоминаю правила безопасности: нельзя вещества трогать руками, не приступать к выполнению опыта не зная, что и как нужно делать, работать с малыми дозами реактивов. На столе стоит кристаллизатор с водой. В воду заранее добавлен индикатор – фенолфталеин, о чем сообщаю учащимся. Отрезаю ножом кусочек натрия и бросаю в воду. Почему индикатор изменяет свой цвет? Какой газ выделяется в ходе реакции? К какому типу относится данная реакция какому элементу натрий отдает электроны, сколько? Покажите это на уравнении реакции. Аналогично с водой реагируют и все остальные щелочные металлы.
Щелочные металлы очень легко окисляются. Им достаточно и кислорода содержащегося в воздухе, поэтому их хранят под керосином, а литий в вазелине, т.к. он очень легок и в керосине всплывает. Также щелочные металлы надо беречь не только от кислорода, но и от воды. Щелочные металлы хранят очень тщательно в стеклянной банке с плотной крышкой, потом в железной.
ПРОБЛЕМНЫЙ ВОПРОС Скажите, почему мы не рассматриваем взаимодействие щелочных металлов с растворами солей и кислот?
Металлический натрий, с тех пор как его изготовление стало дешевым, находит широкое техническое применение. Его используют в качестве исходного продукта при производстве перекиси натрия и других соединений. Его используют также в больших количествах в органических синтезах (например, в красильном производстве). Металлический калий также иногда употребляют в лаборатории. Кроме того, калий и прежде всего цезий применяют в фотоэлементах. Металлический литий используют в сплавах, так как небольшие добавки этого металла существенно улучшают свойства многих сплавов. Также щелочные металлы используют в качестве катализаторов. Физминутка |
Дают характеристику элементов 1 А группы , записывают электронное строение атомов и состав атомов для щелочных металлов, записывают общие формулы и дают названия примерам, устанавливают закономерности
Записывают в тетради
Дают ответы на вопросы из материалов 9 класса, записывают уравнения реакции, устанавливают их тип, расставляют коэффициенты, комментируют уравнения
2Li + S = Li2S (сульфид лития) 2K + Cl2 = 2 KCl (хлорид калия) 3 Na + P = Na3P (фосфид натрия)
в результате взаимодействия щелочных металлов с неметаллами образуются бинарные соединения – сульфиды, хлориды, фосфиды и другие.
Литий образует нормальный основной оксид.4 Li + O2 = 2 Li2O (оксид лития) Остальные щелочные металлы образуют при взаимодействии с кислородом пероксиды и надпероксиды. 2 Na + O2 = Na2O2 (пероксид натрия)
Щелочные металлы окисляются молекулами воды, при этом образуются щелочи, отсюда и произошло их название – щелочные. Причем скорость реакции будет расти от Li к Cs, т.к. растет их химическая активность. Т Наблюдают , дают пояснения, пишут уравнение реакции, составляют электронный баланс, С водой –гидроксиды 2Ме + 2 Н2О = 2 МеОН + Н2 - С серой при растирании – сульфиды 2 Ме + S = 2 МеS - С водородом при нагревании – гидриды 2 Ме + Н2 = 2 МеН - С оксидами менее активных металлов Li Na K Rb Cs 2 Li + K2O = 2K + Li2O - С кислородом: литий образует оксиды, остальные надпероксиды и пероксиды 4 Li + O2 = 2 Li2O 2 Na + O2 = Na2O2 Na2O2 + 2 Na = 2 Na2O - С галогенами – галогениды F2, Br2, Cl2 -при обычных условиях I2 - только при нагревании 2 Ме + Наl2 = 2 MeHal так как в растворе щелочные металлы сначала энергично прореагируют не с кислотой и с солью, а с водой.
|
| УЭ 5 Применение, первичное закрепление

УЭ6 Рефлек-сия Подведение итогов Оценивание

УЭ7 Домашнее задание | Метапредметные результаты: Познавательные УУД: - применять полученные знания для выполнения заданий, - использовать информацию в нестандартных ситуациях Коммуникативные УУД: - управление поведением партнера, контроль, коррекция, оценка действий партнера Предметные УУД: - применять химические термины, символы и понятия. Регулятивные УУД: - самостоятельно контролировать своё время и управлять им. Личностные УУД: - приобретать личностно-значимый опыт
Коммуникативные: - анализирование своей работы и работы класса - самодиагностика - умение с достаточной полнотой и точностью выражать свои мысли; Познавательные: - рефлексия. Личностные УУД: - самоопределение
Метапредметные результаты: Познавательные УУД: - выбирать задания в соответствии с желаниями и возможностями -применять полученные знания для выполнения заданий, Коммуникативные УУД: - самооценка Предметные УУД: - применять полученную информацию для выполнения заданий, решений задач. Регулятивные УУД: - самостоятельно контролировать своё время и управлять им. Личностные УУД: - приобретать личностно-значимый опыт | Цель: первичное закрепление Самостоятельное применение знаний. Задание 1. Составьте уравнения реакций с кислородом:
а) лития ________________ ; б) натрия _______________ Расставьте степени окисления элементов, покажите стрелкой переход электронов. Назовите продукты реакций.
Допишите уравнения реакций с натрием:
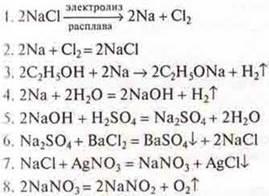
Задание 2. 
Цель: самодиагностика, самоанализ
Полезным ли был урок для вас? Что вы узнали нового? Где вы сможете применить полученные данные на практике?
Оценки за работу , комментирование оценок
Домашнее задание. Комментирование домашнего задания
Обязательный уровень: §19 , стр. 113 упр. 5
Дополнительный уровень : сообщение . В 100 г фасоли содержится 1,075 г калия. Сколько фасоли нужно съесть, чтобы получить суточную норму калия (5 г/сутки) 1) 465 г 2)0,053 г 3)107 г 4)21,5 г . В 100 г изюма содержится 3,055 г калия. Сколько изюма нужно съесть, чтобы получить суточную норму калия (5 г/сутки)? 1) 0,15 г 2) 164 г 3) 61,5 г 4) 305 г
|
Отвечают на вопросы, систематизируют знания, оформляют записи в тетради
Выполняют задания, проводят самопроверку и проверку в парах самооценивание
Выполняют задания , составляют уравнения полуреакций
Обобщают, отмечают свое отношение к уроку, к проблеме урока, выделяют положительные и негативные моменты. Оценивают свою работу на уроке.
Слушают комментарии и пояснения к выполнению домашнего задания, предполагают выбор заданий, проводят соизмерение своих возможностей и желаний, задают уточняющие вопросы. |