| 3 | Актуализация знаний
Слайд 1
Слайд 2
Постановка проблемы
| Организует повторение
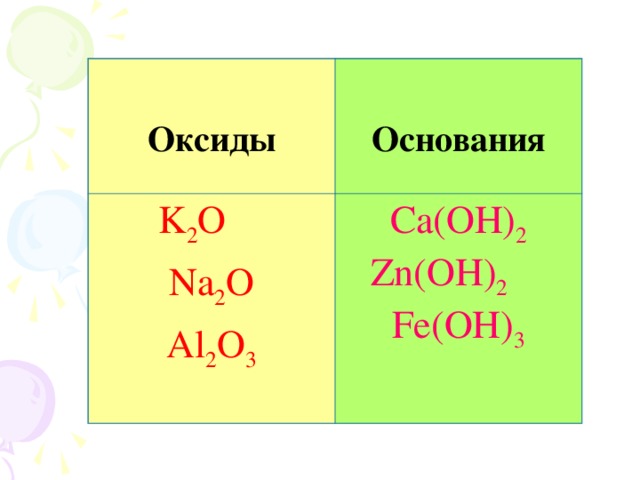
Из предложенных на слайде веществ, выпишите формулы оксидов, оснований. Объясните на основании чего вы это сделали. Дайте определения.
Предлагает выступить у доски одной из пар. Предлагает классу оценить работу товарищей.
Создает интеллектуальное затруднение: куда отнести оставшиеся формулы?
Ребята, какие у вас возникают ощущения при виде этих фруктов? (демонстрирую вазу с фруктами: лимоны, киви, апельсины) А почему они кислые? Подводит учащихся к целеполаганию. Отгадайте шараду.
| 1. Вспомните, как классифицируют сложные соединения? (На органические, неорганические)
2. Как классифицируют неорганические вещества? (На оксиды, основания, кислоты и соли).
3. Назовите, какие из них мы с вами уже изучили? (Оксиды и основания).
Работают в паре. Сначала каждый сам делит вещества, затем проверяет выбор товарища. Взаимопроверка и обсуждение в парах. Защита своей точки зрения.
Оценивают работу выступившей пары.
Испытывают затруднение в связи с наличием нового понятия. Возникает необходимость получения новых знаний.
(появление слюны, т.к. фрукты кислые)
(содержат какое-то вещество)
Шарада. | Мы первым слогом позовем кота,
Вторым измерим с судна толщу вод,
Союз на окончание пойдет,
И целым станет слово... (Кис-лот-а) |
| Коммуникативные: планирование учебного сотрудничества с учителем и сверстниками, обсуждают, приходят к общей точке зрения, Познавательные: логические – анализ объектов с целью выделения признаков Регулятивные управляют своим поведением и деятельностью, планируют работу, сравнивают свой результат с результатом товарища, анализируют правильность выполненных действий.
|
| 5 | Изучение нового материала
Слайды презентации | Да, сегодня мы с вами будем изучать еще один класс химических соединений - это кислоты 1.Что вы должны узнать об этих веществах после изучения этой темы? По происхождению кислоты бывают - органические и неорганические.
Название класса - "кислоты" указывает на то, что они имеют кислый вкус.
Ещё раз подчёркиваю, что в химическом кабинете ничего нельзя пробовать на вкус. Это - грубейшее нарушение техники безопасности. Но сегодня разрешаю вам определить вкус таблетки аскорбиновой кислоты или сока лимона, которые лежат на подносах. Какой же вывод можно сделать о вкусе кислот? Внимание! Кислоты требуют особого обращения. Учитель демонстрирует опыт №1.Действие концентрированной серной кислоты на целлюлозу. Концентрированной серной кислотой учитель делает надпись на белом листе бумаги. Бесцветная вначале надпись становится через несколько минут чёрной. Учитель проводит демонстрационный опыт №2. Растворение в воде концентрированной серной кислоты (с использованием документ камеры). Сильное разогревание содержимого сосуда учащиеся наблюдают с помощью градусника. Фиксируется внимание учащихся на том, что в связи с выделением большого количества теплоты при растворении концентрированной серной кислоты в воде нельзя вливать воду в серную кислоту. В этом случае вода, имеющая меньшую плотность, окажется на поверхности, закипит , и её брызги вместе с кислотой могут обжечь руки и лицо. Большое пристрастие серной кислоты к воде выражается и в том, что она "жадно" отнимает воду у органических веществ, вещество при этом обугливается. Действие кислот на индикаторы
Организует работу в группах. Консультирует. Направляет. Задает наводящие вопросы.
Многие кислоты встречаются в природе. А теперь с помощью эксперимента выясним, отличаются ли соляная и серная кислоты от кислот, входящих в продукты питания.
Не связано ли это с их общим строением, т.е. с наличием атомов водорода в молекулах?
Для того чтобы объяснить сходные свойства кислот, необходимо изучить их состав. Обратите внимание на состав кислот. Что общего в их строении? В них обязательно входит водород - он определяет основность кислоты. Вся остальная часть молекулы называется кислотным остатком. | Учащиеся записывают тему урока в тетрадь.
Запись в тетрадь: Кислоты органические неорганические
Учащиеся могут убедиться в том, что большинство кислот кислые на вкус (но встречаются и другие: горькие - никотиновая, сладкие - салициловая, безвкусные - стеариновая). Запись в тетрадь:
Вывод:
1. Большинство кислот кислые на вкус.
Кислоты разрушают кожу, ткани, древесину! Запись в тетрадь:
"Внимание!!"
Кислоты разрушают кожу, ткани, древесину! Учащиеся должны запомнить:
Кислоту надо приливать к воде, а не наоборот. В случае попадания кислоты на кожу следует промыть её водой и 5% раствором соды. (Сначала - вода, Затем - кислота - Иначе случится большая беда! Осторожно!
Нейтрализовать кислоту раствором соды, быстро смыть водой!
Кислоту надо приливать к воде, а не наоборот!!!
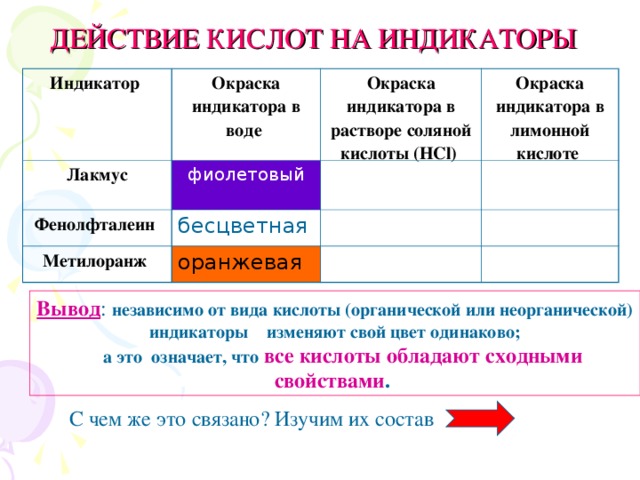
Доклад. Постепенно химики научились распознавать кислоты. Однажды английский химик Роберт Бойль, изучая свойства соляной кислоты, закупленной в Германии у И. Глаубера, случайно пролил её. Кислота попала на сине-фиолетовые лепестки фиалок. Спустя некоторое время лепестки стали ярко-красными. Это явление удивило Р. Бойля, и он тут же провёл серию опытов с разными кислотами и цветками разных растений. Оказалось, что и васильки, и розы, и цветки некоторых других растений изменяли свою окраску при действии кислот. Особенно интересным оказался фиолетовый настой лакмусового лишайника. В растворе кислот он становился красным. После некоторых раздумий такие вещества Р. Бойль назвал индикаторами, что в переводе с латинского языка означало "указатели". Эти вещества затем стали использовать многие химики в своих опытах. Лабораторная работа в группах(по 4 чел.) Учащиеся проводят соответствующие опыты, заполняют таблицу " ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ" (см. приложение № 5). Как изменил окраску лакмус в растворах соляной и лимонной кислот? Почему? Стал красным. Учащиеся действуют на соляную кислоту, на сок лимона, индикатором и отмечают изменение окраски лакмуса. На основании проведенных опытов сделаем выводы: независимо от вида кислоты (органической или неорганической) индикаторы изменяют свой цвет одинаково; а это означает, что все кислоты обладают сходными свойствами. С чем же это связано? Делают вывод: индикаторы изменяют свой цвет в растворах кислот, это общее свойство кислот, которое обусловлено особенностями их строения.
В их состав входят атомы водорода. | Коммуникативные: инициативное сотрудничество в поиске и выборе информации, Познавательные: моделирование, логическое (решение проблемы, построение логической цепи рассуждения, доказательство, выдвижение гипотез и их обоснование) Регулятивные: планирование, прогнозирование |
|
|
| Следовательно, мы можем дать определение классу кислот. Прочитайте формулы кислот. 1. Что общего во всех этих формулах? 2. На каком месте в формуле кислоты записывают знак водорода? Если закрыть водород, то остальная часть молекулы называется кислотным остатком.
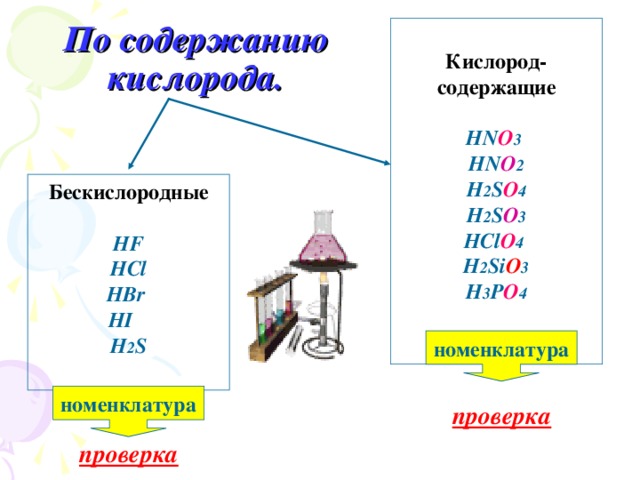
Состав кислотных остатков различен: в одни входит кислород, в другие - нет.
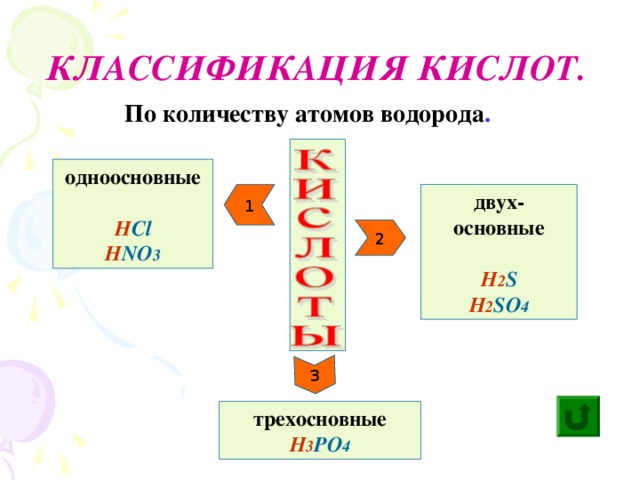
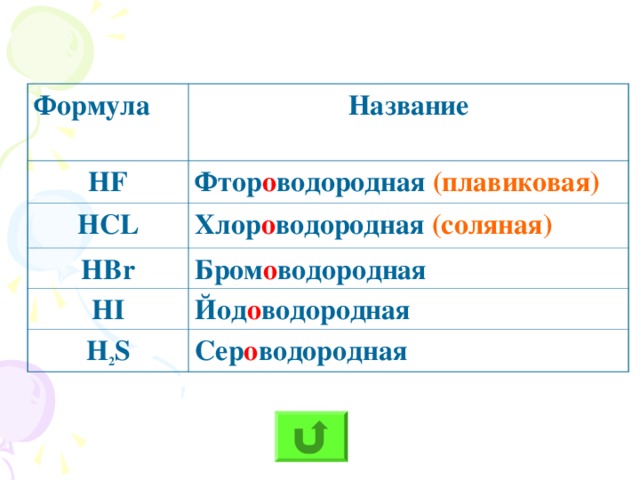
Классифицируем кислоты по двум признакам: 1. по числу атомов водорода: (по основности) - одноосновные, - двухосновные, - трёхосновные; 2. по наличию кислорода в кислотном остатке: - кислородсодержащие, - бескислородные. Номенклатура кислот (на примере соляной, серной, сернистой кислот) | Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (Атомы водорода)
(На первом).
Запись в тетрадь:
НR (кислоты) - это сложные вещества, состоящие из атомов водорода и кислотного остатка (R). Н - обуславливает общие свойства кислот. R-специфические Заполняют таблицу. Приложение № 1 Запись в тетрадь:
Классификация кислот 1) по числу атомов водорода 2)по наличию кислорода в кислотном остатке: (основность кислоты определяется числом атомов водорода): | одноосновные | двухосновные | трехосновные | | НСl | H2SO4 | H3PO4 | | соляная | серная | ортофосфорная | По содержанию атомов кислорода в кислотном остатке: | кислородсодержащие | бескислородные | | HNO3
азотная | H2S
сероводородная | | H2SO4
серная | HCl
соляная |
|
|
| 7 | Закрепление материала Слайды презентации
Рефлексия
Д/З | А теперь проверим, что вы узнали о классификации кислот
1) Найдите формулы кислот. Разместите их в таком порядке, чтобы внизу получилось название индикатора.
KCl, H2SO4, О3, HCl, BaO, NaOH, H3PO4,H2CO3, CO2, HNO3, H2, H2SO3, CuF2.
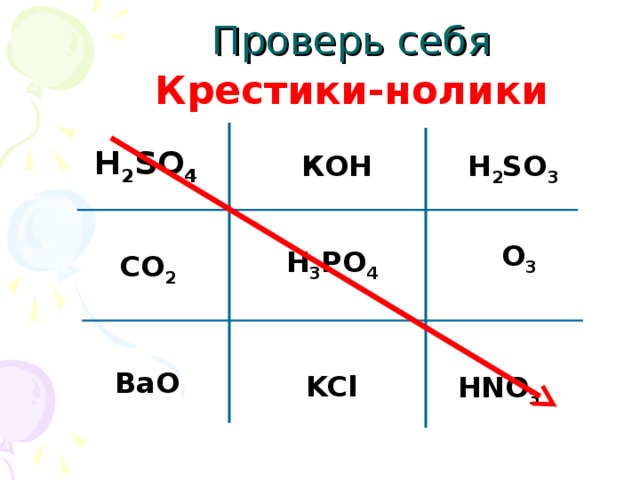
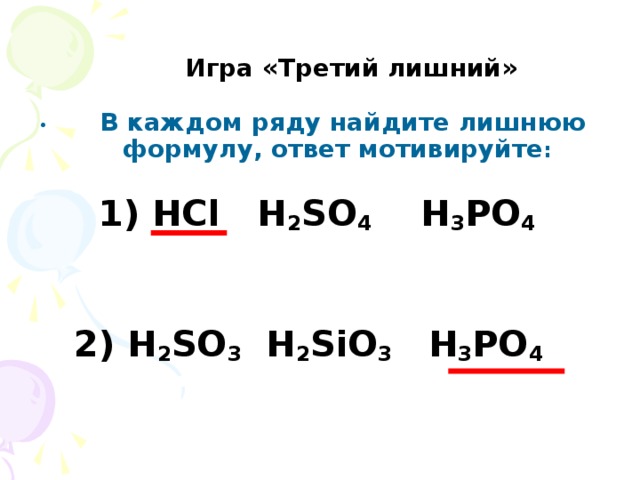
б л о а в г к м и у е с д Провести игру "Крестики-нолики", "Третий лишний".
Спасибо за внимание. Я довольна вашей работой, но моей оценки недостаточно, ответьте пожалуйста на следующие вопросы
Учитель подводит итог урока. Отмечает активных ребят, объявляет оценки и задаёт домашнее задание
Комментирование домашнего задания.
| Классифицируют формулы кислот HCl, H2SO4, H2S, H3PO4, H2SO3, HBr, HNO2, HNO3, H2CO3,H2SiO3 по следующим признакам. 1. кислородсодержащие, 2. бескислородные, 3. одноосновные, 4. двухосновнные. (номер кислоты по счету соответствует букве) - лакмус Приложение № 2
Приложение № 3 1. Я узнал(а) много нового. 2. Мне это пригодится в жизни. 3. На уроке было над чем подумать. 4. На все возникшие у меня вопросы, я получил(а) ответы. 5. На уроке я поработал(а) добросовестно.
Ответы учащихся Записывают в дневники домашнее задание. | Регулятивные: Контроль, оценка, коррекция Коммуникативные: Управление поведением партнера (контроль, коррекция, оценка действий партнера)
Личностные: смыслообразование Коммуникативные: умение с достаточной полнотой и точностью выражать свои мысли Познавательные: рефлексия
|