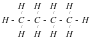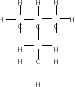Органическая химия. Теория химического строения А.М. Бутлерова.
1. До начала 19-века все известные вещества делили по их происхождению на две группы: вещества минеральные и вещества органические. Многие ученые тех времен считали, что органические вещества могут образоваться только в живых организмах при помощи "жизненной силы". Такие взгляды назывались виталистическими. Большой удар взглядам виталистов нанес немецкий химик Ф. Велер. Он первые получил органические вещества из неорганических: в 1824 г. – щавелевую кислоту, а в 1828 г. – мочевину. Щ. к. встречается в растениях, а мочевина образуется в организме человека и животных.
Большинство неорганических веществ немолекулярного строения, и поэтому они обладают высокими температурами плавления и кипения. Органические вещества, как правило, молекулярного строения, и поэтому они имеют низкие температуры плавления. В состав молекул всех органических веществ входит углерод. Органическая химия – это раздел химической науки, в котором изучаются соединения углерода и их превращения. Органические вещества – углеродосодержащие вещества, которые образуются в живых организмах, которые синтезируются.
2. Первые попытки создания теории.
а) Теория радикалов (Берцелиус).
Берцелиус полагал, что органические вещества построены из двух частей -радикалов. Он считал, что радикалы сохраняются неизменными во время химических реакций.
б) Теория типов (Жерар).
Жерар предложил рассматривать каждое вещество как единое целое. Он считал, что все органические соединения являются производными простейших неорганических веществ: водорода, хлористого водорода, воды и предложил несколько типов.
I тип - водорода II тип – хлористого водорода
III тип – воды
в) Важным этапом был съезд химиков в Карлсруэ в 1860 году, где были развиты и подтверждены идеи атомистики.
г) В результате работ Э. Франкланда и Кекуле в химии утвердилось понятие о валентности, и, в частности, было развито представление о 4-валентности углерода (Кекуле).
д) А в 1857 году Ф. А. Кекуле и А. С. Купер выдвинули идею о соединении атомов углерода в цепи.
Вывод: все эти успехи науки подготовили условия для нового этапа в развитии органической химии - появление теории химического строения органических соединений.
Основные положения теории химического строения А. М. Бутлерова и их доказательства.
Эти положения А. М. Бутлеров сформулировал в 1858 - 1861 годах.
1-е положение. Атомы в молекулах реально существуют. Доказательство данного положения
В 1828 г. ученик Я. Берцелиуса - немецкий ученый Ф. Веллер из неорганических веществ впервые синтезировал органическое вещество - мочевину.
2-е положение. Соединение атомов в молекулы происходит не в беспорядке, а в определенной последовательности, согласно их валентности. Углерод в соединениях четырехвалентный.
3-е положение. Свойства веществ зависят не только от качественного и количественного состава, но и от порядка соединения атомов в молекуле (явление изомерии).
Доказательство данного положения
Изучая строение молекул углеводородов, А. М. Бутлеров пришел к выводу, что у этих веществ, начиная с бутана (С4Н10), возможен различный порядок соединения атомов при одном и том же составе молекул.Так, в бутане возможно двоякое расположение атомов углерода: в виде прямой (неразветвленной) и разветвленной цепи.
б)
а)
C4H10
изобутан (toкип.=-11,7оС)
бутан (toкип.=-0,5оС)
Вещества, имеющие одинаковый состав молекул (одну и ту же молекулярную формулу), но различное химическое строение и обладающие поэтому разными свойствами, называются изомерами.
Вывод: Наличие изомеров – одна из причин многообразия органических соединений.
4- ое положение. По свойствам данного вещества можно определить строение его молекул, а по строению – предвидеть свойства.
Если данное вещество изменяет окраску фиолетового лакмуса на розовый цвет, взаимодействует с металлами, стоящими до водорода, с основными оксидами, основаниями, то мы можем предположить, что это вещество относится к классу кислот, в своем составе имеет атомы водорода и кислотный остаток. И, наоборот, если данное вещество относится к классу кислот, то проявляет вышеперечисленные свойства.
Например: H2SO4 – серная кислота
H2SO4 – H+ + HSO4-
HSO4-H+ + SO42-
H2SO4- 2H++SO42-
Zn + H2SO4=ZnSO4 + H2
CuO + H2SO4 =CuSO4+ H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
5-ое положение. Атомы и группа атомов в молекулах веществ взаимно влияют друг на друга.
Для этого надо сравнить свойства водных растворов NH3, HCl, H2O
NH4OH + лакмус = синий цвет среда щелочная
HCl + лакмус = розовый цвет среда кислая
H2O + лакмус = остается фиолетовым среда нейтральная
Во всех трех случаях в состав веществ входят атомы водорода, но они соединены с разными атомами, которые указывают различное влияние на атомы водорода, поэтому свойства веществ различны.
Электронная природа химических связей органических соединениях. Способы разрыва связей.
А) Органические соединения отличаются от неорганических тем, что первые обладают молекулярным строением. В молекуле органических веществ между атомами существуют только ковалентные связи, неполярные или с небольшой полярностью. Эти связи образуются также за счет перекрывания s-s, s-p p-p. Электронных облаков. В случае образования ковалентной полярной связи область перекрывания электронных облаков смещается к более электроотрицательному элементу, который получает частичный отрицательный заряд, а другой элемент от которого оттянута электронная плотность – частичный положительный заряд.
Б) Химические реакция представляют собой единство двух противоположных процессов – разрыва одних связей и образования новых.
Существует два вида разрыва ковалентной связи: 1 – Способ –ионный А :В- А+ + :В- А: В – А:- + В+
2- способ – свободнорадикальный А:В = А*+ В* свободный радикал
Частицы имеющие неспаренные электроны, называются свободными радикалами. H+I-= H+ + I- 2H:I =2H*2I*
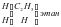
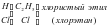
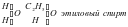
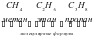
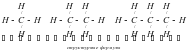

 Изучая строение молекул углеводородов, А. М. Бутлеров пришел к выводу, что у этих веществ, начиная с бутана (С4Н10), возможен различный порядок соединения атомов при одном и том же составе молекул.Так, в бутане возможно двоякое расположение атомов углерода: в виде прямой (неразветвленной) и разветвленной цепи.
Изучая строение молекул углеводородов, А. М. Бутлеров пришел к выводу, что у этих веществ, начиная с бутана (С4Н10), возможен различный порядок соединения атомов при одном и том же составе молекул.Так, в бутане возможно двоякое расположение атомов углерода: в виде прямой (неразветвленной) и разветвленной цепи.