Арены. Бензол
Цель: сформировать представление обучающихся о строении бензола, познакомить с его физическими и химическими свойствами, способами получения и рассмотреть применение бензола.
Задачи:
- образовательные: обеспечение усвоения обучающимися основных понятий темы: бензол, реакция присоединения, реакции замещения, реакция тримеризация ацетилена.
- развивающие: развитие химического языка, обучение составлению уравнений химических реакций для бензола, навыков работы с компьютером.
- воспитательные: привитие познавательного интереса к химии, развитие мыслительной деятельности и познавательной активности.
Оборудование: мультимедиа, компьютеры.
Методы: наглядно – иллюстративный, эвристический.
Формы: фронтальная беседа, вопросно – ответная форма, индивидуальная,
Ход урока.
- Организационный момент.
- Мотивация учащихся.
Мы с вами уже изучили предельные углеводороды - алканы, непредельные углеводороды - алкены, алкадиены, алкины. Сегодня мы с вами познакомимся с ароматическими углеводородами или аренами. Определите симантику слову ароматические (аромат). Дайте лексическое значение слову аромат. Почему эти вещества названы ароматическими? Ароматическими эти углеводороды были названы потому, что первые известные представители их обладали приятным запахом. Позднее оказалось, что большинство веществ, которые принадлежат к этой группе не имеют ароматного запаха. Однако исторически сложившееся название этих соединений осталось. Простейший и самый важный представитель ароматических углеводородов – бензол. Мы познакомимся со строением, изучим удивительные свойства бензола, узнаем о его применение в народном хозяйстве, посмотрим занимательные опыты.
III. Изучение нового материала.
1. Понятие об аренах.
- Откройте тетрадь, запишите сегодняшнее число и тему урока «Арены. Бензол».
Арены – углеводороды с общей формулой CnH2n-6, молекулы которых, содержат бензольное кольцо. Молекулярная формула бензола C6H6А теперь давайте рассмотрим историю его открытия. Слушая мой рассказ и просматривая слайды сделайте краткий конспект истории открытия бензола.
2. История открытия
Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменно-угольной смолы. Но ни названия вещество не получило, ни состав его не был известен.
Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году английским физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа
В 1833 году немецкий физико-химик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли бензойной кислоты (именно от этого и произошло название бензол)
Проверим ваши конспекты.
Мы узнали о истории его открытии теперь посмотрим какое же строение имеет молекула бензола
Строение молекулы бензола.
В 1865г. Кекуле предложил структурную формулу бензола.
Как вы видите, молекула соответствующая формуле Кекуле, содержит двойные связи, следовательно для него характерны должны качественные реакции на кратные связи.
А какие качественные реакции характерны для алкенов и алкинов? (Обесчвечивание перманганата калия и бромной воды)
Но бензол не обесчвечивает перманганата калия и бромную воду. Пытаясь объяснить эти несоответствия, многие ученые предлагали различные варианты структуры бензола.
В настоящее время бензол обозначают или формулой Кекуле или что наиболее логично шестиугольником, в котором изображают окружность. Молекула бензола имеет циклическое строение.
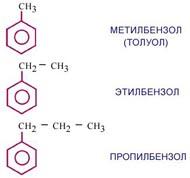
Гомологи бензола.
А теперь познакомимся с гомологами бензола. Какие вещества называют гомологами? (это вещества, сходные по составу и свойствам и отличающиеся на одну или более групп - CH2)
Следующий момент урока – получение бензола.
4. Получение бензола.
Бензол получают из каменноугольной смолы, образующейся при коксовании угля.
В настоящее время бензол получают из нефти.
Бензол получают синтетическими методами.
Одним из синтетических способов - тримеризация ацетилена.
Теперь посмотрим какими же физическими свойствами обладает это вещество.
5. Физические свойства.
По ходу моего рассказа запишите основные свойства.
· Бензол представляет собой бесцветную жидкость с температурой кипения +80ºС и температурой плавления + 5ºС.
· Он обладает характерным запахом, токсичен.
· Легче воды и не растворяется в ней.
Что вы для себя отметили.
Рассмотрев физические свойства бензола можно перейти к изучению химических свойств.
6. Химические свойства.
1. Бензол горит. (Просмотр опыта) Пламя бензола коптящее из-за высокого содержания углерода в молекуле.
2 C6 H6 + 15 O2 → 12CO2 + 6H2O
Расставьте коэффициенты в уравнении.
Из-за особенного строения молекулы, бензол занимает как бы промежуточное положение между алканами иалкенами, т.е. может вступать в реакции присоединения, так и в реакции замещения. Однако, в отличие от алканов, реакции замещения с бензолом протекают легче, а реакции присоединения – труднее, чем у алкенов.
2. Реакции замещения в бензоле протекают легче, чем в алканах.
а) реакция галогенирования (просмотр опыта).
А теперь сами напишите как бензол будет реагировать с хлором.
б) реакция нитрования – взаимодействие с азотной кислотой.
Нитробензол – исходное соединение для получения анилина.
3. Реакции присоединения в бензоле протекают труднее, чем в алкенах.
а) реакция гидрирования
б) реакция хлорирование.
Несмотря на высокую непредельность молекулы бензола (по составу), он не дает характерных, качественных реакций для непредельных углеводородов: не обесцвечивает бромную воду и раствор перманганата калия.
Это связано с особым строением молекулы бензола.
Какие реакции характерны для бензола?
А теперь узнаем где находит применение бензол
7. Применение бензола.
1-добавка к бензину;
производство
2-растворителей;
3-ацетона;
4-анилина;
5-фенола;
6-пестицидов;
7-лекарств;
8-фенолформальдегидных пластмасс.
IV. Закрепление.
Проверить полученные на уроке знания предлагаю, вам с помощью комбинированного задания I группа работает с тестом (см. приложение), II группа решает задачу.
Задача
Из 7,8 г бензола получено 8,61 г нитробензола. Определите выход (в%) продукта реакции.
7,8г 8,61 г
C6H6 + HNO3 → C6H5NO2 + H2O
n = 1 моль n = 1 моль
M = 78 г/моль M = 123 г/моль
m = 78 г m = 123г
7,8 г/78 г = х/123г
х = 7,8 *123 / 78 = 12,3 г
12,3 г – 100%
8,61 г – х %
х = 70%
V. Рефлексия.
Чтобы урок остался в памяти, выскажите свое мнение, продолжив предложение. На уроке я узнала, что….