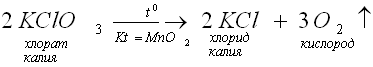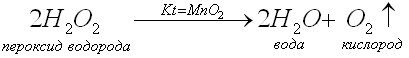| Агрегатное состояние – газ. Цвет – без цвета Запах – без запаха Растворимость в воде – плохо растворим t° кип. – 183°С Электропроводность – неэлектропроводен Теплопроводность – плохо проводит тепло (плохая) Тяжелее воздуха Тест Часть А. 1. Чтобы доказать наличие в сосуде кислорода, а не воздуха, проще всего использовать: А) разницу в плотности воздуха и кислорода; Б) совпадение цвета; В) тлеющую лучинку; Г) разницу в степени растворимости в воде 2. Впервые об открытии кислорода сообщил: A) К. Шееле;
Б) Д. Пристли; B) А. Лавуазье;
Г) М.Ломоносов.
3. Свойство вещества кислорода: А) газ с резким запахом; Б) твердое вещество; В) тяжелее воздуха; Г) газ желто-зеленого цвета. Часть В. 4. Для получения кислорода в лаборатории мы не использовали вещество, формула которого: а) H2O; б) KMnO4; в) H2O2; г) Fe3O4. Часть С. 5. Почему в историю открытия кислорода записана фамилия Пристли как первооткрывателя, а не Шееле? A) Он первым получил кислород в истории химии; Б) Он первым опубликовал свою работу по получению кислорода; B) Он первым поставил биологические опыты; Г) Он первым установил, что кислород содержится в воздухе. Тест Вариант 2. Часть А. 1. Самый распространенный элемент в земной коре? А) железо; Б) кислород; В) кремний; Г) алюминий. 2. Кислород впервые был получен:
А) нагреванием бертолетовой соли; Б) разложением воды электрическим током; В) разложением перманганата калия; Г) разложением оксида ртути (II) при нагревании. 3. В каком веке был открыт кислород?
А) XVII; Б) XVI; В) XVIII; Г) XIX. Часть В. 4. Кислород можно получить в лаборатории и собрать: А) вытеснением воды и воздуха в пробирку, расположенную отверстием вниз; Б) над водой и вытеснением воздуха в пробирку, расположенную дном вниз; В) только вытеснением воды; Г) только вытеснением воздуха в пробирку, расположенную дном вниз. Часть С. 5. Что делать, если пролилась ртуть? А) Оставить её испаряться. Б) Засыпать измельчённой серой и удалить через некоторое время. В) Аккуратно собрать, и выбросить в мусорный ящик. Г) Собрать ртуть и вылить в раковину. Вычеркните неверные суждения. Самопроверка. В промышленности получают из воздуха. Сложное вещество. При обычных условиях бесцветный газ. Собирают вытеснением воздуха В природе встречается только в составе сложных веществ. Собирают в перевернутый вверх дном сосуд. В лаборатории получают из перекиси водорода. Газ, имеющий запах. Поддерживает горение. Тяжелее воздуха. Входит в состав минералов, горных пород, песка, воды. При обычных условиях жидкость. Входит в состав воздуха. Образуется в природе в процессе фотосинтеза. | 


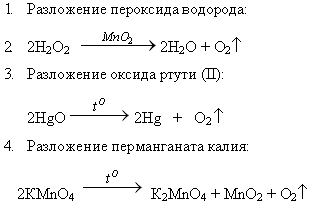
 Учитель: Кислород можно получить и разложением других кислородсодержащих веществ в присутствии катализаторов.
Учитель: Кислород можно получить и разложением других кислородсодержащих веществ в присутствии катализаторов.