Муниципальное бюджетное общеобразовательное учреждение
«Гимназия №32»
г.Нижнекамск Республика Татарстан
Конспект урока по химии
в 9 классе
«Фосфор»
Подготовила:
учитель химии
Валеева Елена Николаевна
Нижнекамск 2015
Цели урока:
Образовательная: изучить строение атома фосфора, его аллотропные модификации, физические и химические свойства простого вещества фосфора, применение.
Развивающая: создать условия для развития умений учащихся анализировать, обобщать, делать выводы, сравнивать.
Воспитательная: способствовать развитию навыков коммуникативного общения учащихся .
Тип урока: урок изучения нового материала.
Средства обучения:
кадры из фильма «Собака Баскервилей»,
компьютерная презентация,
мультимедийное учебное пособие «Виртуальная лаборатория»
периодическая система Д. И. Менделеева,
ХОД УРОКА
Организационный момент.
Здравствуйте те, кто весел сегодня!
Здравствуйте те, кто грустит!
Здравствуйте те, кто общается с радостью!
Здравствуйте те, кто молчит!
Здравствуйте, ребята.
Актуализация знаний.
Наш урок я предлагаю начать с кадров из фильма «Собака Баскервиллей», по одноименному произведению Конан Дойля из серии «Приключения Шерлока Хомса».
(кадры из фильма с бегущей собакой)
Сам автор этот момент описывает так:
“...Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана...»
- Как вы считаете, почему, светится маска на морде чудовища? Какое простое вещество обладает таким свойством светиться в темноте? О каком химическом элементе идет речь? (обсуждение в группах)
(Учащиеся однозначно говорят, что это фосфор)
Вот в какой неприятной истории оказался замешан элемент №15. Но могло ли быть такое в действительности, имеет ли фосфор такие свойства, прав ли был А.Конан-Дойл? Выясним сегодня на уроке.
- Как вы уже, наверное, поняли тема урока сегодня «Фосфор и его соединения».
Сегодня на уроке мы с вами рассмотрим строение атома фосфора, изучим его физические и химические свойства, его аллотропные модификации. (слайд 2)
Изучение нового материала
1. Характеристика элемента алюминия по его положение в ПСХЭ Д.И.Менделеева. Строение атома.
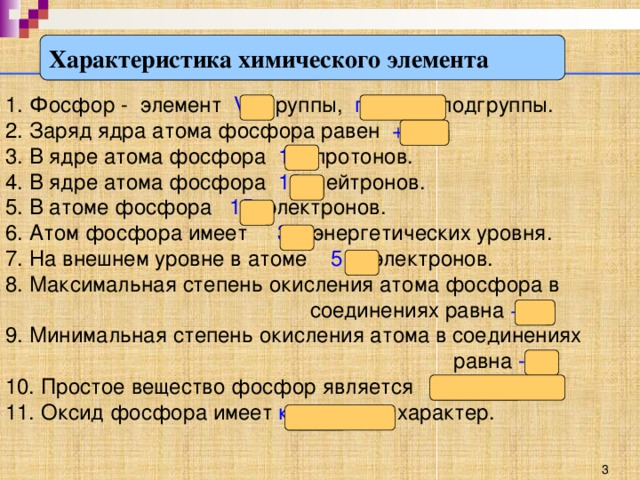
Перед вами периодическая система химических элементов Д.И.Менделеева. (слайд 3) Все элементы расположены в периодах и группах. Сейчас я вам предлагаю найти фосфор и дать ему характеристику по положению в Периодической системе, а именно, вставить пропущенные слова в тексте
Фосфор - элемент __________ группы, __________ подгруппы
Заряд ядра атома фосфора равен ______
В ядре атома фосфора __________ протонов.
В ядре атома фосфора _________ нейтронов.
В атоме фосфора ________ электронов.
Атом фосфора имеет _________ энергетических уровня.
На внешнем уровне в атоме фосфора _________ электронов.
Максимальная степень окисления атома фосфора в соединениях равна ________.
Минимальная степень окисления атома фосфора в соединениях равна ________.
Простое вещество фосфор является ____________.
Оксид фосфора имеет ___________________ характер.
Предполагаемые ответы:
Фосфор - элемент 5 группы, главной подгруппы
Заряд ядра атома фосфора равен 15
В ядре атома фосфора 15 протонов.
В ядре атома фосфора 16 нейтронов.
В атоме фосфора 15 электронов.
Атом фосфора имеет 3 энергетических уровня.
На внешнем уровне в атоме фосфора 5 электронов
Максимальная степень окисления атома фосфора в соединениях равна +5
Минимальная степень окисления атома фосфора в соединениях равна --3.
Простое вещество фосфор является неметаллом.
Оксид фосфора имеет __ кислотный _ характер.
Какой вывод мы можем сделать о положении фосфора в ПС?
Предполагаемые ответы:
Фосфор – химический элемент 5 группы главной подгруппы. В ядре фосфора 15 электронов, 15 протонов, 16 нейтронов. Все электроны расположены на 3 энергетических уровнях. На внешнем энергетическом уровне находится 5 электронов. Максимальная степень окисления атома фосфора в соединениях равна +5. Минимальная степень окисления атома фосфора в соединениях равна -3.
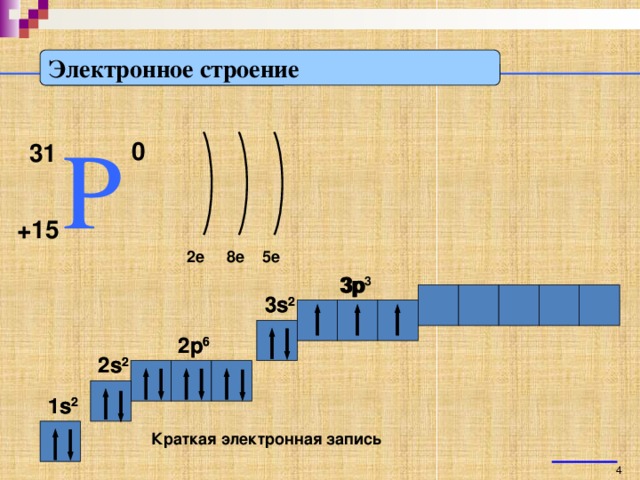
А теперь познакомимся с электронным строением атома фосфора более подробно:
Заряд ядра атома фосфора +15. Атом имеет три энергетических уровня, на перовом энергетическом уровне 2 электрона, на 2 – 8 е, на 3 – 3е. Посмотрим на порядок заполнения энергетических уровней. (слайд 5)
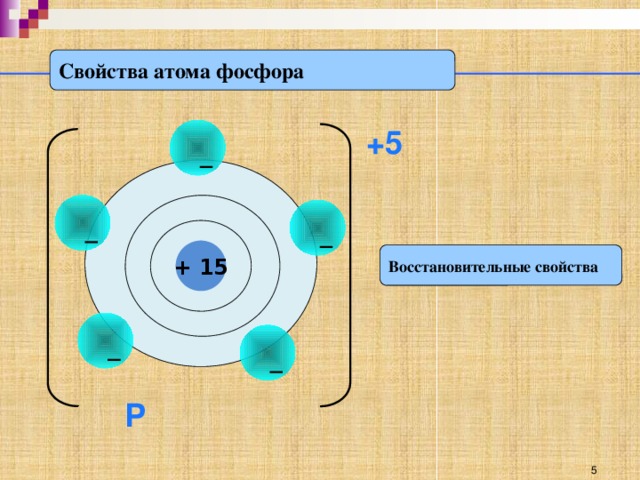
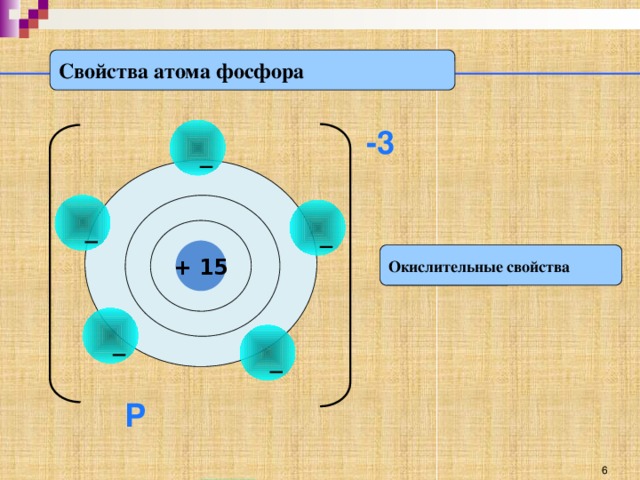
Как вы видите по краткой электронной записи, на последнем энергетическом уровне атома фосфора находится 5 электрона, которые атом в ходе химической реакции может отдать, проявляя при этом положительную степень окисления +5 и являясь восстановителем. (слайд 6) Или, наоборот, принять 3 электрона до полного заполнения 3 энергетического уровня, проявляя отрицательную степень окисления -3 и являясь при этом окислителем. (слайд 7)
Какой вывод можно сделать о свойствах атома фосфора на основе его электронного строения.
Предполагаемые ответы:
Фосфор в ходе химической реакции может проявлять окислительные и восстановительные свойства.
2. Физические свойства фосфора, как простого вещества.
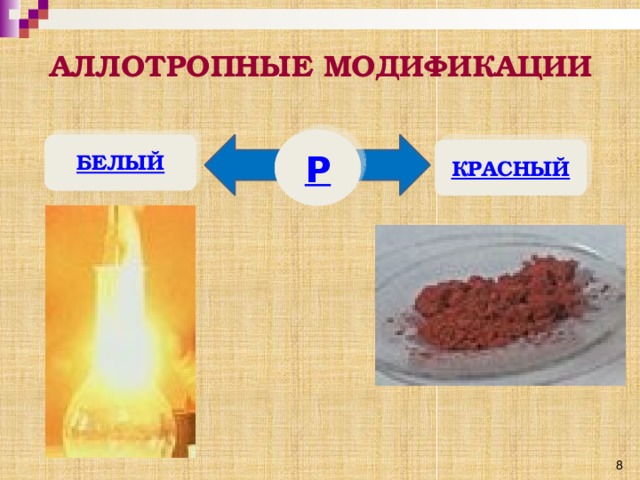
Фосфор в свободном состоянии образует аллотропные модификации. Важнейшие из них: белый и красный фосфор.(слайд 8) Они взаимосвязаны и способны переходить друг в друга. (Видеоопыт «Превращение красного фосфора в белый»)
Проведем сравнительную характеристику физических свойств фосфора и посмотрим, как эти свойства связаны со строением. На основе материала учебника п. 28 стр. 159 заполните таблицу «Сравнительная характеристика аллотропных модификаций фосфора» (слайд 9)
(работа в группах)
| Свойства | Рбелый | Ркрасный |
| Строение |
|
|
| Растворимость в воде |
|
|
| Растворимость в сероуглероде |
|
|
| Действие на организм |
|
|
| Способность к свечению |
|
|
Предполагаемые ответы:
| Свойства | Рбелый | Ркрасный |
| Строение |
молекулярное |
атомное
|
| Растворимость в воде | нерастворим | нерастворим |
| Растворимость в сероуглероде | растворим | нерастворим |
| Действие на организм | ядовит | не ядовит
|
| Способность к свечению | светится в темноте | не светится в темноте |
(Проверка со слайда )
Что вы можете сказать о белом фосфоре? Дайте ему характеристику.
Предполагаемые ответы:
Белый фосфор имеет молекулярное строение, нерастворим в воде, зато растворим в сероуглероде, ядовит, светится в темноте.
Что вы можете сказать о характеристики красного фосфора?
Предполагаемые ответы:
Красный фосфор имеет атомное строение, нерастворим в воде и в сероуглероде, не ядовит, не светится в темноте.
3. Химические свойства фосфора.
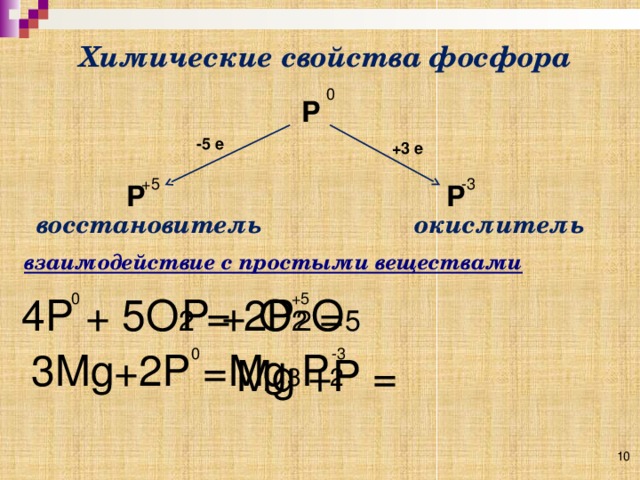
На основе строения атома мы выяснили, что простое вещество фосфор - довольно активный неметалл способен проявлять как окислительные, так и восстановительные свойства (слайд )
Р0


-5е +3е
Р+5 Р-3
восстановитель окислитель
Взаимодействие с простыми веществами:
Фосфор реагирует с простыми веществами, например, с кислородом.
Задание: Допишите уравнения реакций взаимодейстия фосфора с кислородом в тетради, расставте коэффициенты, назовите полученное вещество. Какие свойства проявляят фосфор в этой химической реакции?
(Видеоопыт «Горение белого и красного фосфора)
Р + О2
Предполагаемые ответы:
4 Р +5 О2 2 Р2О5
Фосфор является восстановителем, он изменяет степень окисления
от 0 до +5
(проверка со слайда )
Фосфор взаимодействует и с металлами, например с магнием. Продуктами реакции являются фосфиды металлов.
Задание: Допишите уравнение химической реакции в тетради, расставте коэффициенты. Какие свойства проявляят фосфор в этой химической реакции?
Мg + Р
Предполагаемые ответы:
3Мg + 2Р Mg3Р2
Фосфор является окислителем, он изменяет степень окисления
от 0 до -3
(проверка со слайда )
Какой вывод мы можем сделать о химической активности фосфора?
Предполагаемые ответы:
Фосфор – химически активный неметалл.
Физкультминутка:
Групповая работа:
1 группа:
Допишите уравнение реакции взаимодействия фосфора с бертолетовой солью, зная, что в данной реакции фосфор является восстановителем, расставьте коэффициенты:
Р + КClО3 =
2 группа:
Из набора продуктов выберите те, в состав которых входит фосфор.
(учебник)
3 группа:
Какая кислота соответствует атому фосфора, назовите ее, запишите формулу кислоты, назовите соли этой кислоты. (учебник )
4 группа:
Каково применение и его соединений? (учебник )
Предполагаемые ответы:
1 группа: 6Р0 + 5КClО3 =3 Р+52О5 + 5КCl
Посмотрим видеоопыт «Взаимодействие фосфора и бертолетовой соли». Такую же реакцию можно наблюдать и при зажигании спички (Опыт «Зажигание спички») В головке спичек содержится бертолетова соль, в намазке шкурки – красный фосфор.
Не всегда были спички так безопасны. В 1867 г. от ожогов скончалась итальянская эрцгерцогиня Матильда, которая случайно наступила на спичку, – ее платье было мгновенно охвачено пламенем. В те времена спички были весьма опасны: мало того, что зажигались они очень легко, а порой и неожиданно, в них содержался сильно ядовитый белый фосфор.
2 группа:
Вещества, содержащие фосфор – мясо, молоко, хлеб, яйца.
3 группа:
Фосфорная кислота.
Соли фосфорной кислоты:
средние – фосфаты, нерастворимы в воде
кислые – гидрофосфаты и дигидрофосфаты, большинство хорошо растворимы в воде.
4 группа:
Применение красного фосфора:
производство спичек;
производство фосфорной кислоты
производство ядохимикатов.
III Закрепление изученного материала.
Предлагаю посмотреть следующий отрывок из фильма «Собака Баскервилей»(видеофрагмент)
Как вы считаете, произведение А. Конан-Дойля это реальность или художественный вымысел? Все ли здесь верно с химической точки зрения или в этом сюжете допущена существенная химическая ошибка?
(обсуждение в группах)
Предполагаемый ответ:
Белый фосфор – ядовитое вещество, которое способно самовоспла-
меняться, поэтому, собака измазанная белым фосфором должна была загореться.
IV Итог урока
Сегодня на уроке мы познакомились с неметаллом фосфором, изучили его строение, физические и химические свойства. Какой мы можем сделать вывод о положении неметалла в периодической системе и его химической активности?
Предполагаемый ответ:
Фосфор – химический элемент 5 группы главной подгруппы. В ядре фосфора 15 электронов, 15 протонов, 16 нейтронов. Все электроны расположены на 3 энергетических уровнях.
Фосфор – химически активный неметалл. Он взаимодействует с простыми и сложными веществами.
Фосфор в ходе химической реакции может проявлять окислительные и восстановительные свойства.
Класс по результатам урока оценивается.
V Домашнее задание:
§ 28 в. 1, 3, стр. 163– «4»
«5» - творческое задание:
Составить кроссворд, в котором ключевым словом является тема нашего урока «Фосфор» или ребус по данной теме.
А я вам предлагаю свою версию кроссворда:
Галоген, который входит в состав зубной пасты.
Газ, поддерживающий дыхание и горение.
Как называется соединение химического элемента с кислородом.
Неметалл – самый сильный окислитель.
Газ, являющийся основной частью воздуха.
Самый легкий газ, который можно использовать в качестве экологически чистого топлива.
|
| 1 | |
|
|
| 2 |
|
|
|
|
|
|
|
| | ![]() 3 3
|
|
|
|
|
|
|
| 4 |
|
|
|
| ![]() 5 5
|
|
|
|
|
|
| 6 |
|
|
|
|
|
|
|
| ф | т | о | р |
| к | и | с | л | о | р | о | д |
| ![]() ![]()
| о | к | с | и | д |
|
|
| ф | т | о | р |
| а | з | о | т |
|
|
| в | о | д | о | р | о | д |
Литература
Габриелян О.С. Химия 8 класс. – Москва: Дрофа, 2007.
Конан-Дойль А, «Собака Баскервилей». - Тула, 1993.
Курганский С.М. Интеллектуальные игры по химии. - Москва, 2007.
Интернет-ресурсы
http://www.your-play.ru Фильм «Собака Баскервилей», 1981 г.