Калиничева Екатерина Антоновна – учитель химии высшей квалификационной категории КГУ «Средняя школа №5» г. Петропавловск,
Калиничева Екатерина Антоновна – учитель химии высшей квалификационной категории КГУ «Средняя школа №5» г. Петропавловск,
Северо-Казахстанская область,
ул. Мира 195, р.т. 51-85-03, д.т. 51-66-98
Тема: Факторы, влияющие на скорость химических реакций.
10 класс
Цели урока:
Образовательные: изучить факторы, влияющие на скорость химических реакций; продолжить формирование умений - составлять уравнения химических реакций, работать с учебной литературой.
Воспитательные: продолжить воспитание навыков сотрудничества, умения слушать, общаться и работать индивидуально, в паре, в группах; показать связь изучаемой темы с жизнью; воспитание культуры умственного труда (качественное оформление результатов работы и их представление, фиксация информации по ходу устной беседы и т.п.), культуру участия в беседе, обсуждении.
Развивающие: развивать умения устанавливать причинно-следственные связи состав – свойства - применение; продолжить развитие навыков сравнения, обобщения материала; учить размышлять, прогнозировать.
Методы обучения:
• Перцептивный аспект (передача знаний): словесные, наглядные, практические.
• Гностический аспект: проблемно-поисковые, исследовательские методы.
• Управленческий аспект: работа над управлением, самостоятельная.
• Мотивационный аспект: учебные дискуссии, неожиданность, занимательность.
• Аспект контроля: устный, письменный, фронтальный, групповой, индивидуальный, текущий, тестовый.
Организационные формы: беседа, самостоятельная и практическая работа, выступления учащихся.
Дидактическое и методическое оснащение урока:
Учебник «Химия», 10 класс, Н.Н.Нурахметов.
Презентация «Факторы, влияющие на скорость химических реакций».
Раздаточный материал.
Оборудование:
Компьютер, мультимедийный проектор, экран.
Ряд напряжения металлов Бекетова.
Периодическая система Д.И.Менделеева.
На столах: карточки (проверка домашнего задания), инструктивные карточки, технологические карты (лаборатории).
Приемы активизации мыслительной деятельности учащихся:
Анализ учебной информации.
Раскрытие межпредметных связей между химией, биологией, медициной, историей.
Выдвижение гипотез.
Анализ и составление кластера.
Тип урока: урок – комбинированный с сочетанием фронтального, парного и индивидуального вида работы учащихся.
Формирование компетентности учащихся на этапах урока.
I. Организационный момент.
II. Ориентировочно-мотивационный этап – формирование компетентности личностного самосовершенствования.
III. Операционно-исполнительский этап – формирование учебно-познавательной, самообразовательной, социальной компетентностей.
Бодрость за одну минуту по Д.В. Керни – формирование компетентного отношения к своему здоровью.
IV. Коррекция и первичная проверка знаний – формирование компетентности личностного самосовершенствования; формирование коммуникативной и познавательной компетентностей.
V. Рефлексивно-оценочный этап – формирование интеллектуальной компетентности.
VI. Домашнее задание – формирование интеллектуальной компетентности и компетентности личностного самосовершенствования
Ход урока.
Тема, эпиграф к уроку: «Опыт – единственно верный путь спрашивать природу и «слышать» ответ в ее лаборатории». Д.И.Менделеев
Организационный момент (10 баллов) 2 мин. Слайд №1.
Проверка знаний (домашнее задание). 6 мин.
Ф. И. учащегося:
Задание № 1. Данетка.
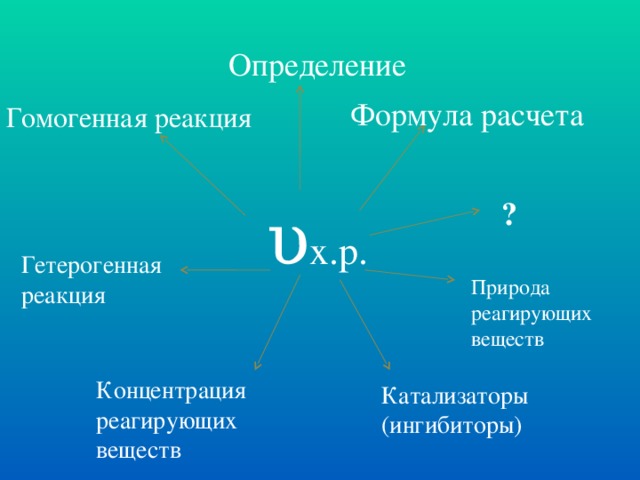
| 1 | Скорость химической реакции – изменение концентрации одного из реагирующих веществ или продуктов реакции в единицу времени
|
|
| 2 | Пример гомогенной реакции: С + О2 = СО2
|
|
| 3 | 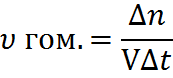
|
|
| 4 | Пример гетерогенной реакции: N2 + 3H2 = 2NH3
|
|
| 5 | 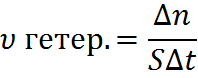
|
|
Примечание. Каждый правильный ответ – 1 балл.
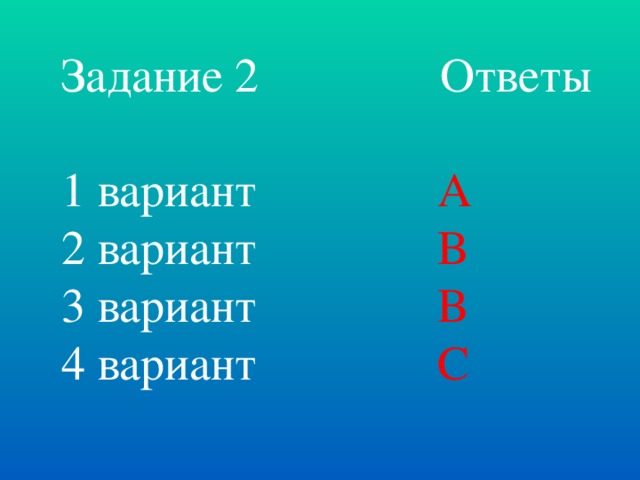
Задание №2. Реши задачу (тест).
1 вариант. Начальная концентрация вещества А составляет 2,4 моль/л. Через 5 мин. концентрация его стала 2,2 моль/л. Средняя скорость такой реакции равна:
А) 0,04 моль/ л∙мин
В) 0,2 моль/ л∙с С) 0,2 моль/ л∙мин
Д) 2 моль/ л∙мин Е) 0,04 моль/ л∙ч Ответ: А
Задание №2. Реши задачу (тест).
2 вариант. За 10 с. концентрация вещества А изменилась от 4,2 моль/л до 2,2 моль/л. Среднее значение скорости реакции по веществу А равно:
А) 2 моль/ л∙с
В) 0,2 моль/ л∙с С) 0,2 моль/ л∙мин
Д) 2 моль/ л∙мин Е) 2 моль/ л∙ч Ответ: В
Задание №2. Реши задачу (тест).
3 вариант. Концентрация вещества за 10 секунд изменилась с 0,2 моль/л до 0,1 моль/л. Средняя скорость такой реакции равна:
А) 0,05 моль/л ∙ сек В) 0,01 моль/л ∙ сек С) 0,03 моль/л ∙ сек
Д) 0,04 моль/л ∙ сек Е) 0,02 моль/л ∙ сек Ответ: В
Задание №2. Реши задачу (тест).
4 вариант. За 10 с. концентрация вещества А изменилась от 4,2 моль/л до 2,2 моль/л. Среднее значение скорости реакции по веществу А равно:
А) 2 моль/л ∙ с
В) 2 моль/л ∙ ч
С) 0,2 моль/л ∙ с
Д) 2 моль/л ∙ мин
Е) 0,2 моль/л ∙ мин Ответ: С Слайд №2,3. Всего баллов: 6
III. Ориентировочно – мотивационный этап. Слайд №4. 1 мин.
Тема: Факторы, влияющие на скорость химических реакций.
Цель: изучить факторы, влияющие на скорость химических реакций. Слайд № 5.
(5 факторов – 2 урока, сегодня – первые 3). 1 мин.
I. Природа реагирующих веществ.
Пример 1 (2 учащихся, 1 лаборатория). 2 балла
Технологическая карта №1. (Задание 1-й лаборатории).
Даны металлы: Mg, Zn, Fe, Cu. Поместите каждый из них в чашечку петри.
Добавьте в каждую чашечку соляную кислоту. Что наблюдаете?
Вывод.
Mg + HCl = v1
Zn + HCl = v2
Fe + HCl = v3
Cu + HCl = нет
Вывод: v1… v2… v3 ,т.к. в ряду напряжения металлов…
(1ученик – практик, опыт + ТБ; 2 – теоретик, объясняет уравнения реакций, каждое 0,5 балла). Слайд №6,7
Пример 2 (опыт – экран). Учитель. Слайд № 8. 10 мин.
Zn + HCl = v1
Zn + СН3СООН = v2
Вывод: v1… v2 , т.к. HCl сильнее СН3СООН
HNO3
Справка. НСlO4 H2SeO4 H2SO4 HCl H2SO3 H2СO3
(ЕНТ) Н3РО4 (СН3СООН) по силе
Домашнее задание№1. (Na + Н2О =, К + Н2О =) 1 балл (6 + 2 +1= 9)
II.Концентрация реагирующих веществ (ж, г). 5 мин.
Пример 1 (2 учащихся, 2 лаборатория). 2 балла
Технологическая карта №2. (Задание 2-й лаборатории).
Даны 2 гранулы цинка. Поместите каждую из них в чашечку петри.
Добавьте в каждую чашечку серную кислоту (в 1 – раствор серной кислоты 1: 5, во 2 – раствор серной кислоты 1: 10). Что наблюдаете?
Вывод (при увеличении концентрации реагирующих веществ увеличивается количество столкновений между частицами и, как следствие, возрастает скорость реакции). Слайд № 9.
5 мин.
Закон действующих массбыл сформулирован норвежскими исследователями К.М. Гульдбергом и М.П. Вааге в 1864-1867 гг. и независимо от них - русским ученым Н.Н. Бекетовым в 1865 г.
аА +вВ → сС + dD Слайд № 10.
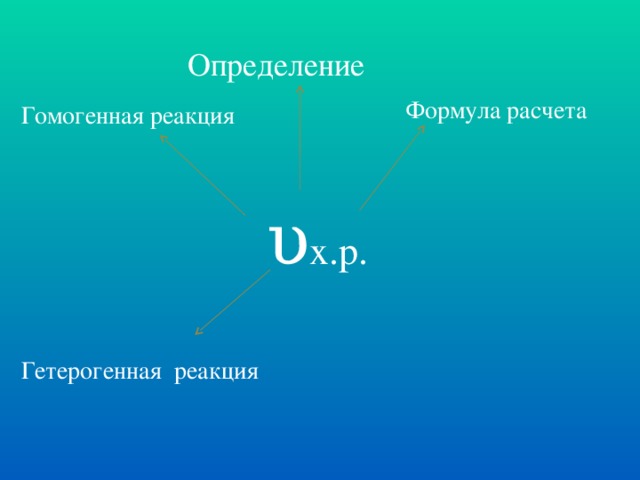
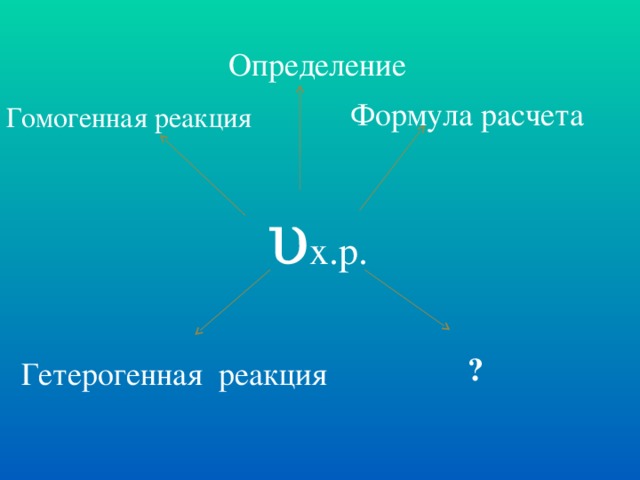
Скорость химической реакции при данной температуре прямо пропорциональна произведению молярных концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам
υ = κ • CAa • CBb (кинетическое уравнение реакции)
CA и CB – молярные концентрации реагирующих веществ
а и в – стехиометрические коэффициенты
κ – константа скорости реакции Слайд № 11.
Пример 1. 2Н2 + О2 = 2Н2О 2
Кинетическое уравнение реакции: υ = κ • CН2 • CО2
Для газообразных веществ изменение давления в системе равносильно изменению концентрации!
Пример 2. S(ТВ.) + О2(г.) = SO2(г.)
Кинетическое уравнение реакции: υ = κ •[O2]
Если реакция протекает в гетерогенной системе, то скорость реакции зависит только от концентрации газообразных веществ. Слайд № 12.
Задача 1. Как изменится скорость реакции: 2SO2 + O2 = 2SO3 при увеличении давления в системе в 3 раза?
Дано: Решение:
Р 3 раза 2SO2 + O2 = 2SO3
V2 / V1 - ? 2
V = к ·[ SO2] · [ O2]
Примем начальные концентрации веществ за 1, тогда
2 2
[ SO2] = 1 ; [ O2] = 1
Из условия, давление, следовательно и концентрация веществ увеличивается в 3 раза:
2 2
[ SO2] · 3 = 3 и [ O2] · 3 = 3
2 2
V2 / V1 = к · 3 · 3/ 1 · 1 = 27
Ответ: V2 / V1 = 27, следовательно скорость реакции возрастает в 27 раз.
Задача 2. Как изменится скорость реакции: FeCl3 + 3KCNS = Fe(CNS)3 + 3KCl , протекающей в водном растворе, при разбавлении реагирующей смеси водой в 2 раза?
Дано: Решение:
С(ионов)
V2 / V1 - ? Fe 3+ + 3CNS - = Fe(CNS)3
3
V = к ·[ Fe 3+ ] · [CNS -]
Примем начальные концентрации веществ за 1, тогда
3 3
[Fe 3+ ] = 1 ; [CNS -] = 1
Из условия, в результате разбавления концентрация ионов уменьшится в 2 раза: 3 3
½ [Fe 3+ ] = ½ и ½ [CNS -] = (1/2)
3 3
V2 / V1 = к · 1/2 · (1\2) / 1 · 1 = 1/16
Ответ: V2 / V1 = 1/16, следовательно скорость реакции уменьшится в 16 раз раз.
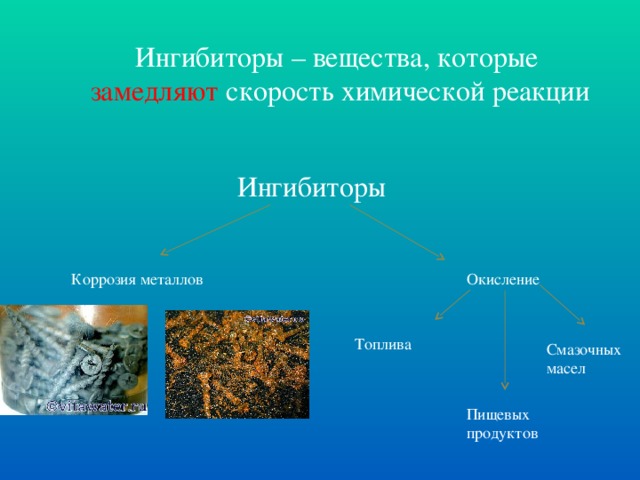
Катализаторы. 1)определение (легенда); 2) примеры. Слайды №13-18
Катализаторы – вещества, которые ускоряют скорость химической реакции, но сами при этом не расходуются
Пример 1. Каталитическое окисление сахарозы кислородом воздуха.
Обычный кусковой сахар или сахар-рафинад представляет собой практически чистую сахарозу С12Н22О11.
С12Н22О11 + 12O2 = 12СО2 + 11Н2О 3 лаборатория (1 уч-ся)
Предполагают (хотя это не установлено точно), что катализатором реакции окисления сахарозы служат соединения цезия, в очень небольшом количестве присутствующие в пепле от сигарет.
Пример 2. Разложение пероксида водорода (химия). Слайд № 19.
MnO2
2Н2О2 = 2Н2О + О2↑ Слайды № 20-21.
Разложение пероксида водорода (биология) Слайд №22.
каталаза
2Н2О2 = 2Н2О + О2↑
Ферменты – биологические катализаторы. 10 мин.
В химическом уравнении катализатор не присутствует среди реагентов или продуктов, его не нужно учитывать и при уравнивании реакции. Поэтому обычно катализатор в уравнении указывают над стрелкой. Если у вас под рукой нет диоксида марганца, его вполне можно заменить двумя-тремя крупинками марганцовки из домашней аптечки: KMnO4 при действии Н2О2 быстро превратится в MnO2 (полезно написать уравнение этой реакции). Дальше полученный катализатор, вне зависимости от его количества, будет работать до тех пор, пока не закончится весь реагент - перекись водорода. Этот опыт можно проводить дома только с разбавленным (аптечным) раствором перекиси водорода. С концентрированным раствором реакция идет очень бурно. Диоксид марганца - не единственный катализатор реакции разложения перекиси водорода. Биологические катализаторы (ферменты), содержащиеся в крови, действуют так же. Именно поэтому слабый раствор перекиси водорода, нанесенный на царапину, начинает пузыриться (выделяющийся при этом кислород дезинфицирует ранку). Катализаторы отличаются избирательностью (селективностью) действия. Например, в зависимости от вида катализатора и условий проведения реакции из этилового спирта можно получить до 40 видов различных продуктов. Огромное практическое значение катализаторов обусловлено возможностью быстро, без затраты энергии получать в больших количествах самые разнообразные вещества. Химические производства, использующие катализаторы, перерабатывают самое дешевое сырье, которое дает природа: природные газы, воздух, руды, нефть, уголь и др., преобразуя их в синтетический каучук и другие полимеры, высококачественные бензины, аммиак, азотную и серную кислоты, минеральные удобрения, органические растворители, красители и многие другие ценные продукты. Понятие «ингибитор», примеры. Слайд № 23.
( опыта – экран- природа, катализатор, ингибитор). 2 мин. (3 мин.)
IV. Рефлексия. Самооценка знаний учащимися.
Оценочный лист ученика.
| «2» | Я был на уроке |
|
| «3» | Я слушал и смотрел, как работают другие, старался все запомнить |
|
| «4» | Я записал главные мысли урока, помогая остальным учащимся отбирать необходимый материал, находить ответ, вносил свои предложения |
|
| «5» | Я активно участвовал в работе группы, был генератором идей |
|
Презентация «10 класс. Химическая кинетика. Факторы, влияющие на скорость химических реакций». (29 слайдов прилагается на диске)
 Калиничева Екатерина Антоновна – учитель химии высшей квалификационной категории КГУ «Средняя школа №5» г. Петропавловск,
Калиничева Екатерина Антоновна – учитель химии высшей квалификационной категории КГУ «Средняя школа №5» г. Петропавловск,










![Пример 1. 2Н 2 + О 2 = 2Н 2 О Кинетическое уравнение реакции: υ = κ • C Н • C О Для газообразных веществ изменение давления в системе равносильно изменению концентрации! Пример 2. S (ТВ.) + О 2(г.) = SO 2(г.) Кинетическое уравнение реакции: υ = κ • [O 2 ] Если реакция протекает в гетерогенной системе , то скорость реакции зависит только от концентрации газообразных веществ 2 2 2](https://fsd.kopilkaurokov.ru/uploads/user_file_547e7fabc313b/img_user_file_547e7fabc313b_0_14.jpg)