В этой презентации представлен очень доступный и полный материал по теме для 9-го класса. Презентация очень красочная и составлена в формате Microsoft Office Power Point. В ней присутствуют не только научные, но и исторические факты, которые играют не менее важную роль в расскрыти данной темы. В этой презентации подробно дается понятие "Электролиты" и "Неэлектролиты", основные положения теории электролитической дисссоциации, полностью раскрывается роль молекул растворителя в процессе электролитической диссоциации.Также имеется информация о слабых и сильных электролитах. И конечно же, объяснение материала сопровождается примерами уравнений реакций. Приятного просмотра!
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
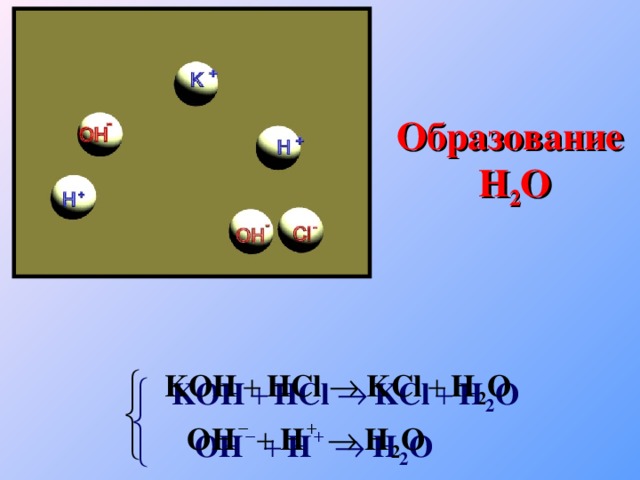
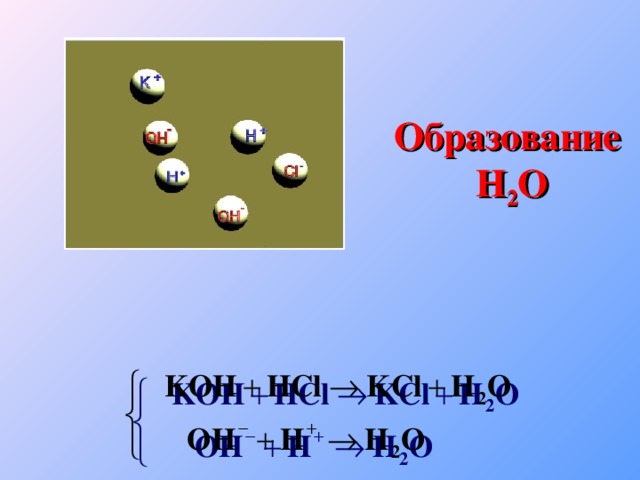
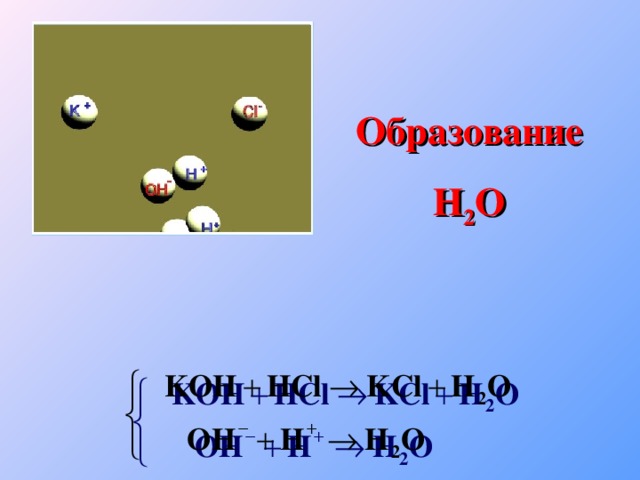
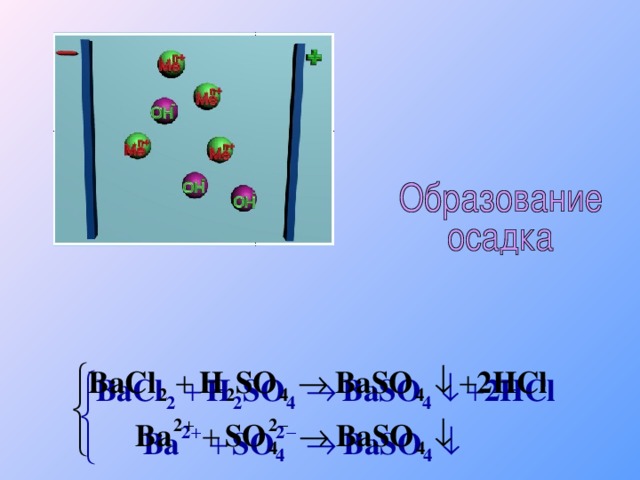
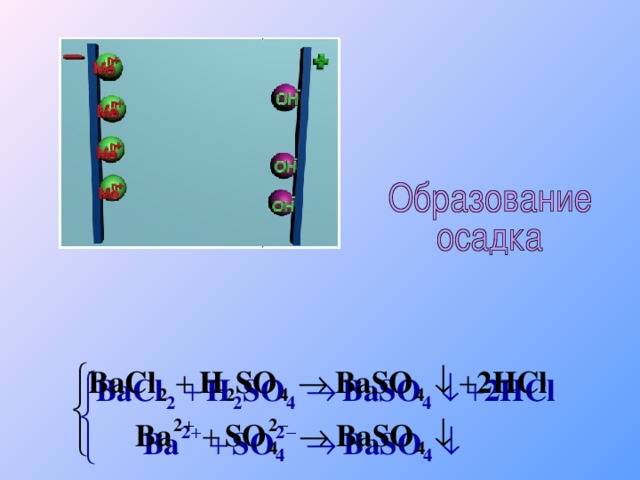
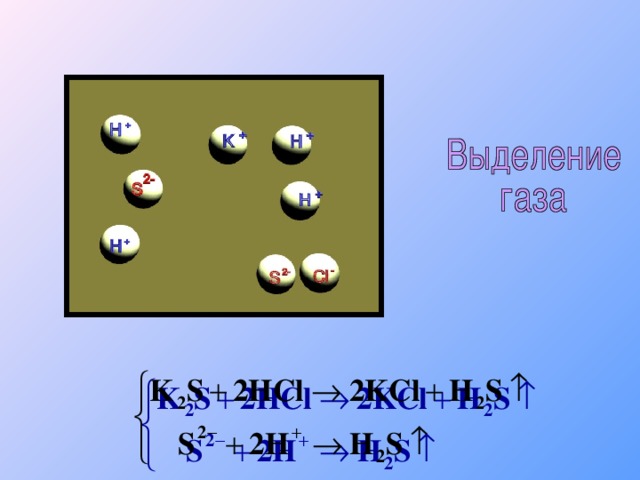
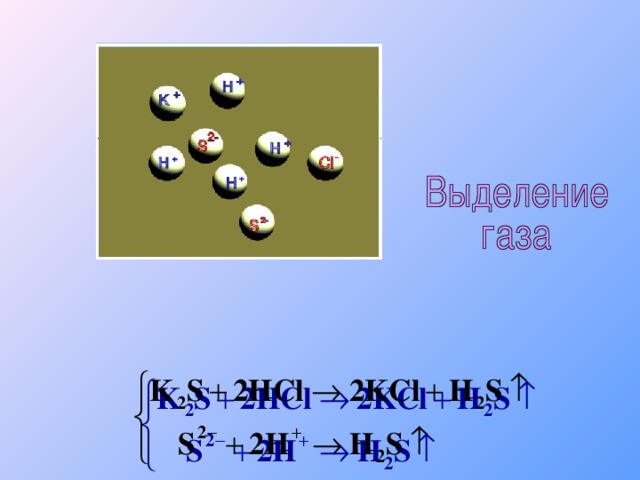
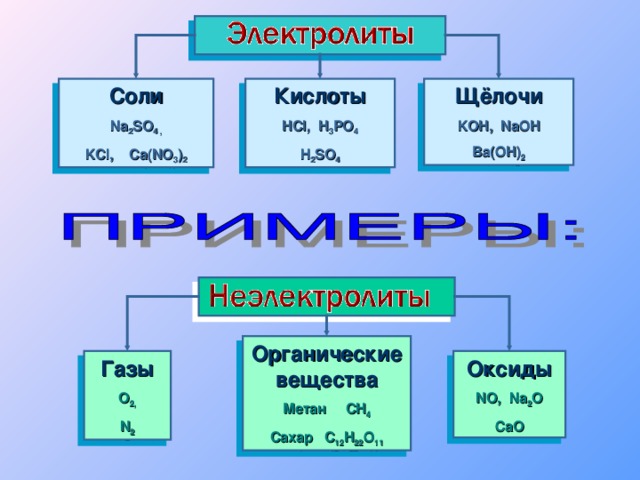
Теория электролитической диссоциации
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Теория электролитической диссоциации»
Похожие файлы
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
1970 руб.
2820 руб.
1990 руб.
2840 руб.
1990 руб.
2840 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства






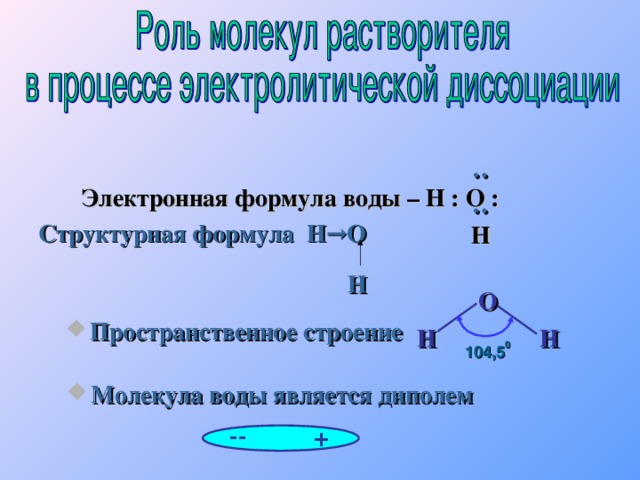
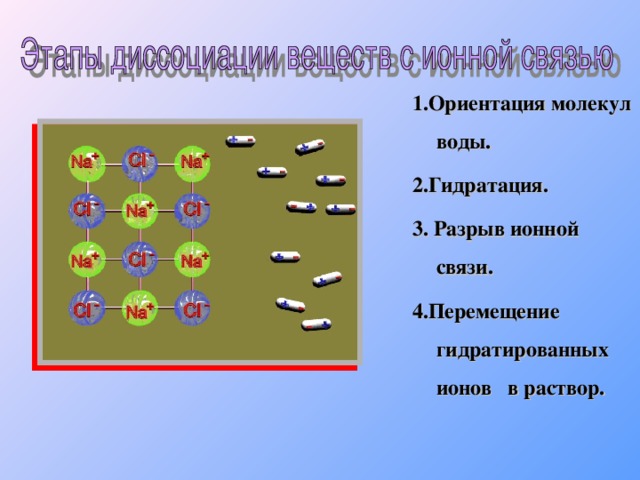


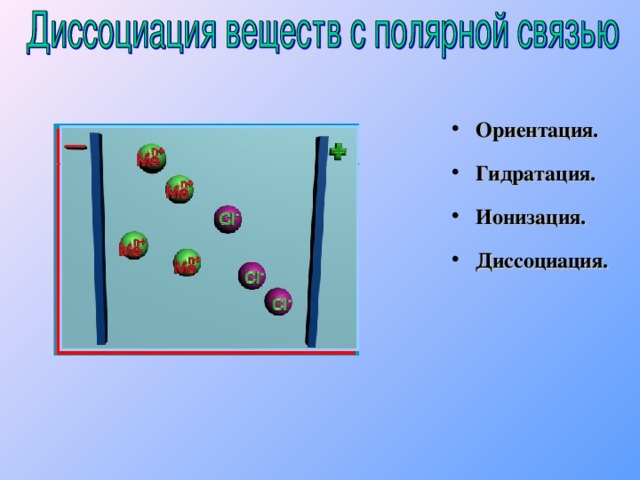
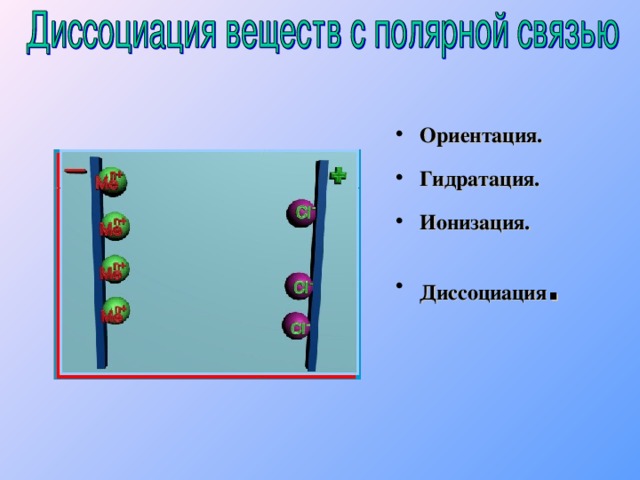
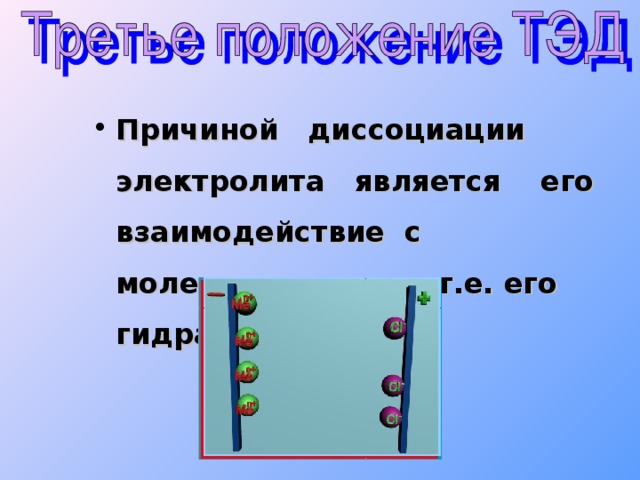
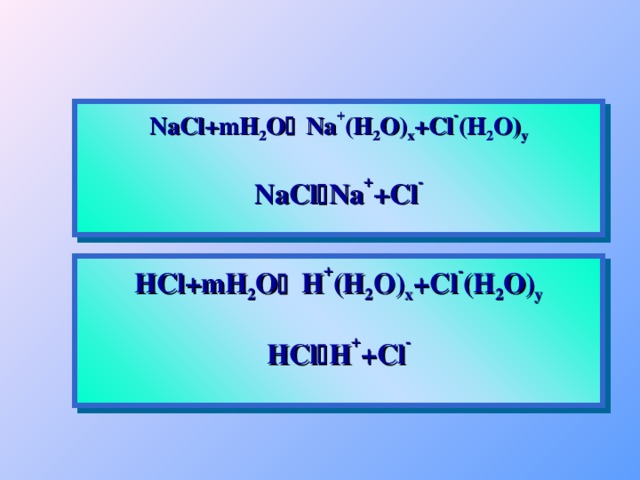



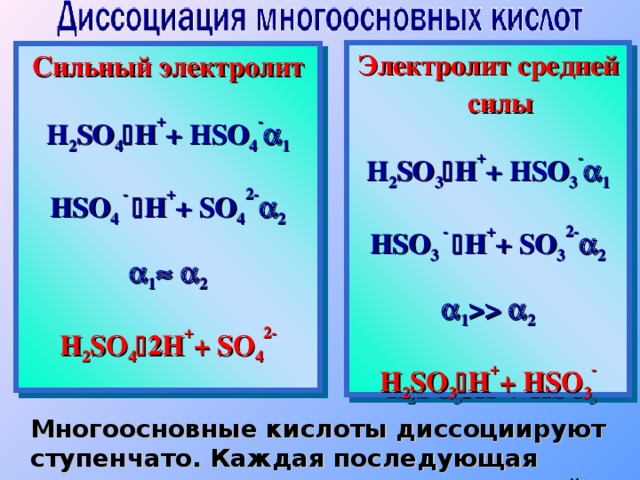 2 H 2 SO 3 H + + HSO 3 - Сильный электролит H 2 SO 4 H + + HSO 4 - 1 HSO 4 - H + + SO 4 2 - 2 1 2 H 2 SO 4 2 H + + SO 4 2 - Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей." width="640"
2 H 2 SO 3 H + + HSO 3 - Сильный электролит H 2 SO 4 H + + HSO 4 - 1 HSO 4 - H + + SO 4 2 - 2 1 2 H 2 SO 4 2 H + + SO 4 2 - Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей." width="640"
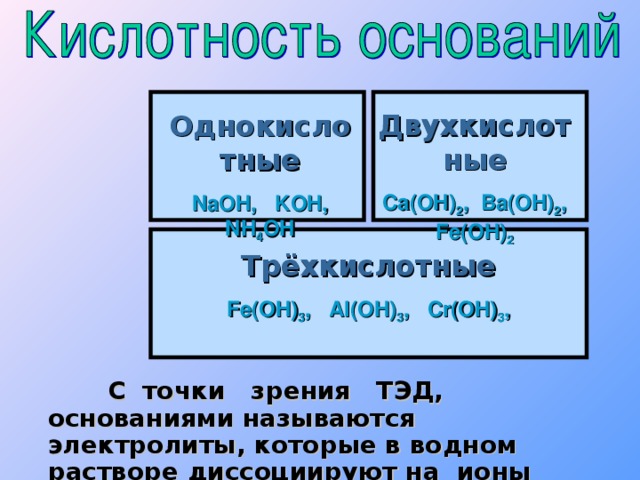






 30%" width="640"
30%" width="640"
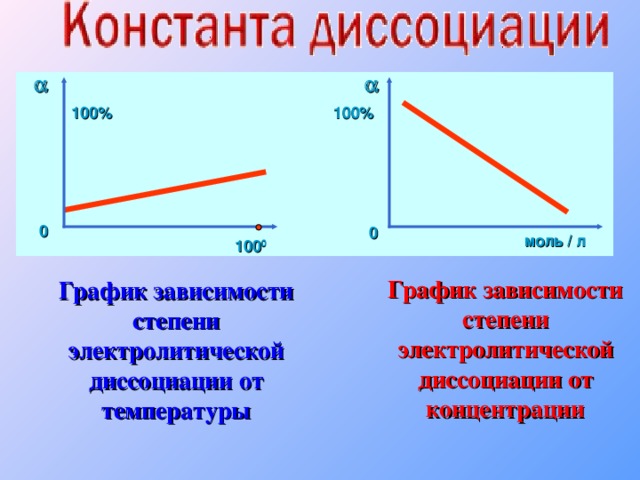
 30%" width="640"
30%" width="640"