Эпиграф: «Кто учился наукам, но не применяет их, похож на того, кто пахал, но не сеет»
Саади - персидский мыслитель, поэт
Скорость химических реакций
Преподаватель химии: Малахова Мария Ильинична

Цель:
Формирование знаний
о скорости химической реакции,
о факторах, влияющих на нее,
и математических выражений скорости химической реакции.

Ключевой вопрос
Что понимают под скоростью химической реакции и от каких факторов она зависит?
Начальная мотивация учебной деятельности
Почему многие продукты питания мы готовим на огне, а храним в холодильнике?

Вопросы, рассматриваемые на занятии:
- Понятие о скорости химических реакций.
- Зависимость скорости химических реакций от различных факторов.

Вопрос 1. Понятие о скорости химических реакций.
Р аздел химии, который изучает скорости химических реакций, их зависимость от различных факторов называется
химической кинетикой

Быстрые химические процессы: взрывы, ионные реакции в растворах, передача нервного импульса

Медленные химические процессы: коррозия, фотосинтез, биосинтез белка.
Белки обновляются наполовину за 70 суток
Неорганическая основа костных тканей за 4-7 лет
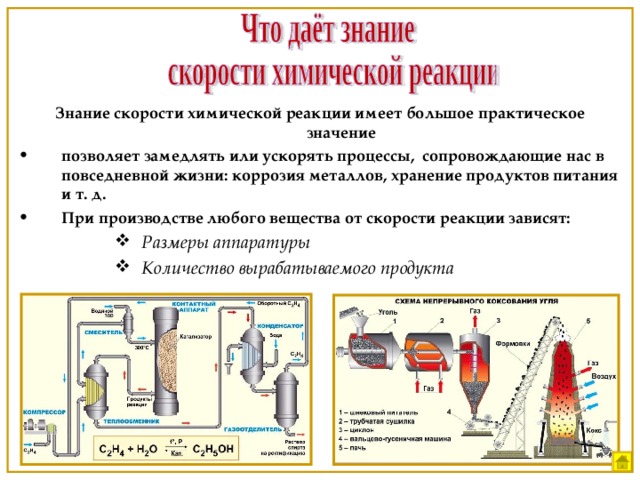
Знание скорости химической реакции имеет большое практическое значение
- позволяет замедлять или ускорять процессы, сопровождающие нас в повседневной жизни: коррозия металлов, хранение продуктов питания и т. д.
- При производстве любого вещества от скорости реакции зависят:
- Размеры аппаратуры Количество вырабатываемого продукта
- Размеры аппаратуры Количество вырабатываемого продукта
- Размеры аппаратуры Количество вырабатываемого продукта
- Размеры аппаратуры
- Количество вырабатываемого продукта
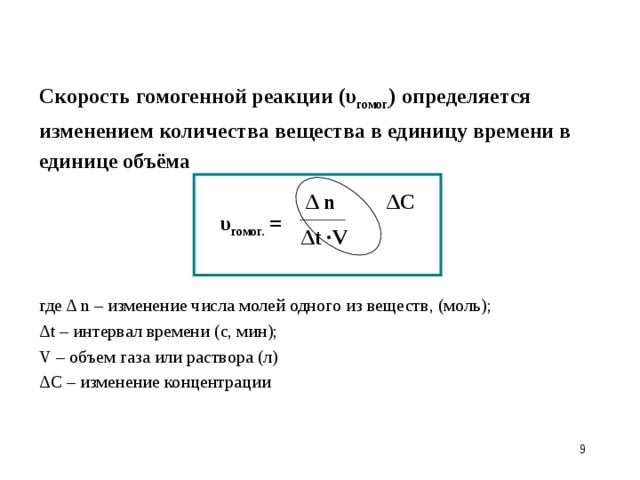
Скорость гомогенной реакции (υ гомог. ) определяется изменением количества вещества в единицу времени в единице объёма
υ гомог. =
где Δ n – изменение числа молей одного из веществ, (моль);
Δt – интервал времени (с, мин);
V – объем газа или раствора (л)
Δ n
ΔC
Δt ∙V
ΔC – изменение концентрации
![Скорость гомогенной реакции (υ гомог. ) определяется изменением концентрации реагирующих веществ или продуктов реакции в единицу времени ΔC моль [ ] υ гомог. =+/- Δt л · с](https://fsd.kopilkaurokov.ru/up/html/2019/06/06/k_5cf8c2e02866b/img_user_file_5cf8c2e0df977_0_9.jpg)
Скорость гомогенной реакции (υ гомог. ) определяется изменением концентрации реагирующих веществ или продуктов реакции в единицу времени
ΔC
моль
[
]
υ гомог.
=+/-
Δt
л · с

Скорость гетерогенной реакции (υ гетер. ) определяется изменением количества вещества в единицу времени на единице поверхности соприкосновения веществ
Δ n
υ гетер.
=
Δt ∙ S
где Δ n – изменение количества вещества (реагента или продукта), (моль);
Δt – интервал времени (с, мин);
S – площадь поверхности соприкосновения веществ (см 2 , м 2 )
10

Закрепим понятие
Задача №1
Химическая реакция протекает в растворе согласно уравнению:
А+В=С
Исходная концентрация вещества А – 0,80 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л.
Определите среднюю скорость реакции за этот промежуток времени ?

Решение
- Дано:
- С(А) = 0,80 моль/л;
- С(А1) = 0,74 моль/л;
- Δ t = 20 минут.
- Найти: υ гомог .=?
- Решение:
1. Определение средней скорости реакции в растворе производится по формуле: υ = +/- Δ C/ Δ t
Подставим значения в формулу:
υ = +/- (0,74 - 0,8)/ 20 = 0,003 моль / л∙мин. Ответ: 0,003 моль / л∙мин.

Почему протекают химические реакции?
Энергия активации Е акт - минимальный избыток энергии, который должна иметь частица (или пара частиц), чтобы произошло эффективное соударение
Энергия
Активированный
комплекс
E act
H

2. Зависимость скорости химических реакций от различных факторов
- Природа реагирующих веществ
- Площадь поверхности твердого вещества
- Концентрация реагирующих веществ
- Давление (для газов)
- Температура
- Катализатор
 υ (Zn + CH 3 COOH = H 2 + Zn(CH3COO) 2 υ (Zn + HCl = H 2 + ZnCl 2 ) υ (Zn + CH 3 COOH = H 2 + Zn(CH3COO) 2 скорость больше у металлов, которые легче отдают электроны (с большим радиусом атома) скорость больше у неметаллов, которые легче принимают электроны (с меньшим радиусом атома) скорость больше у металлов, которые легче отдают электроны (с большим радиусом атома) скорость больше у неметаллов, которые легче принимают электроны (с меньшим радиусом атома) υ (2K + 2 H 2 O = H 2 + 2KOH) υ (2Na + 2 H 2 O = H 2 + 2NaOH) υ (2K + 2 H 2 O = H 2 + 2KOH) υ (2Na + 2 H 2 O = H 2 + 2NaOH) 14" width="640"
υ (Zn + CH 3 COOH = H 2 + Zn(CH3COO) 2 υ (Zn + HCl = H 2 + ZnCl 2 ) υ (Zn + CH 3 COOH = H 2 + Zn(CH3COO) 2 скорость больше у металлов, которые легче отдают электроны (с большим радиусом атома) скорость больше у неметаллов, которые легче принимают электроны (с меньшим радиусом атома) скорость больше у металлов, которые легче отдают электроны (с большим радиусом атома) скорость больше у неметаллов, которые легче принимают электроны (с меньшим радиусом атома) υ (2K + 2 H 2 O = H 2 + 2KOH) υ (2Na + 2 H 2 O = H 2 + 2NaOH) υ (2K + 2 H 2 O = H 2 + 2KOH) υ (2Na + 2 H 2 O = H 2 + 2NaOH) 14" width="640"
2. Зависимость скорости химических реакций от различных факторов
- Природа реагирующих веществ
Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в веществах, что определяет энергию активации молекул.
▪ чем меньше Е акт , тем больше υ;
- скорость больше у веществ с ионной и ковалентной полярной связью (неорганические вещества) скорость меньше у веществ с ковалентной малополярной и неполярной связью (органические вещества )
- скорость больше у веществ с ионной и ковалентной полярной связью (неорганические вещества)
- скорость меньше у веществ с ковалентной малополярной и неполярной связью (органические вещества )
υ (Zn + HCl = H 2 + ZnCl 2 ) υ (Zn + CH 3 COOH = H 2 + Zn(CH3COO) 2
- υ (Zn + HCl = H 2 + ZnCl 2 ) υ (Zn + CH 3 COOH = H 2 + Zn(CH3COO) 2
- скорость больше у металлов, которые легче отдают электроны (с большим радиусом атома) скорость больше у неметаллов, которые легче принимают электроны (с меньшим радиусом атома)
- скорость больше у металлов, которые легче отдают электроны (с большим радиусом атома)
- скорость больше у неметаллов, которые легче принимают электроны (с меньшим радиусом атома)
υ (2K + 2 H 2 O = H 2 + 2KOH) υ (2Na + 2 H 2 O = H 2 + 2NaOH)
- υ (2K + 2 H 2 O = H 2 + 2KOH) υ (2Na + 2 H 2 O = H 2 + 2NaOH)
14

1. Природа реагирующих веществ
Задание для 1 группы экспертов
- Рассмотреть влияние на скорость химических реакций природы реагирующих веществ на примере взаимодействия металлов с водой. Налейте в две пробирки по 3-4 мл воды и опустите в каждую по кусочку металла: в 1-ю — М g , во 2-ю — Cu (в виде проволоки). Что наблюдаете? Нагрейте пробирки. Что наблюдаете? Добавьте в каждую пробирку по капле фенолфталеина. Что наблюдаете? Напишите уравнения реакций.
![▪ чем меньше Е акт , тем больше υ; Если Е акт скорость такой реакции очень большая. 4 FeCl 3 + 3 K 4 [Fe(CN) 6 ] → Fe 4 [Fe(CN) 6 ] 3 + 12 KCl берлинская лазурь 14](https://fsd.kopilkaurokov.ru/up/html/2019/06/06/k_5cf8c2e02866b/img_user_file_5cf8c2e0df977_0_17.jpg)
▪ чем меньше Е акт , тем больше υ;
Если Е акт
скорость такой реакции очень большая.
4 FeCl 3 + 3 K 4 [Fe(CN) 6 ] →
Fe 4 [Fe(CN) 6 ] 3 + 12 KCl
берлинская лазурь
14

18
 120 кДж/моль, скорость таких реакций очень мала. 4Fe + 2Н 2 О + ЗО 2 = 2(Fe 2 O 3 • Н 2 О) ржавление железа 18" width="640"
120 кДж/моль, скорость таких реакций очень мала. 4Fe + 2Н 2 О + ЗО 2 = 2(Fe 2 O 3 • Н 2 О) ржавление железа 18" width="640"
Если Е акт 120 кДж/моль,
скорость таких реакций очень мала.
4Fe + 2Н 2 О + ЗО 2 = 2(Fe 2 O 3 • Н 2 О)
ржавление железа
18
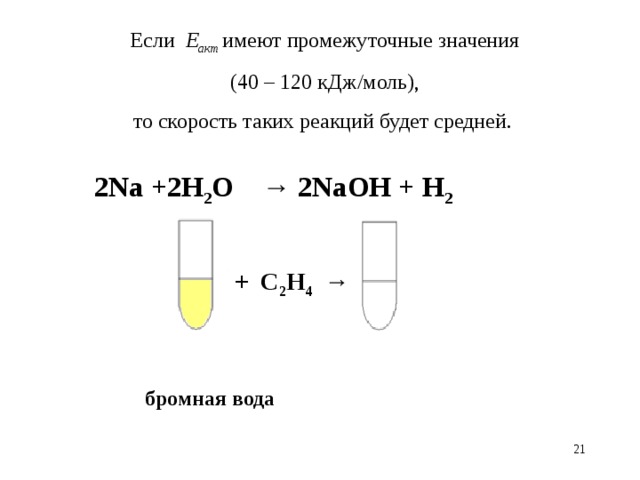
Если Е акт имеют промежуточные значения
(40 – 120 кДж/моль),
то скорость таких реакций будет средней.
2Na + 2H 2 O → 2NaOH + H 2
+ С 2 Н 4 →
бромная вода
18

2. Зависимость скорости химических реакций от различных факторов
2. Поверхность соприкосновения реагирующих веществ
Задание для 2 группы экспертов
Проведите опыт
- Возьмите два небольших кусочка мела, один из которых разотрите в порошок и высыпьте их в воздушные шарики.
- В две пробирки налейте по 10 мл соляной кислоты HCI , наденьте на них шарики и одновременно высыпьте в пробирки порошок и кусочки мела.
- Что наблюдаете? Сделайте вывод о влияние поверхности соприкосновения реагирующих веществ на скорость химических реакций

3. Концентрация реагирующих веществ
для 3 группы экспертов
Проведите опыт
- Рассмотрите влияние концентрации реагирующих веществ на скорость химических реакций на примере взаимодействия тиосульфата натрия с серной кислотой: Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 O + SO 2 + S
- В три стаканчика цилиндрами налить: в первый – 10 мл 1н раствора тиосульфата натрия + 20 мл дист. воды; во второй – 20 мл раствора тиосульфата натрия + 10 мл дист. воды; в третий – 30 мл раствора тиосульфата натрия. Таким образом, концентрации тиосульфата в трех пробирках будут находиться в соотношении 1:2:3
- В другие три стаканчика налейте по 10 мл 1н раствора серной кислоты.
- К первому раствору быстро прилейте раствор серной кислоты и одновременно включите секундомер. С появлением легкой мути секундомер выключите, время в секундах запишите в таблицу.

- Момент сливания растворов нужно считать началом реакции, а появление легкой мути (начало образования осадка) от выпавшей в осадок серы – концом реакции.
- Аналогично проведите опыт со вторым и третьим растворами. Концом реакции считать одинаковую интенсивность помутнения. В этих опытах определяют не абсолютную скорость реакции, а промежуток времени между началом реакции и её видимым результатом.
- Сделайте вывод о влиянии концентрации реагирующих веществ на скорость химических реакций.
21

2. Зависимость скорости химических реакций от различных факторов
3 . Концентрация : чем ↑ С, тем чаще происходят соударения и υ ↑.
Закон действующих масс (з. д. м.):
1867 г.
Скорость химической реакции (υ х.р. ) прямо пропорциональна
произведению концентраций реагирующих веществ,
взятых в степенях их коэффициентов в уравнении реакции
К.Гульдберг и П.Вааге
21

2. Зависимость скорости химических реакций от различных факторов
Для реакции а A + в B = C по закону действующих масс:
υ = k ∙ С A а ∙ C B в
где k – константа скорости;
С – концентрация (моль/л)
* З.д.м. не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии, т.к. они реагируют на поверхности и их концентрации обычно остаются постоянными.

2. Зависимость скорости химических реакций от различных факторов
Задача 2.
Реакция идет по уравнению А +2В → С. Во сколько раз и как изменится скорость реакции при увеличении концентрации вещества В в 3 раза?
Решение:
А +2В → С
По з.д.м. υ = k ∙ С A ∙ C B 2
Пусть С А = а, С В = в, тогда
υ 1 = k ∙ а ∙ в 2
υ 2 = k ∙ а ∙ (3в) 2
υ 1 / υ 2 = а ∙ в 2 / а ∙ 9в 2 = 1/9
Дано:
↑ С В в 3 раза
Найти:
Как изменится
υ х.р.
Ответ: скорость реакции увеличится в 9 раз
21
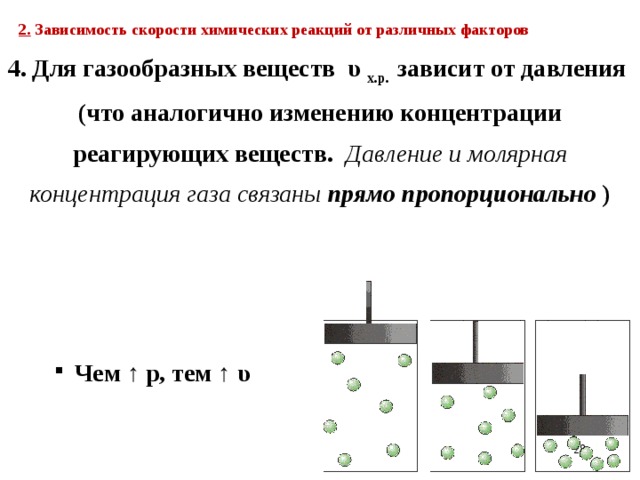
2. Зависимость скорости химических реакций от различных факторов
4. Для газообразных веществ υ х.р. зависит от давления
(что аналогично изменению концентрации
реагирующих веществ. Давление и молярная концентрация газа связаны прямо пропорционально )
21

2. Зависимость скорости химических реакций от различных факторов
5. Температура
Задание для 4 группы экспертов
Проведите опыт
- В две пробирки поместите небольшое количество оксида меди и в каждую прилейте 2-3 мл серной кислоты. Одну из пробирок нагрейте.
- Дайте пояснения: Что наблюдали в результате реакции? Почему реакции имеют разные скорости?
- Сформулируйте зависимость скорости химической реакции от увеличения температуры.

2. Зависимость скорости химических реакций от различных факторов
4. Температура: при увеличении ↑ температуры t на каждые 10 0 С, скорость химической реакции υ увеличивается ↑ в 2-4 раза (правило Вант-Гоффа)
При ↑ t, ↑ количество активных частиц (с Е акт ) и их активных соударений.
21

2. Зависимость скорости химических реакций от различных факторов
Задача 3.
Скорость некоторой реакции при 0 0 С равна 1 моль/л ∙ ч, температурный коэффициент реакции ɣ равен 3. Какой будет скорость данной реакции при 30 0 С?
Дано:
υ t 1 = 1 моль/л ∙ ч
γ =3
t 1 = 0 0 С
t 2 = 30 0 С
Найти: υ t 2
Решение:
υ t 2 = υ t 1 ∙ γ Δt/10
υ t 2 =1∙3 30 - 0/10 = 3 3 = 27 моль/л∙ч
Ответ: Скорость данной реакции при 30 0 С будет равна 27 моль/л∙ч
21
 υ ↑. ▪ Катализаторы остаются неизменными по окончании реакции ▪ Ферменты – биологические катализаторы белковой природы ▪ Ингибиторы – вещества, которые понижают↓ υ 21" width="640"
υ ↑. ▪ Катализаторы остаются неизменными по окончании реакции ▪ Ферменты – биологические катализаторы белковой природы ▪ Ингибиторы – вещества, которые понижают↓ υ 21" width="640"
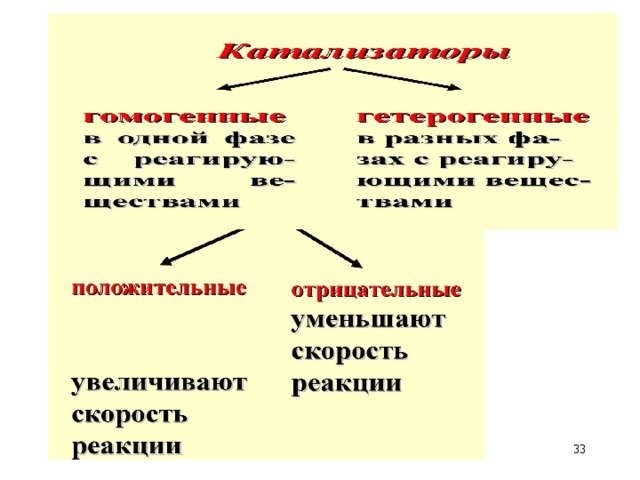
2. Зависимость скорости химических реакций от различных факторов
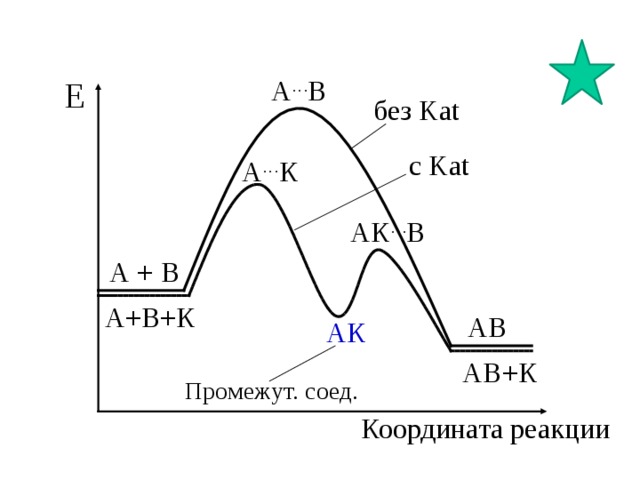
6. Катализаторы – вещества, которые изменяют механизм реакции, уменьшают Е акт = υ ↑.
▪ Катализаторы остаются неизменными по окончании реакции
▪ Ферменты – биологические катализаторы белковой природы
▪ Ингибиторы – вещества, которые понижают↓ υ
21
21
21

21
Е
А … В
без Kat
с Kat
А … К
АК … В
А + В
А+В+К
АВ
АК
АВ+К
Промежут. соед.
Координата реакции

Выводы по теме урока
- Химические реакции протекают с различными скоростями. Величина скорости реакции не зависит от объёма в гомогенной системе и от площади соприкосновения реагентов – в гетерогенной.
- На пути всех частиц, вступающих в химическую реакцию, имеется энергетический барьер, равный энергии активации E а.
- Скорость реакции зависит от факторов :
-природа реагирующих веществ;
-температура;
-концентрация реагирующих веществ;
- действие катализаторов;
-поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).

Выводы по теме урока
- Величина энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции. Чем меньше энергия активации, тем больше эффективных соударений реагирующих частиц.
- При увеличении температуры на 10 º С общее число активных соударений увеличивается в 2-4 раза.
- Чем больше концентрации реагентов, тем больше соударений реагирующих частиц, а среди них и эффективных соударений.
- Катализатор изменяет механизм реакции и направляет её по энергетически более выгодному пути с меньшей энергией активации. Ингибитор замедляет ход реакции.
- Гетерогенные реакции протекают на поверхности соприкосновения реагирующих веществ. Нарушение правильной структуры кристаллической решётки приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на «гладкой» поверхности.

Цель:
Формирование знаний
о скорости химической реакции,
о факторах, влияющих на нее,
и математических выражений скорости химической реакции.

Ключевой вопрос
Что понимают под скоростью химической реакции и от каких факторов она зависит?
Начальная мотивация учебной деятельности
Почему многие продукты питания мы готовим на огне, а храним в холодильнике?

Домашнее задание
- О.С.Габриелян, И.Г.Остроумов. Химия: учебник для студ. Учреждений сред. Проф. Образования-12-е изд., стер.-М.: Академия, 2014- 336с. Стр.104-109,
- Ответить на вопросы и решить задачи в конце главы 6.1