
Выполнила учитель химии МБОУ СОШ № 79 г.о. Самара Язрикова Л.М.

У атомов металлов на внешнем уровне 1-3 электрона.
У атомов металлов на внешнем уровне 1-3 электрона.
Металлы являются восстановителями и окислителями.
Для металлов характерна металлическая кристаллическая решетка.
Для металлов характерна металлическая кристаллическая решетка.
Металлы обладают электропроводностью и теплопроводностью.
Металлы обладают электропроводностью и теплопроводностью.
При взаимодействии с кислородом металлы принимают электроны.
Слайд используется для актуализации знаний по теме металлы
Все металлы активно взаимодействуют с кислотами.
Металлы С u, Au, Ag не взаимодействуют с водой даже при нагревании.
Металлы С u, Au, Ag не взаимодействуют с водой даже при нагревании.
М g, Be относятся к щелочноземельным металлам.

Дать общую характеристику щелочным металлам.
Рассмотреть их электронное строение, сравнить физические и химические свойства.
Узнать о важнейших соединениях металлов и их тривиальных названиях.
Определить области применения этих соединений.

ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ
- Литий был открыт шведским химиком Й. Арведсоном в 1817 г. по предложению Й.Берцелиуса назван литием (от греч. литос – камень)
- Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807 г. при электролизе едких щелочей
- Й. Берцелиус предложил назвать один новый элемент натрием (от араб. натрун – сода), а второй элемент по предложению Гильберта назван калием (от араб. алкали – щелочь )
Гемфри Дэви
(1778 – 1829)
Йенс-Якоб Берцелиус (1779–1848)
30.10.16

- В 1860 – 1861г.г. в Германии Р.Бунзен и Г.Кирхгоф открыли рубидий «темно-красный» и цезий «небесно-голубой».
- В 1939г. во Франции М. Пере открыл радиоактивный элемент франций, который назвал в честь своей страны – Франции.
![Восстано-вительные свойства соединения Метал-лические свойства элемент А r Валентные электроны Атомный радиус Li 2 O, LiOH основные свойства Li 7 2s 1 )) Na 2 O, NaOH основные свойства 23 3s 1 Na ))) K 2 O, KOH основные свойства )))) 4s 1 39 K Rb 2 O, RbOH основные свойства Изучение нового материала. Все сведения не появляются сразу, а имеется возможность входе беседы с учащимися проверить их мнение и вместе дать общую характеристику щелочных металлов по их положению в таблице. ))))) 5s 1 85 Rb Cs 2 O, CsOH основные свойства 6s 1 133 )))))) Cs Радиоактивный элемент ))))))) [223] Fr 7s 1](https://fsd.kopilkaurokov.ru/uploads/user_file_54682cc818a9c/img_user_file_54682cc818a9c_0_5.jpg)
Восстано-вительные свойства
соединения
Метал-лические свойства
элемент
А r
Валентные
электроны
Атомный радиус
Li 2 O, LiOH
основные свойства
Li
7
2s 1
))
Na 2 O, NaOH
основные свойства
23
3s 1
Na
)))
K 2 O, KOH
основные свойства
))))
4s 1
39
K
Rb 2 O, RbOH
основные свойства
Изучение нового материала. Все сведения не появляются сразу, а имеется возможность входе беседы с учащимися проверить их мнение и вместе дать общую характеристику щелочных металлов по их положению в таблице.
)))))
5s 1
85
Rb
Cs 2 O, CsOH
основные свойства
6s 1
133
))))))
Cs
Радиоактивный
элемент
)))))))
[223]
Fr
7s 1

Щелочные металлы
литий
калий
натрий
рубидий
цезий

Физические свойства
Щелочные металлы легкоплавки и мягки, серебристы, как снежки…
Литий - мягкий и пластичный, твёрже натрия, но мягче свинца
Натрий – мягкий металл, его можно резать ножом
Металлический рубидий в ампуле
Металлический цезий в ампуле
30.10.16

Li
Rb
Na
Cs
K
Твердые вещества серебристо-белого цвета
Электропроводны и теплопроводны
Легкоплавкие. пластичные
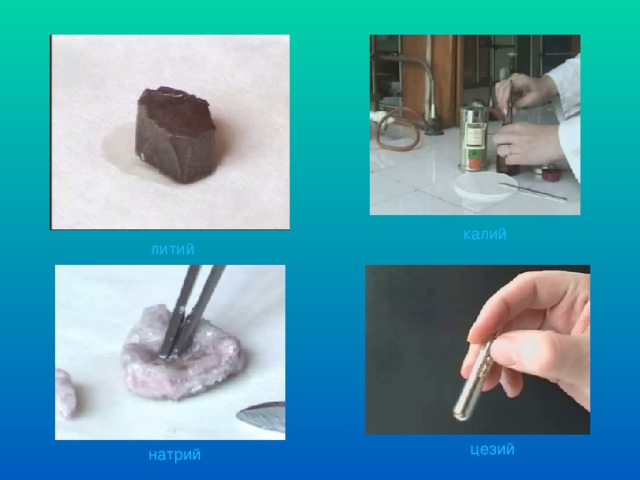
калий
литий
цезий
натрий
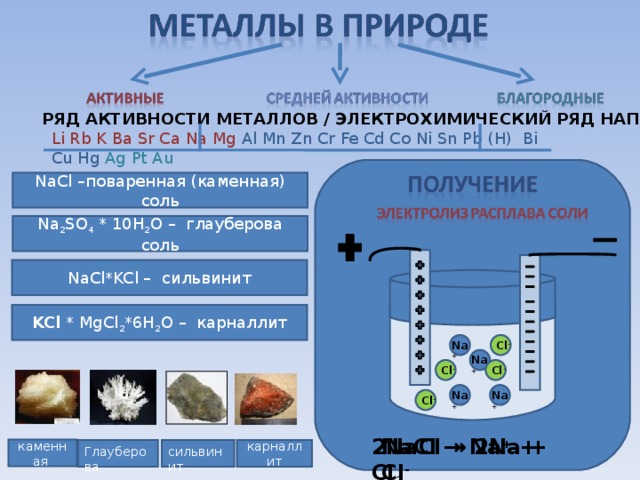
РЯД АКТИВНОСТИ МЕТАЛЛОВ / ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Bi Cu Hg Ag Pt Au
NaCl – поваренная (каменная) соль
Na 2 SO 4 * 10H 2 O – глауберова соль
NaCl*KCl – сильвинит
KCl * MgCl 2 *6H 2 O – карналлит
Na +
Cl -
Na +
Cl -
Cl -
Na +
Na +
Cl -
2NaCl → 2Na + Cl 2
NaCl → Na + + Cl -
каменная
сильвинит
Глауберова
карналлит
11
![Нахождение в природе Ортоклаз Альбит Хлорид натрия Формула К(А lSi 3 О 8 ) Формула NaCl Формула Na[AlSi 3 O 8 ] Сильвин Карналлит Сильвинит Формула NaCl • KCl Формула KCl·MgCl 2 ·6H 2 O Формула К Cl](https://fsd.kopilkaurokov.ru/uploads/user_file_54682cc818a9c/img_user_file_54682cc818a9c_0_11.jpg)
Нахождение в природе
Ортоклаз
Альбит
Хлорид натрия
Формула К(А lSi 3 О 8 )
Формула NaCl
Формула Na[AlSi 3 O 8 ]
Сильвин
Карналлит
Сильвинит
Формула NaCl • KCl
Формула KCl·MgCl 2 ·6H 2 O
Формула К Cl

Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1.

1. Ме + вода = гидроксид металла + водород
Все щелочные металлы активно реагируют с водой, образуя щелочи и восстанавливая воду до водорода:
2Ме 0 + 2Н 2 О = 2Ме +1 ОН + Н 2
2Na + 2Н 2 О = 2NaOH + H 2
Скорость взаимодействия щелочного металла с водой увеличивается от лития к цезию

2. Взаимодействие с кислородом
- Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na 2 O 2 с небольшой примесью надпероксида NaO 2 :
- В продуктах горения калия , рубидия и цезия содержатся в основном надпероксиды:

3 . Взаимодействие с другими веществами
Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов , сульфидов , нитридов , фосфидов, карбидов и силицидов :
11

1
2
3

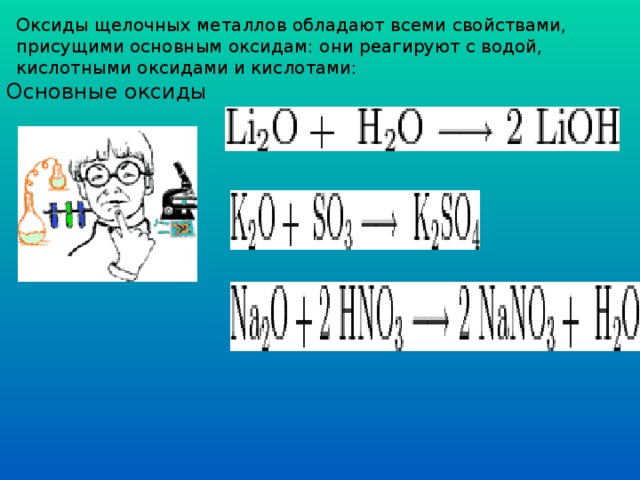
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
Основные оксиды
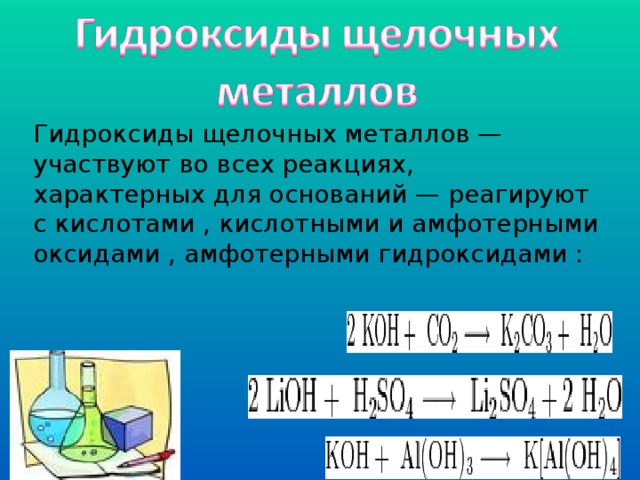
Гидроксиды щелочных металлов —участвуют во всех реакциях, характерных для оснований — реагируют с кислотами , кислотными и амфотерными оксидами , амфотерными гидроксидами :

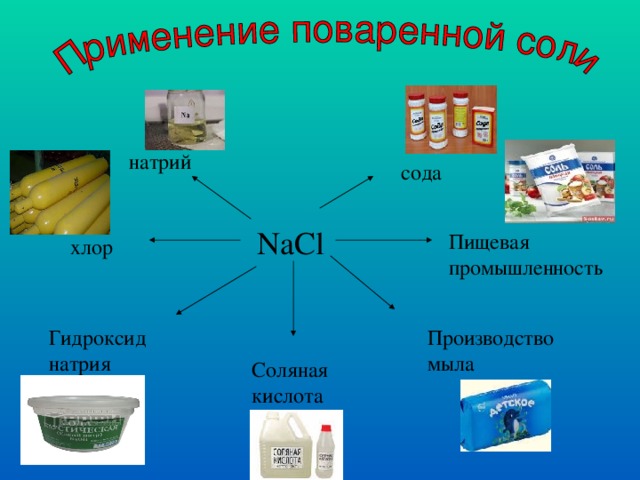
натрий
сода
NaCl
Пищевая промышленность
хлор
Производство мыла
Гидроксид натрия
Соляная кислота

Na + - внутриклеточный ион, содержится в крови и лимфе, создает в клетках осмотическое давление.
K + - внеклеточный ион, поддерживает работу сердца и мышц.

Сколько воды и хлорида натрия нужно взять для приготовления физиологического раствора
массой 0,5 кг?
4,5г соли
495,5 г воды
Смесь хлорида и гидрокарбоната натрия массой 15 г обработали уксусной кислотой, при этом выделилось 2,8 л (н.у.) газа. Определите массовые доли в процентах компонентов смеси.
Хлорид калия - очень ценное минеральное удобрение. Рассчитайте массовую долю калия (%) в этом веществе.
52%
70% NaHCO 3
30% NaCl
Тривиальные названия солей:
Поваренная соль
Раствор хлорида натрия (0,9%) применяется в медицине. Такой раствор называется физиологическим
Питьевая сода применяется в кулинарии, для выпечки кондитерских изделий.
Хлорид натрия - как добавка к пище
ответ
ответ
Калийные удобрения играю важную роль в жизни растений.
Для работы слайда необходимо кликнуть мышью на любой синий прямоугольник. Для 1-3 ячейки таблицы это задача. Для 4 ячейки - проверка знаний тривиальных названий веществ.
K 2 CO 3
NaCl
поташ
Кристалли-ческая сода
Na 2 CO 3 *10H 2 O
Калийная селитра
KNO 3
ответ
Na 2 SO 4 *10H 2 O
NaHCO 3
Глауберова соль
Питьевая сода

Задание №1.
Определите «лишний» элемент в ряду.
А) Fr, K, Cu, Na ;
Б) P, Li, O, Cl ;
В) Al, Ag, Ra, Cs .
Объясните свой выбор.
Cu, Li, Ag

Задание № 2.
Горение какого металла вы наблюдаете на рисунке, если пламя окрашено в соответствующий цвет

Окраска пламени ионами щелочных металлов
Li +
Na +
K +
Cs +
30.10.16
Задание № 3.
Шведский химик Юхан Арфведсон в 1817 г. Изучал свойства оксида нового химического элемента с формулой Э2О. Этот оксид был белого цвета, энергично взаимодействовал с водой с образованием сильного основания ЭОН, а с кислотами давал соли. Со щелочами Э2О не реагировал, а в атмосфере СО2 превращался в карбонат Э2СО3, а при сплавлении с оксидом фосфора ( V) давал ортофосфат Э3РО4. И карбонат и ортофосфат плохо растворялись в воде. Когда порошок Э2О вносили в пламя, оно окрашивалось в карминово – красный цвет. Какой оксид изучал Арфведсон? Напишите все упомянутые реакции.

1)Li 2 O + H 2 O→2LiOH
2) Li 2 O + 2HNO 3 → 2LiNO 3 + H 2 O
3) Li 2 O + CO 2 → Li 2 CO 3
4) 3Li 2 O + P 2 O 5 → 2Li 3 PO 4

Электроотрицательность
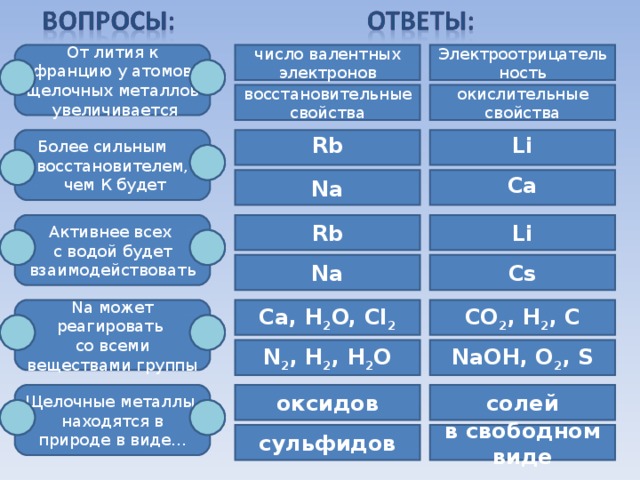
От лития к францию у атомов щелочных металлов увеличивается
число валентных электронов
окислительные свойства
восстановительные свойства
Li
Rb
Более сильным восстановителем,
чем К будет
Ca
Na
Активнее всех
с водой будет взаимодействовать
Li
Rb
Na
Cs
Na может реагировать
со всеми веществами группы
CO 2 , H 2 , C
С a, H 2 O, Cl 2
При выполнении этого задания необходимо выбрать правильный ответ и щелкнут по нему левой кнопкой мыши.
N 2 , H 2 , H 2 O
NaOH, O 2 , S
Щелочные металлы находятся в природе в виде…
оксидов
солей
в свободном виде
сульфидов
30

Закрепление
С помощью уравнений реакций осуществите превращения:
1) Na → Na 2 O 2 → Na 2 O
NaOH → Na 2 CO 3
- Li → Li 2 O → LiOH → LiCl
LiOH
30.10.16
30

1.Какой металл при взаимодействии с водой образует щелочь?
Si
Na
Cu
Cs
Fr
Li
Zn
Pb
K
4s 2
3s 1
1s 1
2s 2
6s 1
3s 2 3p 1
2s 1
4s 1
6s 2
2. Определите электронные формулу щелочных металлов.

Подведение итогов
- Сегодня я узнал (а) …
- Я удивился (лась)…
- Я хотел (а) бы…
Домашнее задание: § 11 с. 44-45, зад- к Кузнецовой Н.Е., Лёвкина № 8-43, 8-53





![Восстано-вительные свойства соединения Метал-лические свойства элемент А r Валентные электроны Атомный радиус Li 2 O, LiOH основные свойства Li 7 2s 1 )) Na 2 O, NaOH основные свойства 23 3s 1 Na ))) K 2 O, KOH основные свойства )))) 4s 1 39 K Rb 2 O, RbOH основные свойства Изучение нового материала. Все сведения не появляются сразу, а имеется возможность входе беседы с учащимися проверить их мнение и вместе дать общую характеристику щелочных металлов по их положению в таблице. ))))) 5s 1 85 Rb Cs 2 O, CsOH основные свойства 6s 1 133 )))))) Cs Радиоактивный элемент ))))))) [223] Fr 7s 1](https://fsd.kopilkaurokov.ru/uploads/user_file_54682cc818a9c/img_user_file_54682cc818a9c_0_5.jpg)





![Нахождение в природе Ортоклаз Альбит Хлорид натрия Формула К(А lSi 3 О 8 ) Формула NaCl Формула Na[AlSi 3 O 8 ] Сильвин Карналлит Сильвинит Формула NaCl • KCl Формула KCl·MgCl 2 ·6H 2 O Формула К Cl](https://fsd.kopilkaurokov.ru/uploads/user_file_54682cc818a9c/img_user_file_54682cc818a9c_0_11.jpg)



































