Министерство образования и науки Республики Казахстан
село Митрофановка, Уланский район, Восточно-Казахстанкая область
КГУ «Средняя школа имени Н. Лут»
Открытый урок в 8 классе по теме
«Щелочные металлы. Натрий»
с. Митрофановка, 2015
Цели урока:
Образовательная: создать условия для формирования знаний о щелочных металлах. Рассмотреть строение атома, физические и химические свойства, а так же биологическую роль и области применения этих металлов.
Воспитательная: Создать условия для воспитания навыков сотрудничества, умения слушать и работать в группах.
Развивающая: Формировать умения сравнивать, обобщать материал и находить главное. Устанавливать причинно-следственные связи состава- свойства- применения.
Тип урока: Сообщение новых знаний.
Методы: обяснительно-иллюстративные, исследовательские, мультимедийные курсы.
Формы работы: фронтальная, индивидуальная.
Оборудование: интерактивная доска, ПК, компьютерная презентация темы.
Реактивы: гидроксид натрия, фенолфталеин, метиловый оранжевый.
План урока: (презентация)
Организационный момент.
Изучение новой темы
А)История открытия и названия
Б)Характеристика щелочных металлов как s-элементов ПСХЭ Д.И. Менделеева.
В)Содержание в природе
Д)Физические свойства
Е)Химические свойства
Ж)Опыт
Е)Применение, биологическая роль.
Закрепление.
4.Подведение итогов урока, информация о домашнем задании
Организационный момент. Поздороваться, отметить отсутствующих.
Здравствуйте ребята и уважаемые гости!
Сегодня мы приступаем к изучению новой главы «Щелочные металлы. Галогены. Их соединения». Тема же нашего урока «Щелочные металлы. Натрий».(слайд 1)
На уроке мы познакомимся со свойствами щелочных металлов и историей их открытия. Рассмотрим их как химические элементы, выясним их биологическую роль в живых организмах и области применения на примере натрия.
Эпиграф нашего урока(слайд 2)
Великие законы мирозданья
В сущности наивны и просты
И порой нам не хватает мирозданья
Для разгадки этой простоты
2.Изучение новой темы.
Откройте ваши тетради, запишите сегодняшнее число и тему урока.
А) Открытие и название щелочных металлов (презентация)
Так почему же мы называем их щелочными? Как вы думаете, ребята? Запишем определение(сл3,4)
При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щелочами. Отсюда и пошло их название.
Наши девочки подготовили небольшие доклады. Послушаем их. Они познакомят нас с щелочными металлами ,расскажут нам об их открытии.(сл5,6,7,8,9,10)
Литий был открыт шведским химиком Й. Арведсоном в 1817 г.
По предложению Й.Берцелиуса назван литием (от греч. литос – камень).
Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807 г. при электролизе едких щелочей. Й. Берцелиус предложил назвать один новый элемент натрием (от араб. натрун – сода), а второй элемент по предложению Гильберта назван калием (от араб. алкали – щелочь).
Рубидий был открыт по характерным линиям в длинноволновой области спектра в 1861г. немецкими учёными Р. Бунзеном и Г. Киргофом. Цвет этих линий определил и название элемента. По латыни «рубидис» - тёмно-красный. В 1863г. Бунзен получил рубидий в чистом виде.
Цезий был первым элементом, открытым с помощью метода спектрального анализа. В 1860 г Р. Бунзен и Г. Киргоф по ярко-синим линиям в спектре обнаружили в воде минеральных источников в Боварии новый химический элемент. Название элемента происходит от лат. Слова «цезиус» - «небесно-голубой».
Франций был открыт в 1939г француженкой М. Пере. Она доказала, что этот элемент является продуктом распада актиния. Это радиоактивный элемент. Период его полураспада 22 минуты. В начале 50г удалось получить франций искусственно.
3. Характеристика щелочных металлов как s-элементов ПСХЭ Д.И. Менделеева
Вопрос учащимся: В каких группах подгруппах ПСХЭ находятся преимущественно типичные металлы? (Ответ: 1А и 2А). Мы рассмотрим металлы 1А группы- щелочные металлы. (сл 11, 12)
Щелочные металлы –это элементы главной подгруппы 1А группы ПСХЭ: литий, натрий, калий, рубидий, цезий, франций.
У атомов элементов 1А группы на внешнем энергетическом уровне находится один валентный электрон, расположенный на S –подуровне. Эти элементы относятся к S-элементам. Имея на последнем энергетическом уровне один валентный электрон, расположенном на большом расстоянии от ядра, атомы щелочных металлов отдают этот электрон. Поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1
(сл13) Все элементы 1А группы похожи между собой по свойствам, это объясняется однотипным строением последнего энергетического уровня. С ростом радиуса атома в группе Li-Na-K-Rb-Cs-Fr ослабевает связь валентного электрона с ядром. Соответственно, в этом ряду энергия ионизации атомов щелочных металлов уменьшается. Увеличиваются восстановительные свойства, уменьшаются температура плавления и кипения. Также уменьшается прочность химических связей
Рассмотрим щелочные металлы на примере натрия(сл 14, 15, 16, 17, 18, 19, 20, 21)
Название элемента натрий. Латинское название- Natrium.Символ хим.элемента – Na. Порядковый номер 11, электронная конфигурация внешнего слоя 3S1
Натрий находится в главной подгруппе,1 группы, он начинает 3 период, обладая самым большим размером атома, он содержит на внешнем энергетическом уровне 1 электрон, поэтому натрий, как и все щелочные металлы, слабо удерживает и легко отдает свой валентный электрон, являясь очень сильным восстановителем.Степень окисления в соединениях +1
Зарисуйте себе в тетрадь(сл21)

Содержание в природе(сл22)
По распространенности на нашей планете натрий занимает 6 место. На его долю приходится 2,64% массы земной коры. Из-за высокой активности в природе натрий встречается только в виде соединений. Важнейшие месторождения: Прикаспийская низменность, Приаралье,по течению реки Иртыш, Зап.Каз и др.
(сл23) Физические свойства.
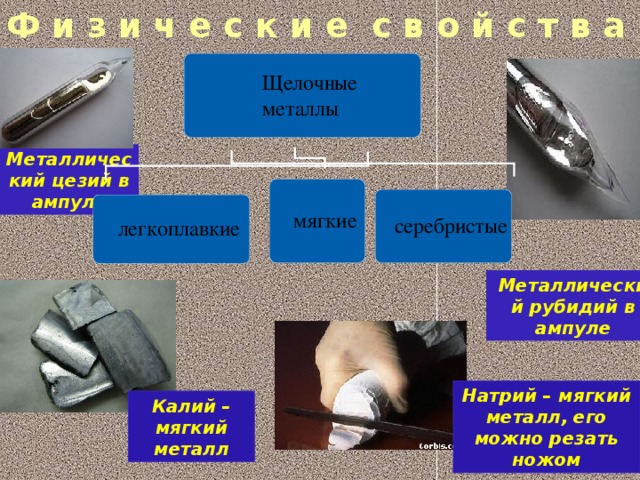
Все щелочные металлы очень мягкие, режутся ножом. Из-за высокой активности в природе встречаются только в виде соединений. Хранят металлы под слоем керосина или вазелинового масла, так как на воздухе они мгновенно покрываются налетом оксидов.
Натрий -это лёгкий серебристо-белый, мягкий как пластилин металл.Натрий легче воды, плотность равна 0,97г/см3. Характерный металлический блеск можно наблюдать у натрия только на свежем срезе.
При работе с натрием нужно соблюдать правила ТБ. Его нельзя брать руками, он способен вызвать ожог кожи. Остатки нельзя выбрасывать в раковину или мусорную корзину, может произойти возгорание или даже взрыв.
(сл24) Химические свойства.
Перейдем к рассмотрению химических свойств натрия
2Na + Н2 = 2NaН – гидрид натрия;
2Na + Сl2 = 2NaСl – хлорид натрия;
2Nа + S = Nа2S – сульфид натрия;
4 Na + О2 = 2Na2О2 –пероксид натрия.
б) со сложными веществами
2Nа + 2НОН = 2NаОН + Н2 гидроксид натрия
(сл 25)Натрий ,брошенный в воду, бурно реагирует с водой. При этом кусочек металла расплавляется (под действием выделяющейся теплоты) и «бегает» по поверхности. Его «толкает» выделяющийся водород, который может даже воспламениться и взорваться, если кусочек металла не очень маленький. Это очень опасно, поэтому для реакции натрия с водой берут кусочки металлы не больше горошины и соблюдать правила ТБ
С водными растворами солей и кислот проводить взаимодействие натрия также небезопасно. В первую очередь натрий будет реагировать с водой.
Опыт « Хим.св. на примере гидроксида натрия»(сл26)
Еще раз повторю, что при работе с натрием нужно быть осторожными и соблюдать правила техники безопасности
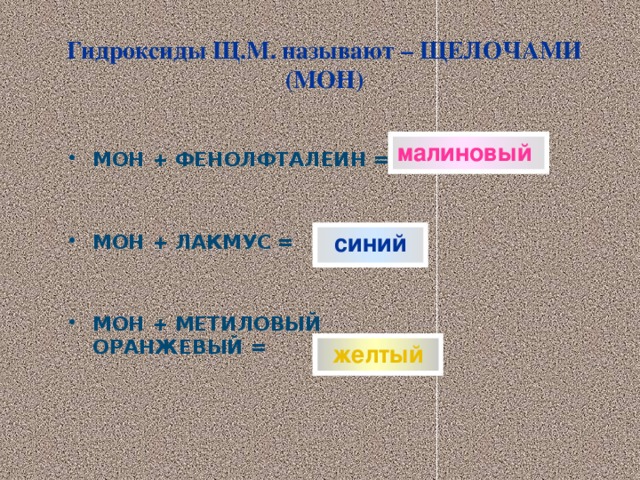
Растворимые в воде основания(щелочи) изменяют цвет индикаторов
ЩЕЛОЧЬ + ФЕНОЛФТ. = МАЛИНОВЫЙ
ЩЕЛОЧЬ + МЕТИЛОРАНЖ =ЖЕЛТЫЙ
ЩЕЛОЧЬ + ЛАКМУС = СИНИЙ
ПОСМОТРИМ ТАК ЛИ ЭТО?
Возьмем три пробирки с раствором гидроксида натрия
1 В первую пробирку добавим пипеткой несколько капель фенолфталеина. Гидроксид натрия приобрел малиновый цвет
2 Во вторую пробирку добавить несколько капель метилоранжа. Щелочь стала желтого цвета
3 В третью пробирку опустим лакмусовую бумажку – цвет стал синим.
Что и требовалось доказать!
Обнаружение натрия и его соединений.(сл 27)
Ионы натрия окрашивают пламя в желтый цвет. Эта реакция очень чувствительна.Достаточно провести платиновой проволочкой по ладони, а затем внести ее в пламя горелки, и мы тотчас увидим характерную желтую окраску.
Получение(сл28)
Поскольку натрий относится к самым активным восстановителям и легко отдает свой внешний электрон, заставить его ион принять этот электрон очень трудно. Поэтому получить натрий в свободном виде удалось только тогда, когда в начале 19 века ученые начали использовать электрический ток.
В 1807 году англ.ученый Г.Деви получил металлический натрий с помощью электролиза расплава гидроксида натрия.
Сейчас его получают разложением соединений электрическим током.
(сл 29,30,31)Биологическая роль щелочных металлов.
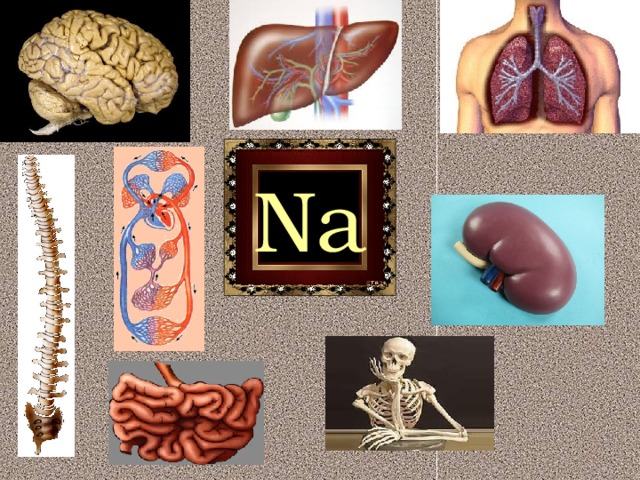
Теперь рассмотрим и биологическую роль натрия в живых организмах. По содержанию в организме человека натрий (0,08%) и калий (0,23%) относятся к макроэлементам, остальные – литий (10 -4%), рубидий (10-5 %) и цезий (10-4%) – микроэлементам. Щелочные металлы в виде различных соединений входят в состав тканей животных и человека. Натрий и калий – жизненно необходимые элементы, постоянно содержатся в организме, участвуют в обмене веществ. Литий, рубидий, цезий – также постоянно содержатся в организме, однако физиологическая и биохимическая роль их мало выяснена. Натрий – основной внеклеточный ион. В организме человека находится натрий в виде его растворимых солей, главным образом: хлорид натрия – NaCl, фосфат натрия – Na3PO4, гидрокарбонат натрия – NaHCO3. Натрий распределен по всему организму: в сыворотке крови, спинномозговой жидкости, пищеварительных соках, желчи, почках, коже, костной ткани, легких, мозге.
Ионы натрия играют важную роль.
В организм натрий поступает в виде поваренной соли – NaCl. Хлорид натрия – основной источник соляной кислоты для желудочного сока. Ежедневная потребность организма в натрии – 1 г.
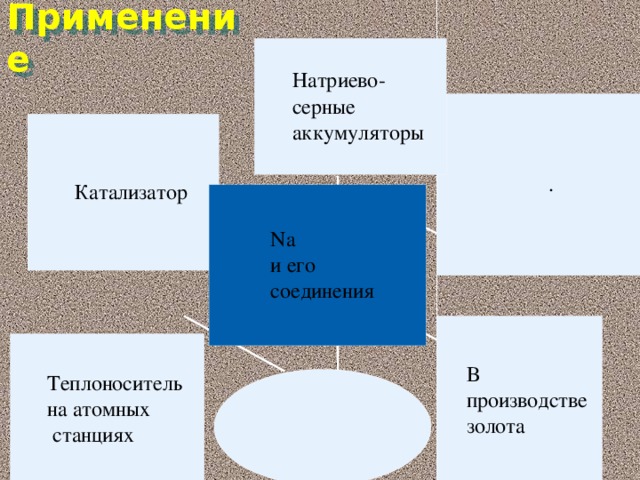
(Слайд 32) Области применения натрия. Металлический натрий находит разнообразное применение в современной науке и технике, медицине
8. Закрепление, подведение итогов.
Ребята, наш урок подходит к концу. О соединениях натрия вы узнаете на следующем уроке. А сейчас, чтобы понять как вы усвоили тему, ответьте на вопросы
Что же собой представляют щелочные металлы по физическим свойствам? (Li, Na, К - металлы серебристо-белого цвета). Легкие, легко режутся ножом.
Почему их хранят как Кощееву смерть? Вследствие своей активности хранят под слоем керосина, чтобы преградить доступ воздуха и влаги к металлам во избежание взрывов и пожаров.
Можно ли их тушить водой?
Эти вещества взрывоопасны. Нельзя тушить щелочные металлы водой, так как последняя энергично реагирует с ними. Остатки щелочных металлов на стенках сосудов после работы с ними также нельзя удалять водой. Для этих целей используют некоторые органические, например, этиловый спирт.
Учащимся предлагается решить небольшой тест.
1. Щелочные металлы – это:
а) р-элементы б) s-элементы в) d-элементы г) f - элементы
2. В ряду от лития к францию атомный радиус:
а) увеличивается б) уменьшается в) не изменяется г) сначала уменьшается, а затем увеличивается
3. При сгорании натрия пламя окрашивается в:
а) красный цвет б) желтый цвет в) фиолетовый цвет г) не окрашивает пламя
4. Основной внеклеточный ион – это:
а) литий б) натрий в) калий г) цезий
5. Степень окисления щелочных металлов равна:
а) +2 б) +1 в) -1 г) 0
Уходя с урока я хочу сказать…(сл33)
Информация о домашнем задании
9