
Урок химии в 9 классе

Очень древний я металл, Счёт столетьям потерял. Был нескромным я не в меру, Тысячи лет до нашей эры. А за блеск, мерцавший холодом, Люди там платили золотом!
Я давно в названии века, В организме человека. Называют мной характер, Из меня почти весь трактор. Очень в яблоке полезно, И зовут меня …
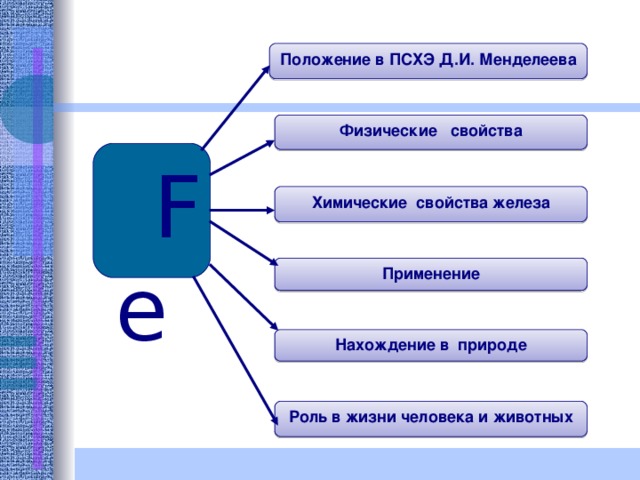
Положение в ПСХЭ Д.И. Менделеева
Физические свойства
Fe
Химические свойства железа
Применение
Нахождение в природе
Роль в жизни человека и животных

Железо, его физические и химические свойства

Положение элемента – железа в периодической системе Д.И. Менделеева.
- Порядковый номер
- Период
- Группа
- Подгруппа
- 26
- Четвертый
- VIII
- Побочная

Строение атома железа
26
30
26
- Расположение электронов по энергетическим уровням:
2,8,14,2
- Допишите электронную формулу
1s 2 2 s 2 2р 6 3 s 2 3р 6 ….

1s 2 2 s 2 2р 6 3 s 2 3р 6 3d 6 4 s 2
Какие электроны для элементов главных подгрупп являются валентными?
А какие электроны для элементов побочных подгрупп являются валентными?
Запомни!
Особенностью электронного строения элементов побочных подгрупп является заполнение электронами не последнего, а предпоследнего уровня.

Почему из такого количества металлов побочных подгрупп для изучения выбрали один- именно железо ?
- Наиболее широко используется в современной промышленности.
- Велика его распространенность в природе.
- Важен с биологической точки зрения.

Физические свойства железа:
- Серебристо-белый
- Блестящий
- Очень пластичный, легко куется, прокатывается, штампуется
- Намагничивается и размагничивается
- 1539 0 С
- Магнитные свойства
- Температура плавления
- Твердость
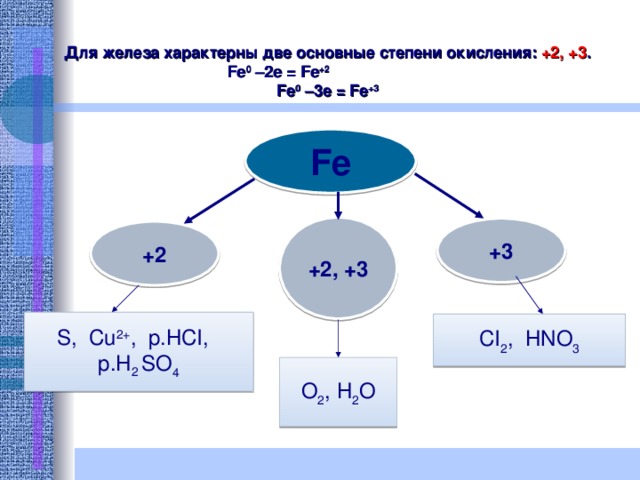
Для железа характерны две основные степени окисления: +2, +3 .
Fe 0 –2e = Fe +2
Fe 0 –3e = Fe +3
Fe
+2, +3
+ 3
+2
S, Cu 2+ , p.HCI,
p.H 2 SO 4
CI 2 , HNO 3
O 2 , H 2 O
 Fe 3 O 4 ( FeO • Fe 2 O 3 )" width="640"
Fe 3 O 4 ( FeO • Fe 2 O 3 )" width="640"
Химические свойства железа
Взаимодействие с простыми веществами -неметаллами
1) С кислородом.
0 0 +2 , +3 -2 +2 -2 +3 -2
3 Fe + 2O 2 —Fe 3 O 4 ( FeO • Fe 2 O 3 )


Химические свойства железа
Взаимодействие с простыми веществами - неметаллами.
2) С серой и хлором.
Запишите уравнение реакции

 Fe 3 O 4 + 4H 2 0 при t =700 0 - 900 0" width="640"
Fe 3 O 4 + 4H 2 0 при t =700 0 - 900 0" width="640"
Химические свойства железа
Взаимодействие со сложными веществами
1) с водой.
+2, +3
3 Fe 0 + 4H 2 O — Fe 3 O 4 + 4H 2 0
при t =700 0 - 900 0

Лабораторные опыты
- «Взаимодействие железа с растворами кислот и солей»
Оборудование: Fe, раствор HCl, раствор CuSO 4 , штатив, пробирки.
Правила безопасности.
Соблюдайте осторожность при работе с растворами кислот.
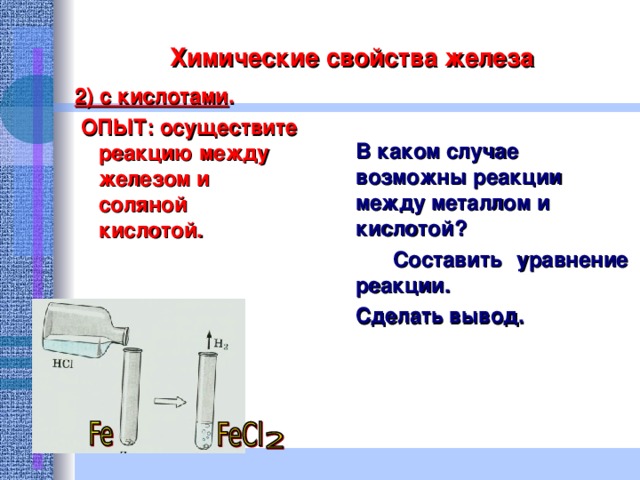
Химические свойства железа
2) с кислотами .
ОПЫТ: осуществите реакцию между железом и соляной кислотой.
В каком случае возможны реакции между металлом и кислотой?
Составить уравнение реакции.
Сделать вывод.
 FeCl 2 + H 2 1. Металл находится в ряду активности металлов до водорода. 2. Должна получиться растворимая соль. 3. Реакция характерна для растворов кислот. 4. Металл + кислота → соль + водород Металлы взаимодействуют с кислотами если:" width="640"
FeCl 2 + H 2 1. Металл находится в ряду активности металлов до водорода. 2. Должна получиться растворимая соль. 3. Реакция характерна для растворов кислот. 4. Металл + кислота → соль + водород Металлы взаимодействуют с кислотами если:" width="640"
Fe + 2HCl —FeCl 2 + H 2
1. Металл находится в ряду активности металлов до водорода.
2. Должна получиться растворимая соль.
3. Реакция характерна для растворов кислот.
4. Металл + кислота → соль + водород
Металлы
взаимодействуют
с кислотами
если:

Химические свойства железа
3) С солями.
ОПЫТ: осуществите реакцию между железом и раствором хлорида меди (II).
В каком случае возможны реакции между металлом и растворами солей?
Составить уравнение реакции.
Сделать вывод.
 FeCl 2 + Cu Металлы взаимодействуют с растворами солей если: 1. Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. 2. Обе соли (и реагирующая, и образующая в результате реакции) должны быть растворимыми ." width="640"
FeCl 2 + Cu Металлы взаимодействуют с растворами солей если: 1. Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. 2. Обе соли (и реагирующая, и образующая в результате реакции) должны быть растворимыми ." width="640"
Fe + CuCl 2 — FeCl 2 + Cu
Металлы
взаимодействуют с растворами солей
если:
1. Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений.
2. Обе соли (и реагирующая, и образующая в результате реакции) должны быть растворимыми .

Трубопроводы
для воды,
нефти и газа
Гидроэлектро-
станции и опоры
линий электропередач
Железо сегодня
Автомобили ,
Тракторы,
Подводные лодки,
Бытовые приборы,
Другие предметы

Лабораторные опыты
- «Ознакомление с образцами природных соединений железа»
- Оборудование: природные образцы, вода, стакан, стеклянная палочка.

Природные соединения железа:
- Fe 3 O 4 – магнитный железня к
- Fe 2 O 3 – красный железняк (гематит)
- 2 Fe 2 O 3 * 3 H 2 O – бурый железняк
- FeS 2 – железный колчедан

Способы получения железа
- восстановление железа из его оксида оксидом углерода или водородом;
- Fe 2 O 3 + 3CO → 2Fe + 3CO 2
- восстановление железа из его оксида алюминотермическим методом;
- Fe 2 O 3 + 2 Al → Al 2 O 3 + 2 Fe
- электролизом водных растворов солей железа


Железо в виде ионов присутствует в организмах всех животных и, конечно же, человека.
Основная биологическая функция железа – участие в транспорте кислорода ко всем органам и окислительных процессах.
В организме человека с массой тела прниблизительно70 кг содержится 4,2 г железа, а в 1 л крови – 450 мг.
При недостатке железа в организме развивается железистая анемия.
Перенос железа в организме осуществляет важнейший белок –гемоглобин, в котором находится больше половины всего железа организма.
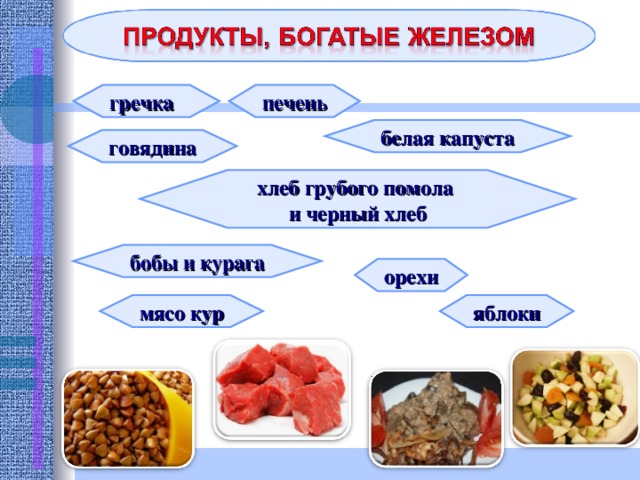
гречка
печень
белая капуста
говядина
хлеб грубого помола
и черный хлеб
бобы и курага
орехи
мясо кур
яблоки

Будьте внимательны к своему здоровью: наличие достаточного количества гемоглобина – это наша жизнь!!!
При анемии (недостатке гемоглобина) увеличьте в своем рационе количество нежирного говяжьего мяса и печени, красной икры, а также яичных желтков.
При анемии, для приготовления пищи, рекомендуется использовать чугунную посуду.
Как показали эксперименты, приготовление и кипячение соуса на протяжении 20 минут в такой посуде, способствует увеличению количества железа в 9 раз.
Людям с пониженным гемоглобином необходимо чаще бывать на свежем воздухе.

Итоговый тест. Отметить знаком «+» номер положения, которое считается верным
Вариант 1.
Вариант 2.
- 1/ Железо – это активный щелочной металл.
- 2/ Железо легко куется.
- 3/ Железо входит в состав сплава бронзы.
- 4/ На внешнем энергетическом уровне атома железа 2 электрона.
- 5/ Железо взаимодействует с разбавленными кислотами.
- 6/ С галогенами образует галогениды со степенью окисления +2.
- 7/ Железо не взаимодействует с кислородом.
- 8/ Железо можно получить путем электролиза расплава его соли.
- 1/ Железо – это металл серебристо-белого цвета.
- 2\ Железо не обладает способностью намагничиваться.
- 3\ Атомы железа проявляют окислительные свойства.
- 4\ На внешнем энергетическом уровне атома железа 1 электрон.
- 5\ Железо вытесняет медь из растворов ее солей.
- 6\ С галогенами образует соединения со степенью окисления +3.
- 7\ С раствором серной кислоты образует сульфат железа (II).
- 8\ Железо не подвергается коррозии.

Ответы
Критерии отметки:
“ 5” – 0 ошибок,
“ 4” – 1-2 ошибки,
“ 3” – 3-4 ошибки,
“ 2” – 5 и больше ошибок.

- Сегодня я понял (а), что……….
- Главным на уроке для меня было………
- Больше всего мне запомнилось………….
-

- Домашнее задание: параграф 14,
- вопрос 5 стр 82 (вспомнить окислительно – восстановительные реакции, уравнение электронного баланса )










 Fe 3 O 4 ( FeO • Fe 2 O 3 )" width="640"
Fe 3 O 4 ( FeO • Fe 2 O 3 )" width="640"



 Fe 3 O 4 + 4H 2 0 при t =700 0 - 900 0" width="640"
Fe 3 O 4 + 4H 2 0 при t =700 0 - 900 0" width="640"


 FeCl 2 + H 2 1. Металл находится в ряду активности металлов до водорода. 2. Должна получиться растворимая соль. 3. Реакция характерна для растворов кислот. 4. Металл + кислота → соль + водород Металлы взаимодействуют с кислотами если:" width="640"
FeCl 2 + H 2 1. Металл находится в ряду активности металлов до водорода. 2. Должна получиться растворимая соль. 3. Реакция характерна для растворов кислот. 4. Металл + кислота → соль + водород Металлы взаимодействуют с кислотами если:" width="640"

 FeCl 2 + Cu Металлы взаимодействуют с растворами солей если: 1. Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. 2. Обе соли (и реагирующая, и образующая в результате реакции) должны быть растворимыми ." width="640"
FeCl 2 + Cu Металлы взаимодействуют с растворами солей если: 1. Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. 2. Обе соли (и реагирующая, и образующая в результате реакции) должны быть растворимыми ." width="640"




























