Урок химии в 9классе
Урок проводится согласно календарно-тематическому планированию
Тема «Кислород»
Цель урока: дать важные сведения о химическом элементе и простом веществе – кислороде; раскрыть распространенность кислорода в природе; познакомить учащихся с физическими свойствами кислорода;
Задачи: обучать самостоятельному поиску необходимой информации при работе с учебником и другими источниками литературы; обучать умению делать выводы;
развивать: любознательность и высокую познавательную активность учащихся на уроке; прививать и развивать навыки делового общения; монологическую речь учащихся с использованием химической терминологии.
воспитывать у учащихся: ответственное отношение к природе, понимание огромного значения кислорода для жизни на земле; воспитывать первоначальное представление о необходимости защиты чистоты атмосферы; воспитывать интерес учащихся к предмету.
Оборудование: кроссворд, мультимедийная презентация, информационно - обучающую программу: химия учебно – тренировочные тематические тестовые задания с использованием контрольно – оценочной системы (подготовка к ЕГЭ) - "Chemistry 2010"
Тип урока : изучение нового материала (с элементами беседы и самостоятельной работы учащихся).
Ход урока:
Этапы урока
Слайд
презентации
Организационный - приветствие учащихся, выявление отсутствующих в классе
Актуализация знаний с целью настроя на восприятие нового материала: ребята разгадывают кроссворд «Элементы в банке» (приложение). В выделенном столбце слово – КИСЛОРОД.
Слайд
«Кроссворд в банке»
Изучение нового материала: появляются слова – девиз урока:
Без кислорода - беда: ведь он нужен для дыхания
и горения, без него нет ни жизни, ни тепла.
Это самое главное вещество Земли.
Слайд № 2
Сообщение темы и цели урока, демонстрация слайда с названием, запись темы в тетрадях
Слайд № 3
Учащимся предлагается дать характеристику элементу – кислород, после демонстрируется слайд «Характеристика элемента – кислород» с целью корректировки информации, найденной учащимися самостоятельно. Учащиеся делают записи в тетрадях.
Слайд № 4
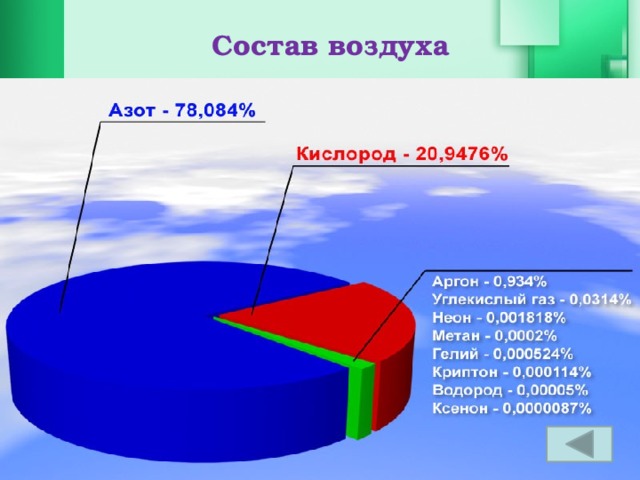
С помощью учебника учащимся предлагается описать физические свойства кислорода. Демонстрируется слайд, дополняющий информацию учебника соответствующими
ссылками на фото жидкого и кристаллического кислорода.
Слайд № 12,
Слайд № 3
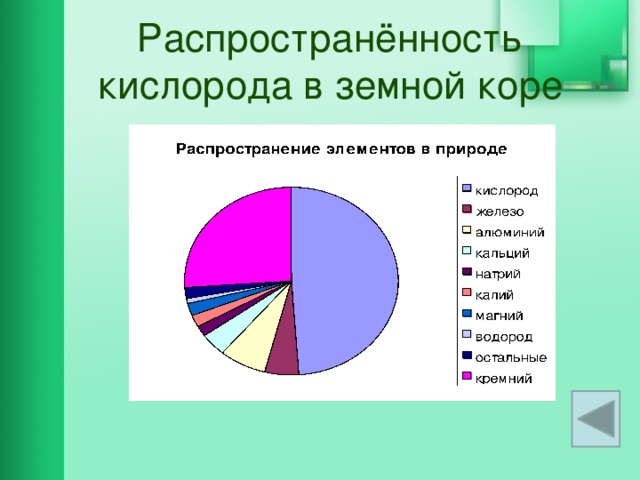
Далее учащиеся с помощью учебника и дополняющей информации из презентации рассматривают нахождение кислорода в природе и делают вывод, что кислород самый распространенный химический элемент на Земле.
Слайд №6,
Слайд№10, Слайд №11
Рассматривая вопрос о получении кислорода, акцентируется внимание учащихся на важнейшем процессе природы – фотосинтезе, о том, что кислород является его побочным продуктом.
Предлагаем решить задачу с использованием уравнения процесса фотосинтеза, один учащийся у доски, остальные на местах. Условие, а потом и решение задачи демонстрируется на слайдах презентации - пошагово.
Слайд № 7
Задача - Слайд № 14
Продолжаем беседу о получении кислорода в лабораторных условиях и промышленности, с записью соответствующих уравнений реакций в тетради. В презентации демонстрируется видеооопыт разложения перманганата калия и определение наличия кислорода. Учащиеся делают вывод о способности кислорода поддерживать горение.
Слайд № 7
Видеоопыт
school-collection.edu.ru
В ходе дальнейшей беседы учащиеся должны прийти к выводу об окислительных свойствах кислорода, что в нём горят металлы и неметаллы, а также сложные вещества. Во время данной беседы демонстрируются видеопыты горения серы, магния и железа в кислороде. В интерактивном режиме демонстрируются уравнения горения данных веществ. Делаем вывод, что реакции с участием кислорода ОВР, экзотермические (в зависимости от времени можно предложить задачу по термохимическому уравнению) и называются горением (звучит аудиозапись с определением понятия «горение»)
Слайд № 8
Видеоопыт
http://himekoscho.ucoz.ru
интерактивная таблица свойств кислорода и аудиозапись
school-collection.edu.ru
О применении кислорода учащиеся узнают после просмотра видео интернет – урока.
Слайд № 8
http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/primenenie-kisloroda
Закрепление материала завершаем самостоятельной работой с использованием информационно - обучающей программы: химия учебно-тренировочные тематические тестовые задания с использованием контрольно – оценочной системы (подготовка к ЕГЭ) - "Chemistry 2010"
"Chemistry 2010"
Итоги урока, выставление оценок и запись домашнего задания.