Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Презентация к уроку химии в 8 классе по теме "Кислоты"
Презентация знакомит учащихся с составом, классификацией, представителями кислот, качественными реакциями на кислоты. В ней представлено значение кислот в организме человека и животных.
Тема урока: Кислоты
Цели и задачи урока:
1. Познакомить учащихся с составом, классификацией, представителями кислот, качественными реакциями на кислоты.
2. Развивать умения учащихся наблюдать, анализировать опыты, делать выводы о зависимости свойств веществ от состава и строения.
3. Способствовать воспитанию любознательности и интереса к предмету с помощью эксперимента и использования электронных средств наглядности.
Оборудование: на столах учащихся пробирки с водой, растворами гидроксида калия, соляной кислоты, кристаллические лимонная и аскорбиновая кислоты, таблетка витамина С, индикаторы. Диск с интерактивными играми, компьютер, проектор, экран.
План урока.
1. Организационная часть. Сообщение темы урока.
2. Домашнее задание.
3. Проверка знаний предыдущего материала.
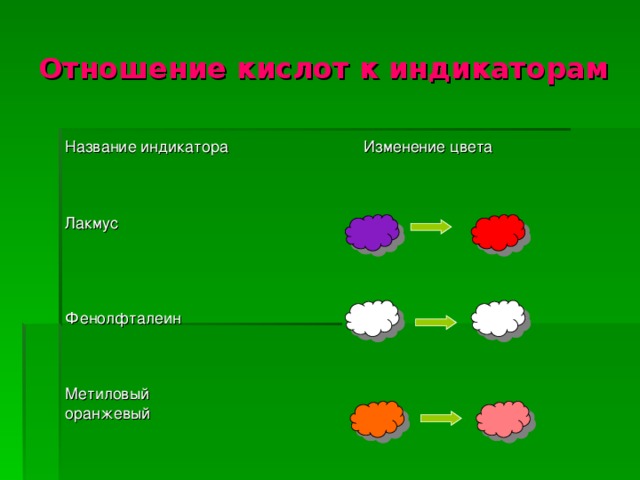
4. Изучение нового материала. Лабораторный опыт «Действие кислот на индикаторы»
5. Закрепление
6. Подведение итогов урока. Рефлексия.
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Презентация к уроку химии в 8 классе по теме "Кислоты" »
Похожие файлы
Полезное для учителя
Распродажа видеоуроков!
1520 руб.
2530 руб.
1660 руб.
2760 руб.
1700 руб.
2840 руб.
1880 руб.
3140 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства