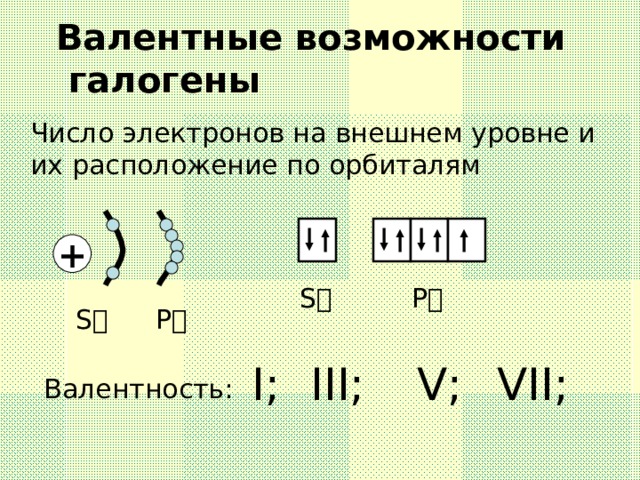
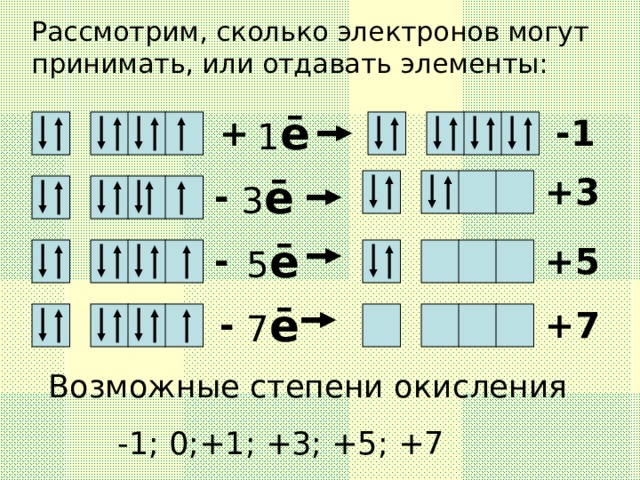
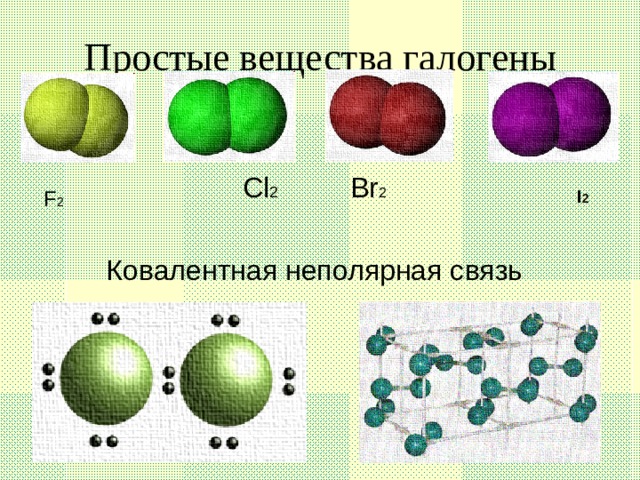
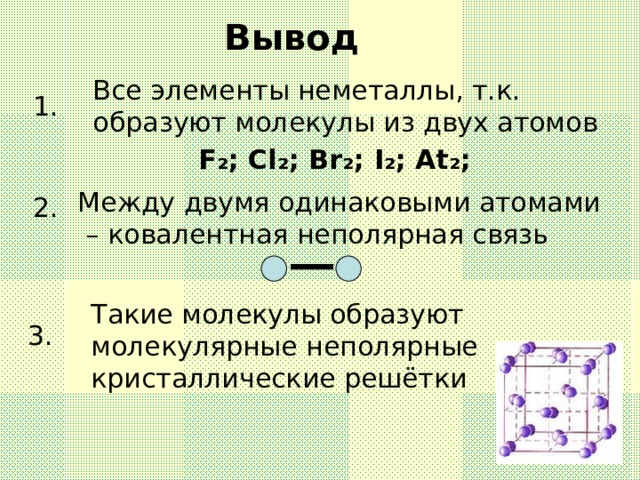
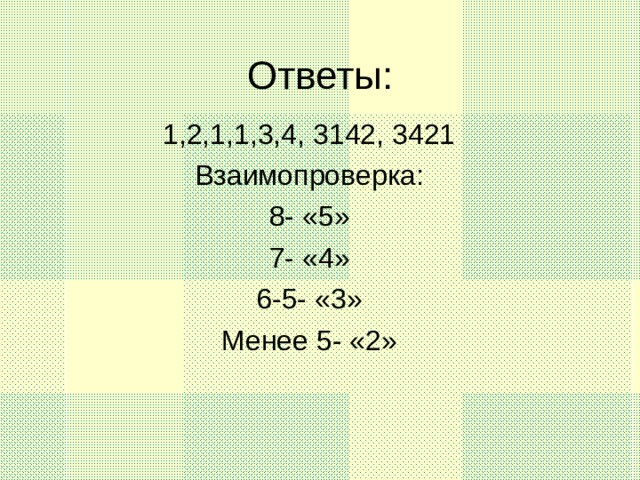
Данную презентацию используют как сопровождение на уроке по теме " Галогены",помогает создать или дополнить образ представляемых веществ " Галогены", их строение,свойства и историю открытия.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Презентация на тему "Галогены"
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Презентация на тему "Галогены"»
Похожие файлы
Полезное для учителя
Распродажа видеоуроков!
2200 руб.
3140 руб.
2200 руб.
3140 руб.
1990 руб.
2840 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства