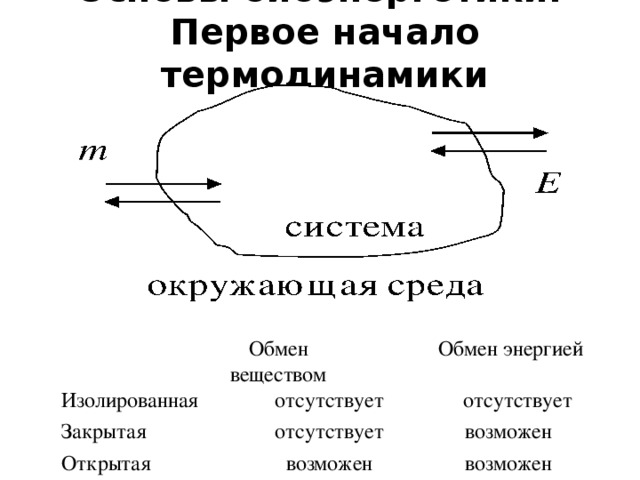
•Параметры состояния системы – физические величины, определяющие термодинамические свойства системы
•Интенсивные параметры – величины, значения которых не зависят от массы системы. К ним относятся: температура (T), давление (p), концентрация (c), плотность (ρ) и другие. В пределах одной фазы интенсивные параметры остаются постоянными или изменяются непрерывно, а при переходе через фазовую границу – скачкообразно. При взаимодействии двух и более систем значения их интенсивных параметров усредняются.
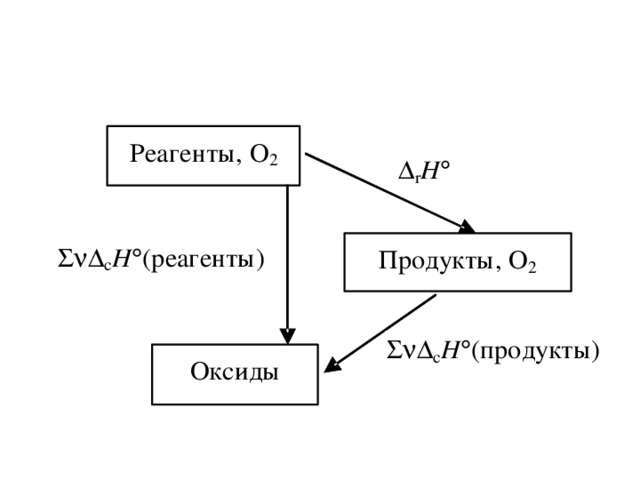
• Экстенсивные параметры – величины, значения которых зависят (пропорциональны) массе; к ним относятся: объем (V), количество вещества (ν), внутренняя энергия (U), энтальпия (H) и другие. Значения экстенсивных параметров системы равны сумме параметров всех частей системы. При взаимодействии систем их экстенсивные параметры суммируются. После отнесения к единице массы (удельные величины) или к единице количества вещества (мольные величины) экстенсивные параметры приобретают свойства интенсивных!








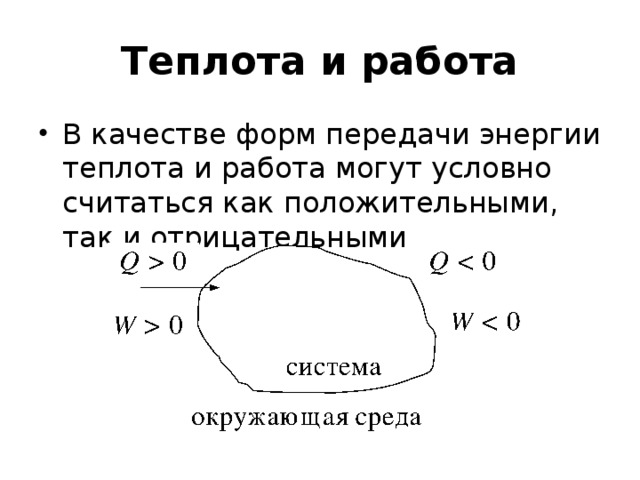








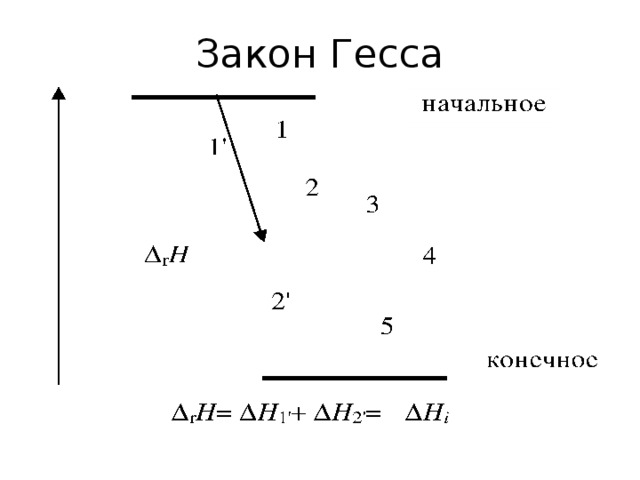


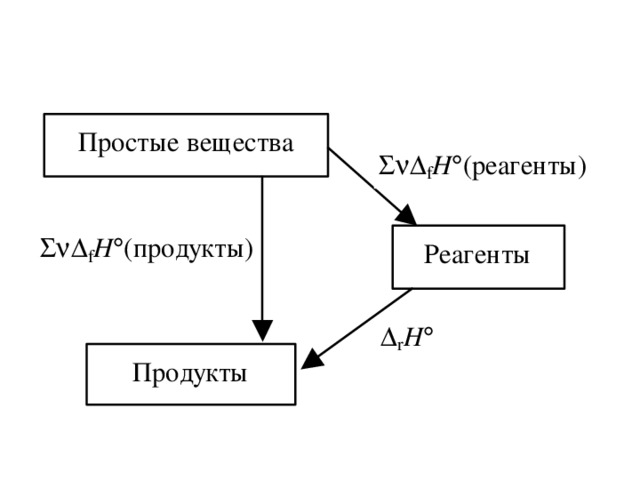
![Пример. Рассчитайте стандартную теплоту реакции 2 H 2 S (г) + 6 NO (г) = 2 H 2 O (ж) + 2 SO 2 (г) + 3 N 2 (г). (записываем под формулами веществ значения f H из таблицы) f H , кДж/моль 20,5 -90 286 297 0 Вычислим r H : r H = [2( 286) + 2( 297)] [2( 20,5) + 6 90] = 1665 кДж/моль.](https://fsd.kopilkaurokov.ru/uploads/user_file_54060ec945c48/img_user_file_54060ec945c48_23.jpg)















