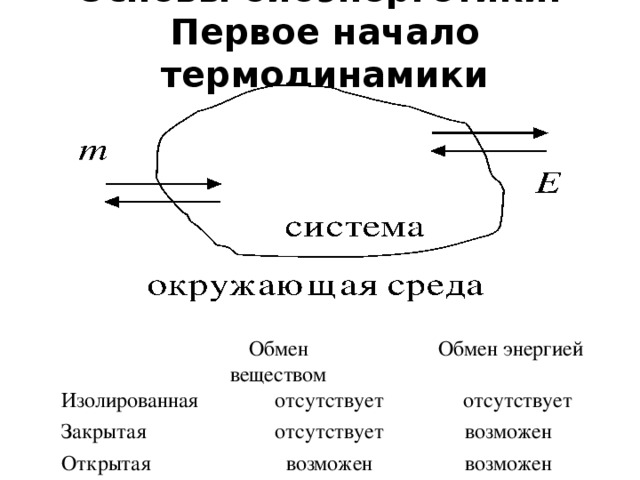
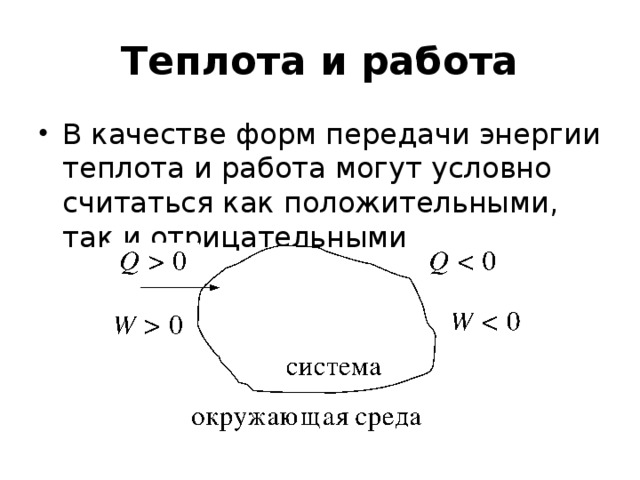
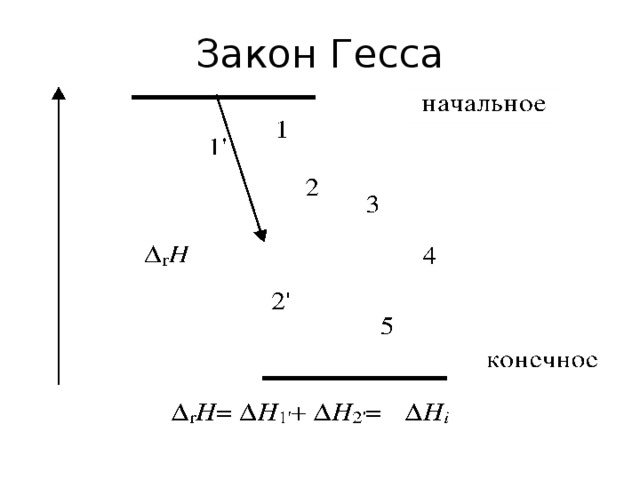
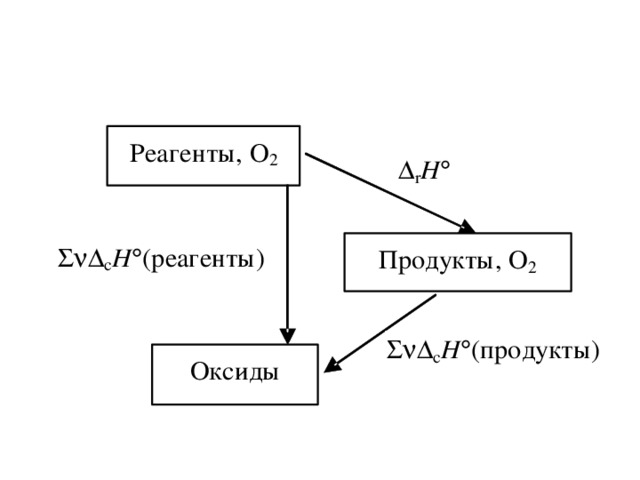
•Функции состояния – функции независимых параметров, изменения которых в ходе процесса не зависят от пути процесса, а определяются только начальным и конечным состоянием системы.
• Уравнения, связывающие функции состояния и независимые переменные, называются уравнениями состояния. Функциональные зависимости определяются на основе законов (начал) термодинамики.


















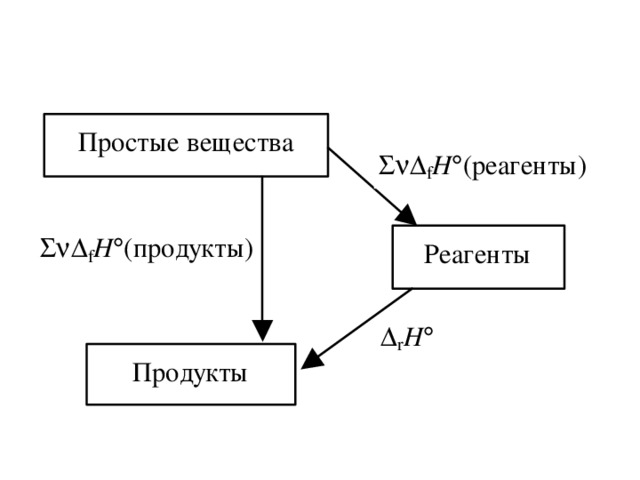
![Пример. Рассчитайте стандартную теплоту реакции 2 H 2 S (г) + 6 NO (г) = 2 H 2 O (ж) + 2 SO 2 (г) + 3 N 2 (г). (записываем под формулами веществ значения f H из таблицы) f H , кДж/моль 20,5 -90 286 297 0 Вычислим r H : r H = [2( 286) + 2( 297)] [2( 20,5) + 6 90] = 1665 кДж/моль.](https://fsd.kopilkaurokov.ru/uploads/user_file_5400a75fd952f/img_user_file_5400a75fd952f_23.jpg)















