
9 класс
Разработка учителя химии I квалификационной категории
МБОУ «Красночетайская СОШ
Красночетайского района
Чувашской Республики
Мидаковой Н.В.

Цель урока:
Повторит строение атома на примере углерода, нахождение в природе, модификации углерода, их физические свойства и применение, используя современные технологии обучения.
Периоды
Ряды
Группы элементов
V
VIII
VI
VII
IV
III
II
I
1
2
He
Н
1
1
1.008
4,003
Гелий
Водород
3
10
8
9
7
6
5
4
F
C
N
Li
O
Ne
B
Be
2
2
12,011
18,998
6,941
10,811
9,012
15,998
14,00
20,179
Фтор
Углерод
Неон
Литий
Кислород
Бериллий
Азот
Бор
16
15
11
17
14
12
18
13
A r
Al
Р
S
Na
Mg
Cl
Si
3
3
26,9815
35,453
30,9738
24,312
39,948
32,064
28,086
22,9898
Аргон
Алюминий
Хлор
Натрий
Сера
Кремний
Магний
Фосфор
22
Ni
Co
Fe
Mn
19
20
Cr
21
28
23
V
24
25
26
27
Ti
Ca
K
Sc
4
4
54,938
58,933
55,847
51,996
50,941
58,70
44,956
47,90
40,08
39,098
Кальций
Никель
Калий
Скандий
Железо
Марганец
Хром
Титан
Кобальт
Ванадий
Kr
Cu
29
35
Br
Se
36
Ge
Zn
As
30
Ga
34
33
32
31
5
65,38
83,80
63,546
72,59
69,72
74,922
78,96
79,904
Бром
Галлий
Селен
Цинк
Медь
Мышьяк
Криптон
Германий
41
40
Rh
Pd
39
45
Sr
Ru
46
Tc
Mo
44
Rb
38
Nb
37
Zr
Y
43
5
42
6
87,62
98,906
95,94
92,906
101,07
91,22
88,906
102,905
106,4
85,468
Стронций
Рутений
Родий
Иттрий
Палладий
Рубидий
Технеций
Молибден
Ниобий
Цирконий
Xe
Cd
50
Ag
51
52
I
In
49
Te
53
Sb
54
Sn
47
48
7
131,30
126,906
107,863
112,41
114,82
118,69
127,60
121,75
Теллур
Кадмий
Сурьма
Индий
Олово
Серебро
Иод
Ксенон
Pt
Cs
74
Hf
75
76
W
Ta
77
72
57
Ba
78
Re
56
Os
55
Ir
La
73
8
6
180,94
185,206
190,2
138,905
137,33
132,95
183,85
195,02
192,22
178,49
Гафний
Лантан
Вольфрам
Тантал
Цезий
Платина
Иридий
Осмий
Рений
Варий
Rn
Tl
84
Au
Pb
Hg
At
86
85
Po
83
Bi
81
80
79
82
9
207,2
200,59
(210)
196,966
208,988
(209)
204,37
(222)
Радон
Висмут
Золото
Ртуть
Астат
Таллий
Поллоний
Свинец
108
107
Hs
Mt
Bh
Sg
109
110
Ds
104
106
Db
105
87
89
88
Rf
Ac
Ra
Fr
10
7
(269)
(269)
(266)
(268)
(271)
(261)
(262)
(223)
(227)
226,025
Радий
Франций
Резерфордий
Актиний
Дубний
Мейтнерий
Хассий
Сборгий
Борий
RO 4
RO 2
R 2 O 7
RO 3
R 2 O 5
R 2 O 3
RO
R 2 O
ВО
RH 4
RH 3
H 2 R
HR
ЛВС
3

Периоды
Ряды
Группы элементов
II
III
IV
V
VI
VII
VIII
I
1
1
С
6
Характеристика элемента
1
2
2 период IVA группа
3
В природе встречается как в свободном виде (алмаз, графит), так и в связанном состоянии
4
Степень окисления в соединениях от -4 до +4
( углекислый газ, карбонаты, уголь, нефть и т.д.)
5
Химическая формула С
Относительная молекулярная масса Мr = 12
12.011
2
2
4
2
Углерод
С
3
0
12
3
4
4
5
5
6
7
+6
8
6
Carboneum
9
10
7
R 2 O 3
R 2 O
RO 4
R 2 O 7
RO 3
R 2 O 5
RO 2
RO
ВО
H 2 R
RH 4
HR
RH 3
ЛВС
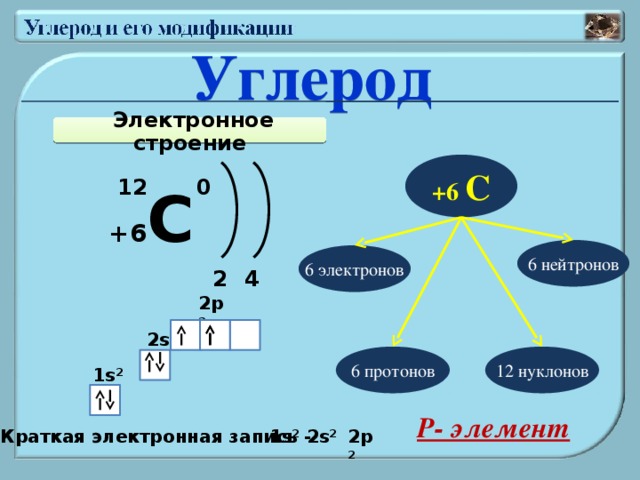
Углерод
Электронное строение
+6 С
0
12
+6 С
6 нейтронов
6 электронов
2
4
2р 2
2s 2
6 протонов
12 нуклонов
1s 2
Р- элемент
2р 2
2s 2
1s 2
Краткая электронная запись -
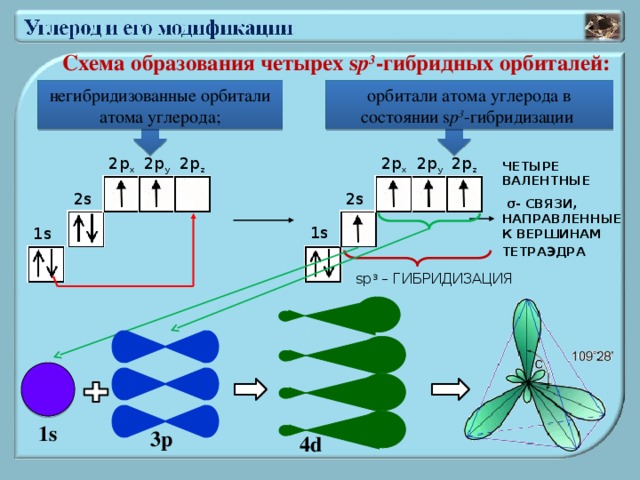
Схема образования четырех s p 3 -гибридных орбиталей:
орбитали атома углерода в состоянии s p 3 -гибридизации
негибридизованные орбитали атома углерода;
2p y
2p x
2p y
2p z
2p x
2p z
ЧЕТЫРЕ ВАЛЕНТНЫЕ
σ- СВЯЗИ, НАПРАВЛЕННЫЕ К ВЕРШИНАМ ТЕТРАЭДРА
2s
2s
1s
1s
sp 3 – ГИБРИДИЗАЦИЯ
1s
3р
4d
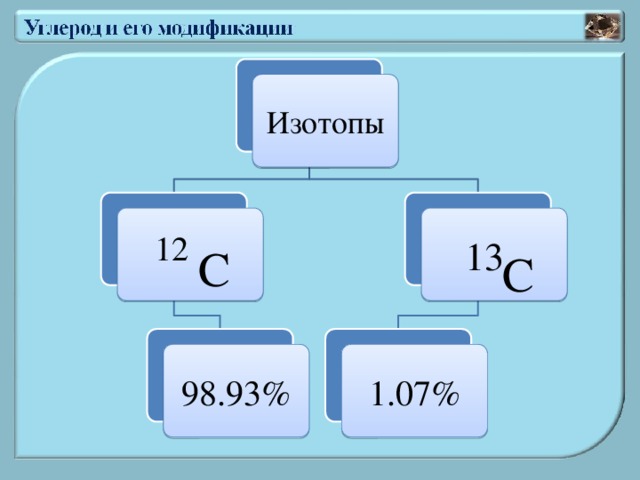
Изотопы
12
13
С
С
98.93%
1.07%

Степень окисления атома С в соединениях
органические
неорганические
+2 +4
-4/-3 -2 -1 0
+1 +2 +3
+4
-2
+1
+1
-2
+4
+2
-2
NaHCO 3
СО СО 2
1*(+1)+1*(+1)+X+3*(-2)=0
X=+4
в неорганических II и IV.
Валентность в органических соединениях – IV,
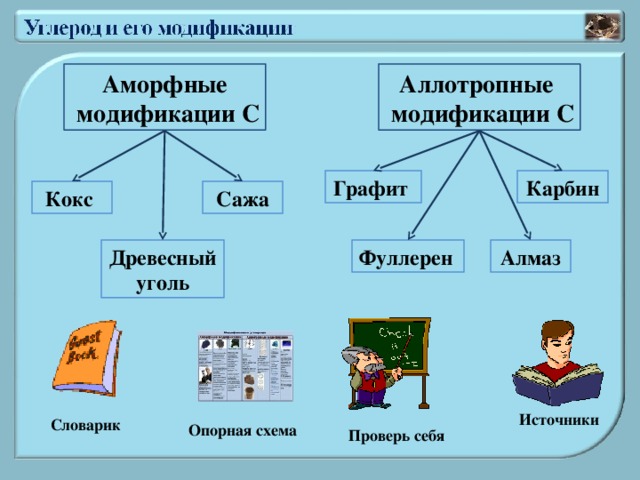
Аллотропные
Аморфные
модификации С
модификации С
Графит
Карбин
Кокс
Сажа
Алмаз
Фуллерен
Древесный уголь
Источники
Словарик
Опорная схема
Проверь себя
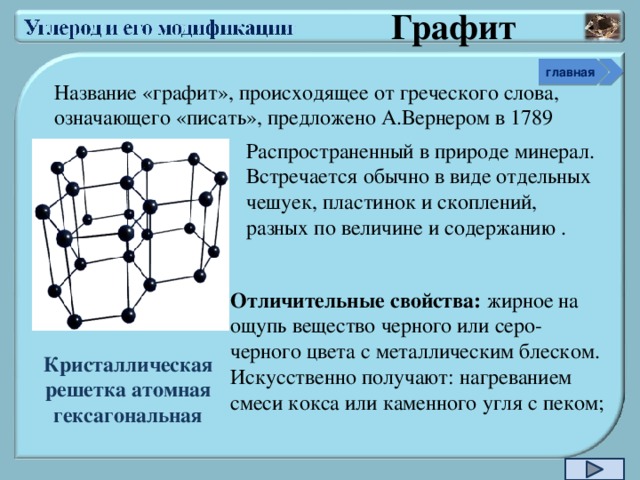
Графит
главная
Название «графит», происходящее от греческого слова, означающего «писать», предложено А.Вернером в 1789
Распространенный в природе минерал. Встречается обычно в виде отдельных чешуек, пластинок и скоплений, разных по величине и содержанию .
Отличительные свойства: жирное на ощупь вещество черного или серо-черного цвета с металлическим блеском. Искусственно получают: нагреванием смеси кокса или каменного угля с пеком;
Кристаллическая решетка атомная
гексагональная

Графит
ПРИМЕНЕНИЕ
главная
- Графитовый порошок – изготовление минеральных красок.
- Смазочный материал (в смеси с маслом) – между отдельными слоями графита взаимодействие настолько слабо, что возникает скольжение. Чешуйки графита заполняя неровности поверхности создают гладкую поверхность.
- Графитовые стержни – электроды – электропроводность.
- Тигли, блоки для атомных реакторов – тугоплавкость.
- Теплозащитный материал для головных частей ракет – термостойкость.
- Получение карбидов – легко реагирует с металлами.
- Изготовление простых карандашей.

Графит
Материалы на основе графита
главная
- Графлекс или пенографит – высокопористый материал заменяет резину и металл.
- Стеклоуглерод – химически стоек, заменяет платиновую химическую посуду.
- Пирографит – для изготовления искусственных клапанов сердца
- Углеродное волокно как наполнитель в пластики для придания большей прочности и электропроводности, лёгкие эластичные электронагреватели
- Рис. Углеродная ткань и углеродное волокно, стаканчик из стеклоуглерода

Графит
КАРАНДАШ
главная
- Первые графитовые карандаши появились в XVIII веке. Это было связано с открытием графитового месторождения в Камберленде (Англия).
- В 1795 г. в Париже по способу Конта изготовлялись карандаши из смеси графита и глины, обожжённые в печи. Эта технология используется и по сей день. Чем больше глины – тем твёрже карандаш. В особые мягкие карандаши добавляют воск и сало – ими можно писать на стекле. Особый сорт рыхлых карандашей служит для пастельной живописи

Древесный уголь
главная
Образуется при разложении древесины без доступа воздуха. Обладает способностью к адсорбции – способностью поглощать различные вещества. Это явление используется для очистки сахара, спирта, в фильтре противогаза. Активированный уголь прокаливают на перегретом пару, число пор при этом увеличивается, что улучшает адсорбцию.

Сажа
главная
Сажа - черный дисперсный продукт неполного сгорания или термического разложения углеродистых веществ. В технике получают из углеводородов (отсюда другое название сажи - технический углерод). Используют в производстве резины, пластмасс, пигмент для лакокрасочных материалов и др.

Кокс
главная
Представляет собой твердое пористое вещество серого цвета, получаемое коксованием каменного угля. Физико-химические свойства каменноугольного кокса определяются его структурой, но по общим характеристикам они близки к свойствам графита.
Область применения: Каменноугольный кокс применяют главным образом в доменном процессе для выплавки чугуна (доменный кокс). Кокс здесь служит одновременно топливом и восстановителем железной руды. В значительно меньших количествах кокс используется в литейном производстве, изготовлении теплоизоляции, графитированных электродов (литейный кокс), для агломерации руд, в химической промышленности, цветной металлургии и др.

Фуллерен
главная
По имени американского инженера и архитектора Ричарда Бакминстера Фуллера, который построил конструкцию купола из сочленённых пяти- и шестиугольников.
Виды молекул фуллеренов: чётное число атомов углерода в молекуле С60, С70, С72, С74, С76, С108, С960 и т.д. Поверхность «мяча» образована пяти- и шестиугольниками с общими рёбрами. Простейший фуллерен – бакминтерфуллерен – состоит из 12 пятиугольников и 20 шестиугольников. Форма близка к сфере.

Фуллерен
главная
Кристаллические вещества чёрного цвета с металлическим блеском.
Полупроводники
При высоком давлении и комнатной температуре легко превращаются в алмаз.
ПРИМЕНЕНИЕ
- Получение полимерных материалов и металлофуллеренов.
- Фторированные фуллерены используют как катоды в гальванических элементах.
- Запоминающие устройства.
- Сверхпроводники.
- Лекарства с противоопухолевой активностью.
- Красители.

Карбин
главная
Белые кристаллы
Состоит из цепей, образованных участками: -С С-С С- (карбин) или =С=С=С=С= (поликумулен). Получен искусственным путем.
Впервые получено советскими химиками В. В. Коршаком, А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым в начале 60-х гг. в
СВОЙСТВА
- Обладает полупроводниковыми свойствами.
- При сильном нагревании без доступа воздуха превращается в графит.
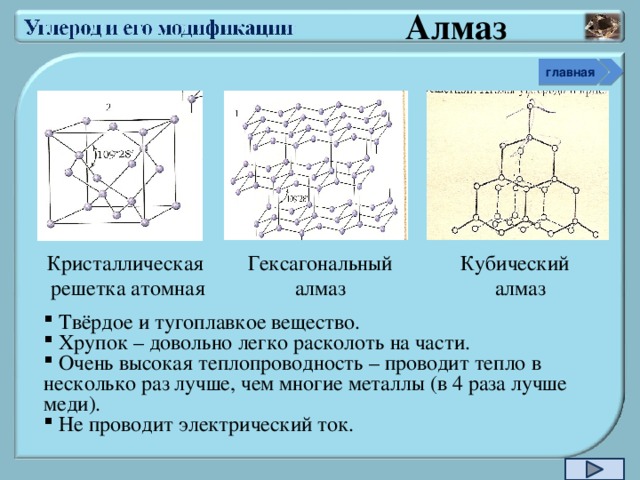
Алмаз
главная
Кристаллическая
Гексагональный алмаз
Кубический
решетка атомная
алмаз
- Твёрдое и тугоплавкое вещество.
- Хрупок – довольно легко расколоть на части.
- Очень высокая теплопроводность – проводит тепло в несколько раз лучше, чем многие металлы (в 4 раза лучше меди).
- Не проводит электрический ток.

Алмаз
главная
ПРИМЕНЕНИЕ
- Изготовление бриллиантов – огранённые алмазы сильно преломляют свет.
- Для резки стекла, металлов, наконечники свёрл («алмазные жала»), буров и резцов – благодаря твёрдости.
- Алмазный порошок – для полировки и огранки драгоценных камней (рубинов) – твёрдость.

Алмаз
главная
Бриллиа́нт (от фр. brillant — блестящий) — алмаз, которому посредством обработки придана специальная форма, максимально выявляющая его естественный блеск.
Известны алмазы оранжевого, голубого, разового, жёлтого, коричневого, молочно-белого, синего, зелёного, серого и даже чёрного цвета. Окраска связана с дефектами в кристаллической решётке и замещением части атомов углерода на атомы бора, азота и даже алюминия. Серая и чёрная окраска алмазов обусловлена включениями графита.

Алмаз
БРИЛЛИАНТЫ
главная
«Нассак» (страз)
«Зелёный дрезденский»
«Санси»
( страз )
«Флорентиец»
«Кохинур» (страз)
Алый бриллиант
(страз)
Мусаева
Проверь себя
главная
Тренажер
Кроссворд
Тест
Интерактив
Интерактив
Интерактив
главная
Тренажер
Модификация какого углерода изображена на рисунке?
главная
алмаз
графит
Ошибка
кокс
Ошибка
Молодец
карбин
Ошибка
сажа
Ошибка
Ошибка
Молодец
Ошибка
бриллиант
фуллерен
кокс
Ошибка
карбин
графит
Ошибка
Молодец
Ошибка
кокс
алмаз

Чему равна степень окисления атома углерода в соединениях?
главная
+4
CO 2
-4
CH 4
H 2 CO 3
+4
CO
+2
HCOOH
+2
HCOH
0

главная











































