Многоатомные спирты
Учитель химии
Аметова Лутфие Меметовна
Содержание
Определение Физические свойства Номенклатура Химические свойства с активными металлами , оксидами
активных металлов , с галогеноводородами ,
с органическими и неорганическими кислотами ,
качественная реакция на многоатомные спирты .
Получение спиртов (этиленгликоль , глицерин )
Применение (этиленгликоль , глицерин ) Источники информации
Определение
К многоатомным спиртам
относятся органические соединения,
в молекулах которых содержится
несколько гидроксильных групп,
соединенных с углеводородным
радикалом.
В общем виде формулу спиртов
можно записать как R(OH) n .
Физические свойства
Этиленгликоль CH 2 OH – CH 2 OH бесцветная сиропообразная жидкость с
t кип. 197 º С , имеет сладкий вкус, без
запаха, очень ядовит , смешивается с водой в
любых соотношениях, гигроскопичен.
Глицерин CH 2 OH – CHOH – CH 2 OH бесцветная, вязкая, t кип. 290 º С,
гигроскопичная жидкость, сладкая на вкус, с
водой смешивается в любых соотношениях.
Номенклатура
Наличие в соединениях двух и
более гидроксильных групп
обозначается соответственно
суффиксами –диол–, –триол– и т.д.
Например
CH 3 – CH 2 – CH 2 – CHOH – CH 2 OH
пентандиол – 1,2
Химические свойства
Для многоатомных спиртов
характерны основные реакции
одноатомных спиртов. В отличие от них,
они могут образовывать производные
по одной или по нескольким
гидроксильным группам, в зависимости
от условий проведения реакций .
1. Взаимодействуют с активными
металлами.
Многоатомные спирты, как и одноатомные,
проявляют свойства кислот при взаимодействии с
активными металлами, при этом происходит
последовательное замещение атомов водорода в
гидроксильных группах.
2 CH 2 OH-CH 2 OH + 2 Na →
2 CH 2 OH-CH 2 ONa + H 2
неполный гликолят натрия
2CH 2 OH-CH 2 ONa + 2Na →
2CH 2 ONa – CH 2 ONa + H 2
полный гликолят натрия
2. Взаимодействуют с оксидами активных
металлов.
Наличие в молекулах многоатомных спиртов
нескольких гидроксильных групп приводит к
большей поляризации связи O – H , поэтому
кислотные свойства у них выражены сильнее
чем у одноатомных спиртов и воды.
CH 2 OH-CH 2 OH +Na 2 O →
CH 2 ONa – CH 2 ONa + H 2 O
полный гликолят натрия
2CH 2 OH – CHOH – CH 2 OH + 3Na 2 O →
2CH 2 ONa – CHONa – CH 2 ONa + 3H 2 O
глицерат натрия
3. При взаимодействии с галогеноводородами ( HCl, HBr ) получаются моно- и дихлор- или бромгидрины глицерина.
CH 2 OH – CHOH – CH 2 OH + HCl →
CH 2 Cl – CHOH – CH 2 OH + H 2 O
3 – хлорпропандиол – 1,2
CH 2 Cl – CHOH – CH 2 OH +HCl →
CH 2 Cl – CHOH – CH 2 Cl+ H 2 O
1, 3 – дихлорпропанол – 2
4.При взаимодействии с органическими
и неорганическими кислотами
образуются полные и неполные сложные
эфиры.
CH 2 OH HO – NO 2 CH 2 ONO 2
| H+ |
CHOH + HO – NO 2 → CHONO 2 + 3H 2 O
| |
CH 2 OH HO – NO 2 CH 2 ONO 2
глицеринтринитрат
(нитроглицерин)
взрывчатое вещество, применяется при
производстве динамита. При его взрыве
выделяется большое количество газов и тепла:
CH 2 ONO 2 -CHONO 2 -CH 2 ONO 2 →
12CO 2 + 6N 2 + O 2 + 10H 2 O + Q
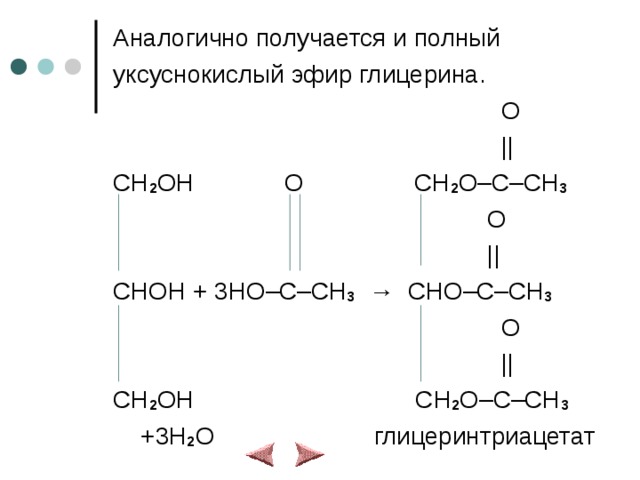
Аналогично получается и полный
уксуснокислый эфир глицерина.
O
||
CH 2 OH O CH 2 O–C–CH 3
O
||
CHOH + 3HO–C–CH 3 → CHO–C–CH 3
O
||
CH 2 OH CH 2 O–C–CH 3
+3H 2 O глицеринтриацетат
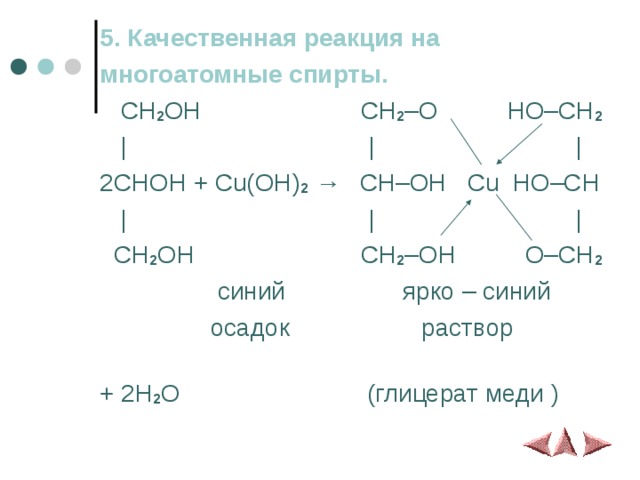
5. Качественная реакция на
многоатомные спирты.
CH 2 OH CH 2 –O HO–CH 2
| | |
2CHOH + Cu(OH) 2 → CH–OH Cu HO–CH
| | |
CH 2 OH CH 2 –OH O–CH 2
синий ярко – синий
осадок раствор
+ 2H 2 O (глицерат меди )
Получение спиртов
Этиленгликоль (этандиол-1,2)
синтезируют из этилена различными
способами:
1)CH 2 =CH 2 + Cl 2 → CH 2 Cl-CH 2 Cl
Гидролиз дихлорэтана
CH 2 Cl-CH 2 Cl + 2 H 2 O ↔ CH 2 OH-CH 2 OH
+2 HCl KOH
2)CH 2 =CH 2 +HOCl→ CH 2 OH-CH 2 Cl
CH 2 OH-CH 2 Cl + H 2 O ↔ CH 2 OH-CH 2 OH +HCl
KOH
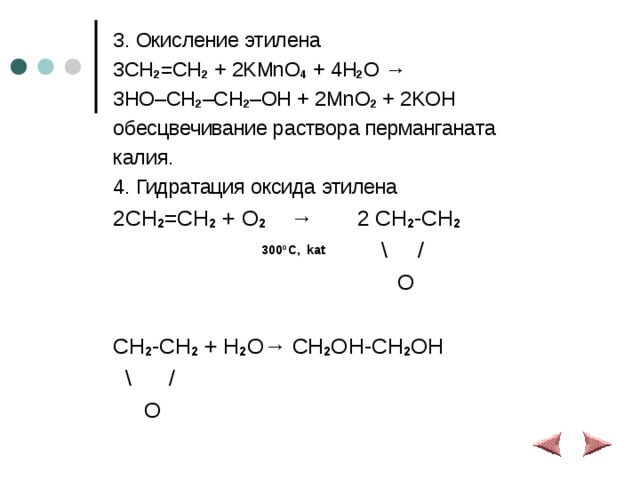
3. Окисление этилена
3CH 2 =CH 2 + 2KMnO 4 + 4H 2 O →
3HO–CH 2 –CH 2 –OH + 2MnO 2 + 2KOH
обесцвечивание раствора перманганата
калия.
4. Гидратация оксида этилена
2CH 2 =CH 2 + O 2 → 2 CH 2 -CH 2
300 ºC , kat \ /
O
CH 2 -CH 2 + H 2 O→ CH 2 OH-CH 2 OH
\ /
O
Глицерин (пропантриол -1,2,3) получают
1) гидролизом жиров;
2) из пропилена 400 º С
а ) CH 2 =CH-CH 3 + Cl 2 → CH 2 =CH-CH 2 Cl +HCl
NaOH
CH 2 =CH-CH 2 Cl + H 2 O ↔ CH 2 =CH-CH 2 OH +
+ NaCl
CH 2 =CH-CH 2 OH + HOCl →
CH 2 Cl –CHOH-CH 2 OH
NaOH
CH 2 Cl–CHOH – CH 2 OH + H 2 O →
CH 2 OH-CHOH-CH 2 OH + HCl
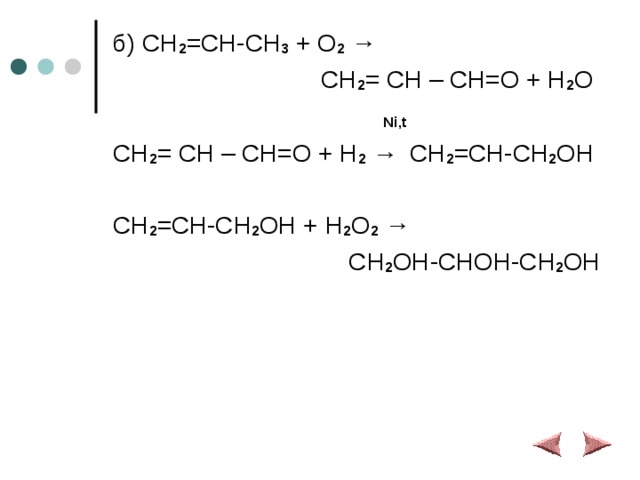
б) CH 2 =CH-CH 3 + O 2 →
CH 2 = CH – CH=O + H 2 O
Ni,t
CH 2 = CH – CH=O + H 2 → CH 2 =CH-CH 2 OH
CH 2 =CH-CH 2 OH + H 2 O 2 →
CH 2 OH-CHOH-CH 2 OH
Применение
Этиленгликоль сильно понижает
температуру замерзания воды. 60%-ный
водный раствор гликоля замерзает при
– 49 º С. Его с успехом применяют для
приготовления антифриза. Он весьма
гигроскопичен, поэтому используется при
изготовлении печатных красок (текстильных,
типографских и штемпельных). Азотнокислый
эфир этиленгликоля – динитроэтиленгликоль –
сильное взрывчатое средство, заменяющее
нитроглицерин.
Глицерин в больших количествах
потребляется в химической, пищевой
(для изготовления кондитерских
изделий, ликеров, прохладительных
напитков), текстильной и полиграфической
промышленностях (добавляется в печатную
краску для предохранения от высыхания).
Его применяют в производстве пластических
масс и лаков (глифталевые смолы),
взрывчатых веществ и порохов, косметических
и лекарственных препаратов, а также в
качестве антифриза.