Обратимость химических реакций. Химическое равновесие, условия его смещения.
Сорокина Е.Л. учитель химии МБОУ СОШ№119 г. Нижний Новгород
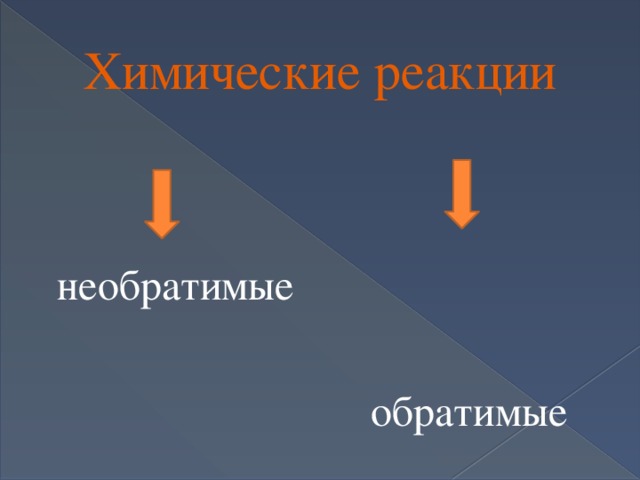
Химические реакции
необратимые
обратимые
Необратимые реакции
протекают до конца
[ одно из реагирующих веществ
расходуется полностью]
имеют одно направление
Относятся реакции: - горения
- некоторые реакции разложения
- реакции ионного обмена с
образованием осадка, выделением
газа или с образованием воды .
Обратимые реакции
протекают не до конца
[ ни одно из реагирующих веществ
не расходуется полностью]
имеют два направления
прямое и обратное
Разделите предложенные реакции на две группы
1) 2KClO 3 → 2KCl + O 2
2) NaOH + HCl → NaCl + H 2 O
3) N 2 + 3H 2 → 2NH 3
4) AgNO 3 + NaCl → AgCl + Na NO 3
5) SO 2 + H 2 O → H 2 SO 3
6) CH 4 + 2O 2 → CO 2 + H 2 O
7) 2SO 2 + O 2 → 2 SO 3
8) CaCO 3 + 2HCL → CaCl 2 + H 2 O + CO 2
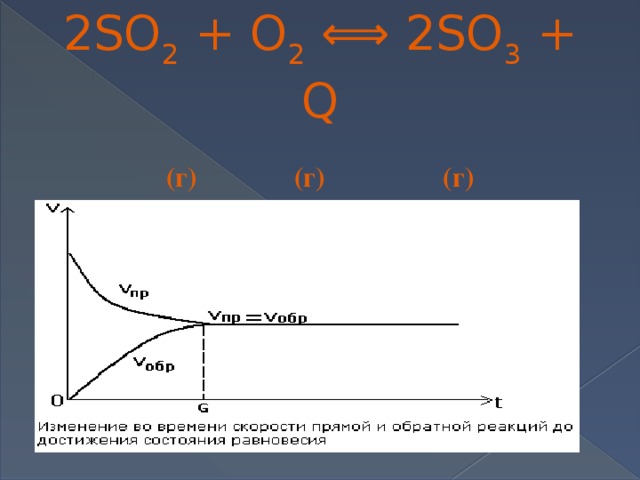
V 2 O 5(тв) 2SO 2 + O 2 ⟺ 2SO 3 + Q (г) (г) (г)
V 2 O 5(тв) 2SO 2 + O 2 ⟺ 2SO 3 + Q (г) (г) (г)
Химическое равновесие
Это динамическое (подвижное) состояние системы (обратимой реакции), при которой
V прямой реакции = V обратной реакции
т.е. сколько молекул продукта реакции образуется в единицу времени, столько же и расходуется на обратную реакцию.
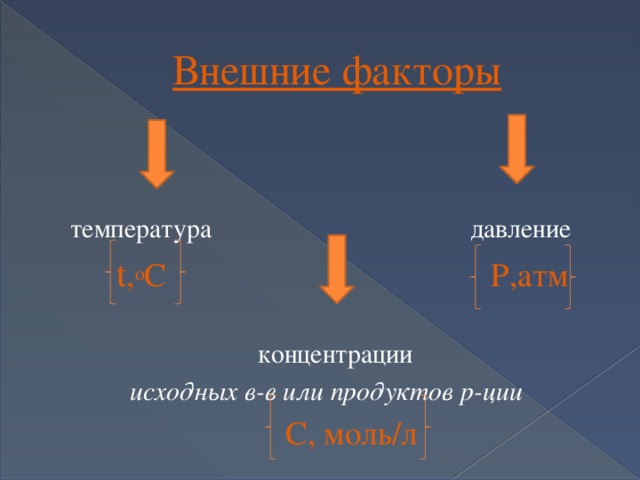
Принцип Ле – Шателье ( бегство от насилия)
1884год
при воздействии на
систему извне, равновесие
смещается в сторону той
реакции, которая
ослабляет это воздействие
( 1850-1936)
Внешние факторы
температура давление
t , o C Р,атм
концентрации
исходных в-в или продуктов р-ции
С, моль/л
Лабораторная работа
I группа – влияние температуры.
II группа – влияние давления.
III группа – влияние концентрации
1) Пользуясь учебником
веществ.
(стр.141) установите
1) Пользуясь учебником
(стр.140) установите
влияние температуры на
влияние давления на
смещение химического
1) Пользуясь учебником
(стр.140) установите
равновесия.
смещение химического
равновесия.
влияние изменения
концентрации веществ на
2) Рассмотрите влияние
2) Рассмотрите влияние
смещение химического
температуры на смещение
равновесия.
давления на смещение
химического равновесия
для предложенной на
химического равновесия
для предложенной на
2) Рассмотрите влияние
доске реакции.
доске реакции
изменения концентрации
3) Докажите опытным
веществ на смещение
химического равновесия
путем правильность
3) Докажите опытным
путем правильность
ваших выводов на
для предложенной на
примере реакции
ваших выводов .
доске реакции.
(С 6 Н 10 О 5 ) n +mI 2 =
3) Докажите опытным
путем правильность
ваших выводов на
= [(С 6 Н 10 О 5 ) n mI 2 ] +Q
примере реакции :
3NH 4 CNS + FeCl 3 ⇄
⇄ Fe ( CNS ) 3 + NH 4 Cl
Влияние внешних факторов на смещение химического равновесия
t↑ → к эндотермической реакции t↓ → к экзотермической реакции
p↓ → к большему объёму
С(в-ва)↓ → к нему
Катализатор не влияет на смещение химического равновесия
Задание №1 CO 2(газ) + С (тв) = 2СО (газ) – Q
как необходимо изменить концетрацию веществ, температуру, давление руакции, чтобы сместить равновесие вправо?
Задание №2 N 2 (газ) + O 2(газ) = 2 NO (газ) - Q
что необходимо сделать, чтобы сместить химическое равновесие вправо (в сторону продуктов реакции)?
Самостоятельная работа
Я в вас верю!!!!!!!!!
Домашнее задание §16. упр.5,6.
Практическая часть
I группа – влияние температуры.
II группа – влияние давления.
1) Пользуясь учебником (стр.141) установите влияние температуры на смещение
химического равновесия.
1) Пользуясь учебником (стр.140) установите влияние давления на смещение
2) Рассмотрите влияние температуры на смещение химического равновесия для
химического равновесия.
2) Рассмотрите влияние давления на смещение химического равновесия для
предложенной на доске реакции.
3) Докажите опытным путем правильность ваших выводов на примере реакции
предложенной на доске реакции
3) Докажите опытным путем правильность ваших выводов .
(С 6 Н 10 О 5 ) n + mI 2 = [(С 6 Н 10 О 5 ) n mI 2 ] +Q
Для проведения опыта вам потребуется:
Для проведения опыта вам потребуется:
реактивы : (С 6 Н 10 О 5 ) n - крахмал, I 2 -спиртовой раствор йода.
оборудование : бутылка с газированной водой.
Ход работы
оборудование : пробирка, спиртовка, стакан с холодной водой, пробиркодержатель ,
Потрясите бутылку и откройте её.
спички.
Прокомментируйте результаты
Ход работы
1- налейте в пробирку крахмал, добавьте 1каплю йода.
2-нагрейте пробирку;
[ В закрытой бутылке с газированной водой в равновесном состоянии находятся три обратимых процесса:
3-остудите пробирку
Н 2 О (ж) ⇄ Н 2 О (г)
Прокомментируйте результаты каждого опыта.
СО 2 (г) ⇄ СО 2 (водный)
СО 2 (водный) + Н 2 О (ж) ⇄ НСО 3 + Н ]
III группа – влияние концентрации веществ.
1) Пользуясь учебником (стр.140) установите влияние изменения концентрации исходных
веществ и продуктов реакции на смещение химического равновесия.
2) Рассмотрите влияние изменения концентрации исходных веществ и продуктов
реакции на смещение химического равновесия для предложенной на доске реакции.
3) Докажите опытным путем правильность ваших выводов на примере реакции :
3NH 4 CNS + FeCl 3 ⇄ Fe ( CNS ) 3 + NH 4 Cl
Для проведения опыта вам потребуется:
реактивы : NH 4 CNS- роданид аммония, FeCl 3 - хлорид железа(III),
NH 4 Cl (крист) – хлорид аммония.
оборудование: колба с водой, 3пустых пробирки.
Ход работы
1- в колбу с водой добавьте по 2 капли роданида аммония и хлорида железа(III).
Раствор должен стать светло-красного цвета (это образец).
2- налейте в пробирки равные объёмы приготовленного раствора.
3- в первую пробирку добавьте 1-2капли раствора NH 4 CNS
4- во вторую пробирку 2-3капли раствора FeCl 3
5- в третью пробирку добавьте на ложечке кристаллический NH 4 Cl
Прокомментируйте результаты каждого опыта
Самостоятельная работа
II- вариант
1.Обратимой реакции соответствует уравнение:
1)KOH + HBr = KBr + H 2 O
2) CO 2 + C = 2CO
3) 2Mg + O 2 = 2MgO
4) Ba(NO 3 ) 2 + K 2 SO 4 = BaSO 4 + 2KNO 3
2. На смещение химического равновесия в системе
С 2 Н 5 ОН (ж) + СН 3 СООН (ж) СН 3 СООС 2 Н 5(ж) + Н 2 О (ж) + Q
не оказывает
1) повышение концентрации СН 3 СООС 2 Н 5
2) уменьшение давления
3) уменьшение концентрации этанола
4) повышение температуры
3. Химическое равновесие в системе
С 4 Н 8(г) + Н 2 (г) С 4 Н 10 (г) + Q
можно сместить в сторону образования бутана при одновременном
1) увеличении температуры и уменьшении давления
2) уменьшении температуры и уменьшении давления
3) увеличении температуры и увеличении давления
4) уменьшении температуры и увеличении давления
4. Какие из приведенных утверждений верны?
А.
исходных веществ равна концентрации продуктов реакции.
Б . Введение катализатора не влияет на смещение химического
равновесия.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
I-вариант
1. Обратимой реакции соответствует уравнение
1)FeCl 2 + 2NaOH = Fe(OH) 2 ↓ + 2NaCl
2) 2K + 2H 2 O = 2KOH + H 2 ↑
3) 2Na + Cl 2 = 2NaCl
4) Н 2 + I 2 = 2HI
2. На смещение химического равновесия в системе
СO (г) + Н 2 O (г) СO 2(г) + Н 2(г) + Q
не оказывает
1) повышение концентрации СО 2
2) уменьшение давления
3) уменьшение концентрации водорода
4) повышение температуры
3. Химическое равновесие в системе
2Н 2 О (г) 2Н 2(г) + О 2(г) – Q
можно сместить в сторону продуктов реакции при одновременном
1) увеличении температуры и уменьшении давления
2) уменьшении температуры и уменьшении давления
3) увеличении температуры и увеличении давления
4) уменьшении температуры и увеличении давления
4. Какие из приведенных утверждений верны?
А.
равна скорости обратной реакции.
Б . Введение катализатора влияет на смещение химического равновесия.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны

![Необратимые реакции протекают до конца [ одно из реагирующих веществ расходуется полностью] имеют одно направление Относятся реакции: - горения - некоторые реакции разложения - реакции ионного обмена с образованием осадка, выделением газа или с образованием воды .](https://fsd.kopilkaurokov.ru/uploads/user_file_54cab258be200/img_user_file_54cab258be200_2.jpg)
![Обратимые реакции протекают не до конца [ ни одно из реагирующих веществ не расходуется полностью] имеют два направления прямое и обратное](https://fsd.kopilkaurokov.ru/uploads/user_file_54cab258be200/img_user_file_54cab258be200_3.jpg)