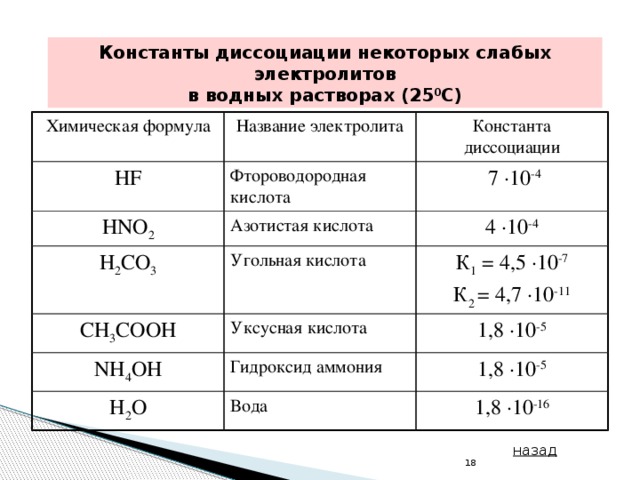
Презентация поможет докладчику сделать интересное сообщение для урока химии. Цель: познакомить учащихся с гидролизом солей. ... Рассмотреть три случая гидролиза солей, углубить представление о сильных и слабых электролитах
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
ГИДРОЛИЗ СОЛЕЙ, ПРИМЕНЕНИЕ СОЛЕЙ
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого презентации
«гидролиз солей»
Полезное для учителя
Распродажа видеоуроков!
1990 руб.
2840 руб.
2200 руб.
3140 руб.
1770 руб.
2530 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства





 7, среда щелочная Na 2 CO 3 , K 2 S Соли 3. Образованы слабым основанием и сильной кислотой по составу Гидролизу подвергаются по катиону рН 4. Образованы слабым основанием и слабой кислотой Гидролизу подвергаются по катиону и аниону рН ~ 7, среда слабокислая или слабощелочная" width="640"
7, среда щелочная Na 2 CO 3 , K 2 S Соли 3. Образованы слабым основанием и сильной кислотой по составу Гидролизу подвергаются по катиону рН 4. Образованы слабым основанием и слабой кислотой Гидролизу подвергаются по катиону и аниону рН ~ 7, среда слабокислая или слабощелочная" width="640"


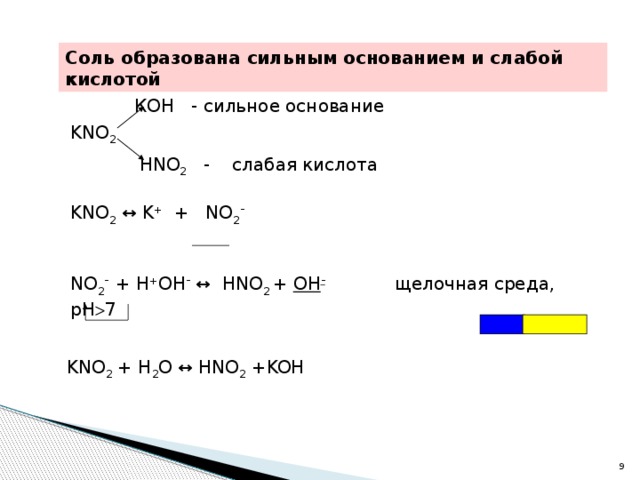
 7 Na 2 S + H 2 O ↔ NaHS + NaOH" width="640"
7 Na 2 S + H 2 O ↔ NaHS + NaOH" width="640"

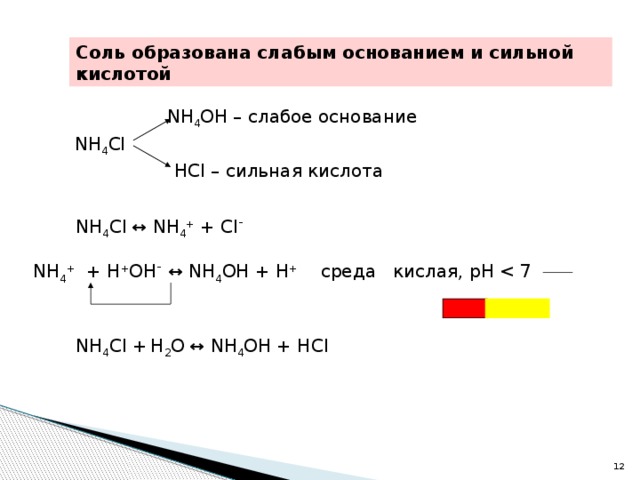
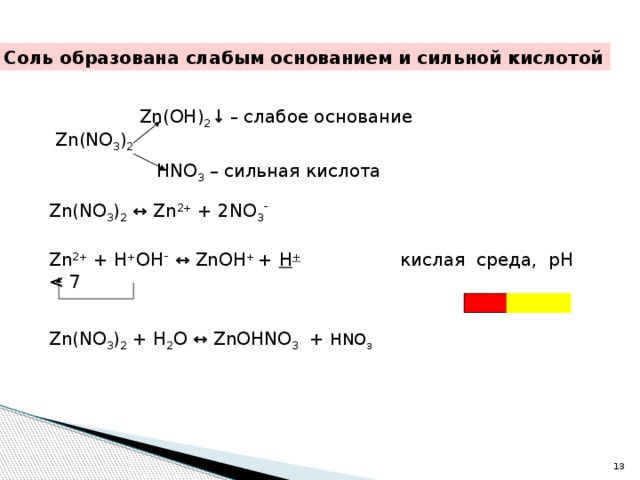



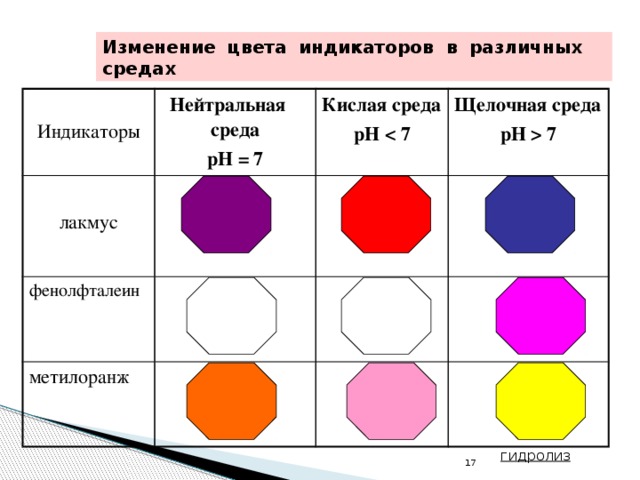 7 гидролиз" width="640"
7 гидролиз" width="640"