Ашық сабақ тақырыбы:
«Азот, фосфор және
олардың қосылыстары»
Сабақтың мақсаты:
Білімділік:
Азот және фосфордың периодтың жүйедегі орнына байланысты V топ элементі ретінде сипаттау, маңызды қасиеттерімен таныстыру. Тәрбиелік:
Оқушылардың пәнге деген қызығушылығын оятып, сөйлеу қабілетін дамыту. Дамытушылық:
Оқушыларды табиғат байлықтарын тиімді пайдалана білуге үйрету.
№ 1 тапсырма
ІVА топша элементеріне қандай элементтер жатады? Көміртектің периодтық жүйедегі орны және атом құрылысы? Көміртектің тотығу дәрежелері? Көміртектің табиғатта таралуы? Көміртектің физикалық қасиеттерін сипаттаңыз? Көміртектің химиялық қасиеттерін сипаттаңыз? Кремнийдің периодтық жүйедегі орны және атом құрылысы? Кремнийдің тотығу дәрежелері? Кремнийдің физикалық қасиеті? Кремнийдің химиялық қасиеті? Силицидтер дегеніміз не? Силанның формуласы?
№ 2 тапсырма
Тотығу дәрежелерін табыңыздар:
CH 4 , CO 2 , CO, SiO 2 , H 2 SiO 3 , SiC, Mg 2 Si, SiH 4 , SiF 4 , H 2 CO 3 , CaC 2 .
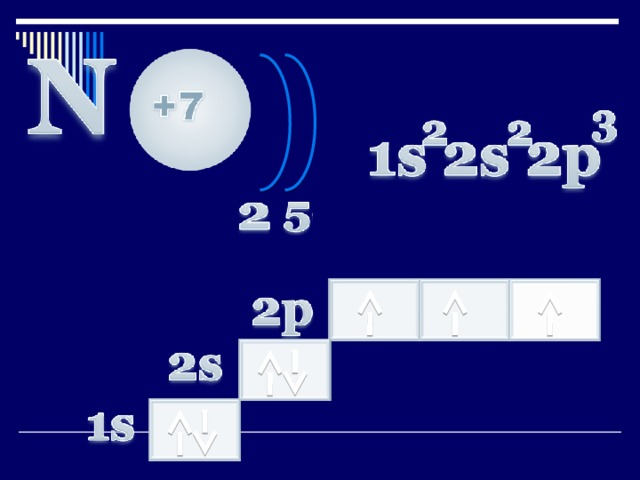
Атом құрылысы
Фосфордың сыртқы энергетикалық деңгейінде 5 электрон бар. Атомындағы электрондардың орналасуы:
+15 Р )2е )8е )5е
Электрондық құрылысы:
1s 2 2s 2 2p 6 3s 2 3p 3
Азот
Фосфор
Табиғатта таралуы:
Бос және қосылыс түрінде кездеседі.
Ауада көлемдік үлесі – 78,09%.
Бұл едәуір көп таралған элемент, жер қыртысындағы оның мөлшері 0,12%-ті құрайды. Фосфор белсенді, табиғатта бос күйінде кездеспейді, маңыздысы-құрамына кальций фосфаты кіретін апатит минералы. Ең көп таралғаны фторапатит 3Ca 3 (PO 4 2 ) .Ca F 2
Массалық үлесі – 75,6%
Маңызды қосылыстары: NаNО 3 , КNО 3 , Са(NО 3 ) 2.
Жер қыртысында мөлшері – 0,01-0,04%
Алынуы:
Аммоний нитридін қыздырып айыру арқылы: NН 4 NО 2 = N 2 + 2Н 2 О
Фосфорды фосфариттен алады. Оны көмірмен (кокспен) және құммен араластырып, 1500С электр пешінде қыздырады: 2Са 3 (РО 4 ) 2 +10С+6SiO 2 =6CaSiO 3 +P +10CO↑
NаNО 2 + NН 4 Сl = N 2 ++NаСl +2Н 2 О
Физикалық қасиеті:
N Иіссіз, түссіз, дәмсіз, ауадан жеңіл газ.
Суда ерігіштігі оттектен төмен
Азотпен салыстырғанда фосфор элементінің бейметалдық қасиеттерінің кемуі, оның жай заттарының қасиеттеріне әсер етеді. Фосфордың аллотропиялық түр өзгерістерінің қасиеттері олардың құрылысымен түсіндіріледі. Ақфосфор құрылысы толық зертелген. Оның малекулалық кристалдық торы бар. Ақ фосфордың малекуласы төрт атомды және дұрыс үш қырлы перамида тәріздес. Фосфордың әрбір атомы перамиданың төбесінде орналасқан. Малекулалық торлы басқа заттарға ұқсас, ақ фосфор жеңіл балқиды және ұшқыш.
ауадан аздап жеңіл - 1960С сұйық күйге
айналады
- 2100С қар тәріздес массаға айналады.
Химиялық қасиеті:
Тотықтырғыш, тотықсыздандырғыш қасиет көрсетеді.
N2+3H2 = 2NH3 3Mg + N2 = Mg3N2 N2 + 3Ca = Ca3N2 N2 + 3F2 = 2NF3 3N2 + 2Al = 2AlN3
2Р+3S=P 2 S 3
2P+3CI 2 = 2РСl 3
РСl 3 +CI 2 = РСl 5 2P+3Ca=Ca 3 P 2
Са 3 Р 2 + 6Н 2 О= 3Cа(ОН) 2 +2РН 3 ↑.
6Р+5КСIО 3 =5KCI+3P 2 O 5
Қолданылуы:
түрлі қосылыстар, NH2синтездеу, инертті орта, ауа салқындатқыш жүйеде, цианид алу, нитрид алу, азот қышқылын алу.
Cа3(PO4)2-фосфорит фторапатит, Р-нәруыз құрам тіс, сүйек
Физикалық қасиеттері
Ақ фосфор
Қызыл фосфор
1.Ақ түсті кристалл зат, тығыздығы 1,83г/см 3
1.Аморфты зат, кристалды емес, тығыздығы 2,20 г/см 3
2.Қараңғыда жарқырайды
3.Кәдімгі жағдайда 30-40 0 С температурада ауадағы оттекпен тотығады
2.Қараңғыда жарқырамайды
4.От алғыш қауіптілігіне байланысты су астында сақтайды
3.Ауадағы оттекпен 260 0 С –та тотығады
5.Суда ерімейді,
(СS 2 ) күкірткөміртекте ериді
4.Отқа қауіпті емес. Қыздырғанда оталады.
5.Суда да, (СS 2 ) күкірткөміртекте де ерімейді
6.Өте қауіпті, улы!
6.Улы емес
7.44 0 С-та балқиды, 280 0 С-та қайнайды
7.400 0 С-та балқиды
Химиялық қасиеттері
1. Фосфор оттекте жанып, пентаоксид түзеді:
4Р+5О 2 =2Р 2 О 5
2. Фосфор хлормен ерекеттесіп, фосфор үш хлоридін және 300 0 С-та фосфор пентахлоридін түзеді:
2Р+3Cl 2 =2РCl 3
2Р+5Cl 2 =2РCl 5
3. Фосфор сутекпен тікелей әрекеттесіп, фосфин түзеді:
2Р+3Н 2 =2РН 3
4. Фосфор металдармен фосфидтер түзе әрекеттеседі:
3Са+2Р=Са 3 Р 2 кальций фосфиді
3Nа+Р=Na 3 Р натрий фосфиді
5. Күрделі заттармен әрекеттеседі:
5КСl 3 +6P=3P 2 O 5 +5KCl
Қолданылуы
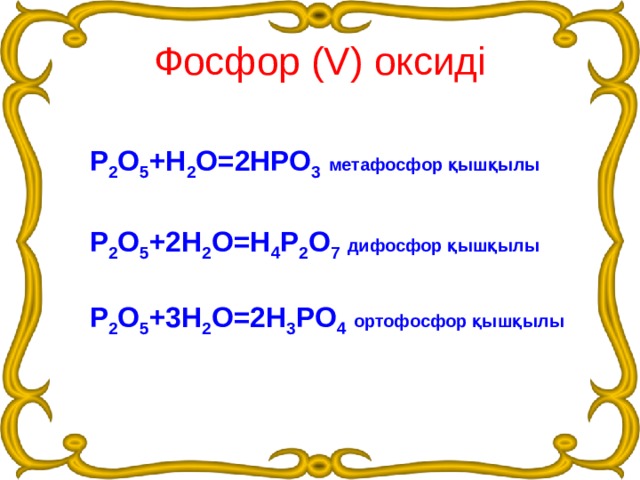
Фосфор (V) оксиді
Р 2 О 5 +Н 2 О=2НРО 3 метафосфор қышқылы
Р 2 О 5 +2Н 2 О=Н 4 Р 2 О 7 дифосфор қышқылы
Р 2 О 5 +3Н 2 О=2Н 3 РО 4 ортофосфор қышқылы
Алынуы
Зертханада алынуы:
P 2 O 5 +3H 2 O=2H 3 PO 4
Өнеркәсіпте алынуы:
Ca 3 (PO 4 ) 2 +3H 2 SO 4 =3CaSO 4 +2H 3 PO 4
Химиялық қасиеттері:
2H 3 PO 4 +3СаО=Ca 3 (PO 4 ) 2 +3H 2 O
Са 3 (PO 4 ) 2 +4Н 3 PO 4 =3Са(Н 2 РО 4 ) 2
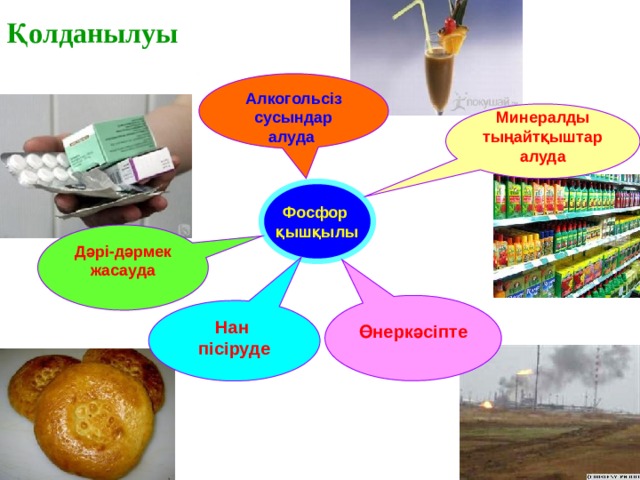
Нан
пісіруде
Қолданылуы
Алкогольсіз сусындар
алуда
Минералды
тыңайтқыштар
алуда
Фосфор
қышқылы
Дәрі-дәрмек жасауда
Өнеркәсіпте
Сабақты бекіту
№ 1 тапсырма
Тотығу дәрежелерін табыңыздар:
NO, NO 2 , HNO 3 , NaNO 3 , N 2 O, P 2 O 5 , H 3 PO 4 , Ag 3 PO 4 , Ca 3 P 2 , PCl 3 , PCl5, P Н 3 , Ca 3 P 2 , P 4 , N 2 .
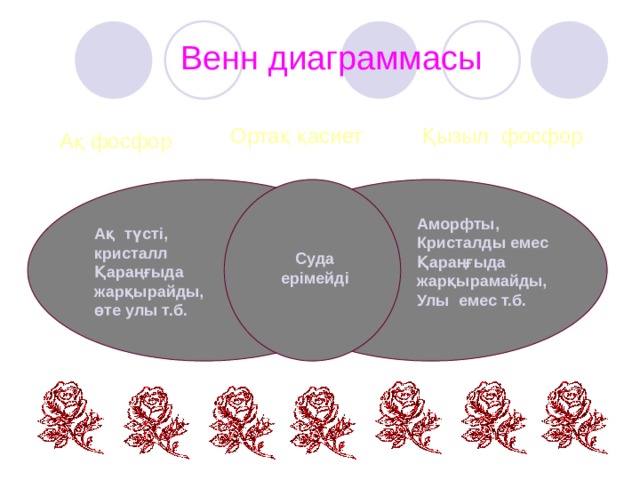
Венн диаграммасы
Қызыл фосфор
Ортақ қасиет
Ақ фосфор
Аморфты,
Кристалды емес
Қараңғыда
жарқырамайды,
Улы емес т.б.
Ақ түсті,
кристалл
Қараңғыда
жарқырайды,
өте улы т.б.
Суда
ерімейді
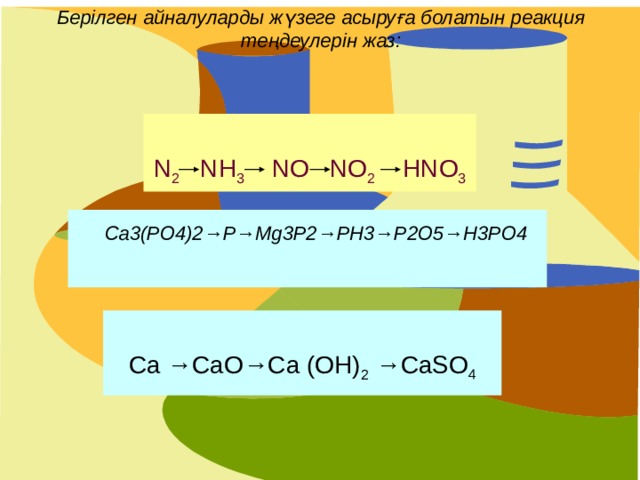
Берілген айналуларды жүзеге асыруға болатын реакция теңдеулерін жаз:
N 2 NH 3 NO NO 2 HNO 3
Ca3(PO4)2→P→Mg3P2→PH3→P2O5→H3PO4
Ca →CaO→Ca (OH) 2 →CaSO 4
Эстафеталық ойын “Термин-синоним”
PH 3
Аммиак
H 3 PO 4
Кальций фосфиді
P 2 O 5
Аммофос
Ca(NO 3 ) 2
Фосфин
NH 3
Фосфор (V) оксиді
NH 4 H 2 PO 4
Кальций нитраты
Ca 3 P 2
Ортофосфор қышқылы
Ca(H 2 PO 4 ) 2 +2CaSO 4
Күміс фосфаты
HPO 4
Жай суперфосфат
Ag 3 PO 4
Метафосфор қышқылы
Эстафеталық ойын “Термин-синоним”
PH 3
Аммиак
H 3 PO 4
Кальций фосфиді
P 2 O 5
Аммофос
Ca(NO 3 ) 2
NH 3
Фосфин
Фосфор (V) оксиді
NH 4 H 2 PO 4
Кальций нитраты
Ca 3 P 2
Ca(H 2 PO 4 ) 2 +2CaSO 4
Ортофосфор қышқылы
Күміс фосфаты
HPO 4
Ag 3 PO 4
Жай суперфосфат
Метафосфор қышқылы
№ 4 тапсырма
«Иә» немесе «жоқ» деп жауап беру
Фосфордың таңбасы «ПЭ» Фосфордың атом масса 31, реттік нөмері 15 Фосфордың тотығу дәрежелері +2 және +4 Азоттың таңбасы «ЭН» Азоттың тотығу дәрежелері – 3 тен +5 ке дейн Азоттың атом массасы 14, реттік нөмері 7 Азоттың ауа құрамындағы мөлшері – 78% Фосфор 3 периодта, 3 қатарда V А топшасында орналасқан Азоттың протон саны 7, нейтрон – 6, электрон – 7 Азот және фосфор химиялық қасиетінде оттекпен әрекеттеспейді Азоттың массалық үлесі – 75,6% Фосфор – иіссіз, түссіз, дәмсіз, ауадан жеңіл газ. Фосфордың нейтрон саны 16, протон – 15, электрон – 15 Азотта 3 энергетикалық деңгейше Фосфиннің формуласы РН 3
Үйге тапсырма:
§ 7.7, 7.8, 7.9.
№ 9 237 бет (есеп шығару)
Аммиак, азот қышқылы және фосфор қышқылдарына шағын баяндама жазу