ЗАНИМАТЕЛЬНЫЕ ЗАДАНИЯ ПО ТЕМЕ «НЕМЕТАЛЛЫ»
Буротвор
Французские химики Жозеф Гей-Люссак и Луи Тенар в 1808 г. провели следующий опыт. Они нагрели в фарфоровом сосуде борную кислоту (гидроксид бора). Это вещество расплавилось, а затем стало пениться и, наконец, превратилось в стеклообразную массу. Её растерли в фарфоровой ступке, добавили металлический калий и нагрели в медной пробирке. Началась бурная реакция, в ходе которой из пробирки показались языки зеленого племени, а потом получился темно-коричневый порошок, нерастворимый в воде. Что это было?
Мемуары химиков
Немецкий химик Фридрих Вёлер в своём дневнике описал опыт, выполненный им совместно с французским коллегой Анри Сент-Клер Девиллем в 1856 г. Они смешали оксид неметалла состава Э2О3 с порошком алюминия и нагрели смесь в платиновом тигле. Началась бурная реакция с выделением большого количества теплоты. Однако при осмотре содержимого тигля искомого неметалла Э в нём не обнаружилось. Девилль уже собрался выбросить остатки веществ опыта (как ему показалось, неудачного), но осторожный Вёлер решил прежде обработать алюминиевый спёк соляной кислотой. После растворения оксида алюминия и остатка непрореагировавшего метала химики увидели на дне сосуда черные блестящие кристаллики неметалла. Какого именно?
Почти как алмаз
Полиция одного из немецких городов напала на след подпольной фирмы, изготовлявшей фальшивые алмазы для технических целей. Это были блестящие черные кристаллы, по твердости близкие к настоящим алмазам, но химически более стойкие. В частности, на фальшивые алмазе не действовали кислород и хлор при температуре ниже10000С, пары воды разрушали их только при 9000С, превращая их в белый оксид состава Э4С, а получали их, прокаливая в электропечи при20000С смесь оксида с углеродом. Какой неметалл скрывается под буквой Э? Каков состав фальшивых алмазов?
Ошибка властителя Лахора
Властитель индийского города Лахора по имени Ранжит-Сингх в 1811 г. хвастался перед другими владыками Индии, Персии и Афганистана, что его голубой алмаз не подвержен действию никаких жидких веществ. Афганский шах Шуджа сказал, что готов поспорить (а ставка в споре- сам голубой алмаз), что его придворный факир-алхимик может за сутки уменьшить массу алмаза, погрузив его в жидкий «алкагест» (мифический универсальный растворитель). Предложение было принято, и придворные двух властителей уселись вокруг сосуда с «алкагестом», куда был погружен алмаз. Вскоре стало заметно, что камень покрылся пузырьками, а жидкость стала желтой. По истечению суток алмаз снова взвесили, и оказалось, что он потерял в весе около 1 карата (0,2г). К огорчению Ранжит-Сингха, алмаз пришлось отдать шаху Шудже. Правда, через два года слой оружия алмаз был возвращен в Лахор, но это уже другая история… Какой состав имел «алкагест»?
Тот, который не разбивается
Среди всех твердых веществ алмаз обладает наибольшей твердостью. Философы древности Тит Лукреций Кар (99-53 гг. до н.э.) и Плиний Старший (23-79гг. н.э.) считали, что алмаз не только горит, но его также нельзя расколоть ударом молота. Само слово «алмаз» на санскрите означало «тот, который не разбивается». В 1476 г. во время сражения солдаты Людовика XI ворвались в пустую палатку бургундского герцога Карла Смелого и увидели множество бриллиантов (ограненных алмазов). Невежественные вояки решили проверить, подлинные ли это драгоценности, и начали крушить их молотом. Видя, как бриллианты превращаются в порошок, солдаты приняли их за фальшивки. В чём разгадка этой истории?
Решетка без замков
В 1941 г. немецкий химик В. Рюдорф проделал такой опыт. Он поместил 1 г некоего неметалла Э в открытом сосуде в эксикатор, где также находилась чашка с жидким бромом. Через несколько часов оказалось, что масса сосуда с неметаллом увеличилась примерно на 0,8 г, а цвет и внешний вид неметалла почти не изменились. Анализ показал, что химик получил соединение состава Э8Br, а формулу следует писать так: (Э8)+ Br-. Позднее установили, что атомы брома входят в кристаллическую решетку Э м располагаются между ее слоями, поэтому в парах брома неметалл Э «набухает». Какой неметалл обладает описанными свойствами? 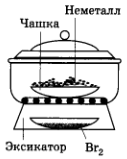
Неметалл захотел стать бронзой
С начала XX в. Многие химики занялись синтезом нитридов щелочных металлов. Было известно, что самый легкий щелочной металл литий уже при комнатной температуре на воздухе покрывается темно-зеленой коркой нитрида состава Li3N. Однако другие щелочные металлы преподносили химикам сюрпризы… Так, в 1926 г. немецкий химик К. Фриденхаген расплавил металлический калий и выдержал расплав в атмосфере азота в течение нескольких часов. Серебристо-белый расплав остался неизменным, а вот внутренние стенки тигля, изготовленного из неметалла Э, приобрели «бронзовый» цвет. «Что это за вещество?»- подумал химик и решил исследовать его состав. Но на воздухе «бронзовый» порошок загорелся, а при контакте его с водой выделился водород. Химический анализ показал, что формула «бронзового порошка КЭ8. Какой неметалл был использован в качестве материала для тигля?
Запоздалое открытие
Соединения неметалла Э были известны с доисторических времен, но сам неметалл Э был получен только в 1823 г. шведским химиком Йёнсом Берцелиусом по реакции ЭF4 с металлическим калием. Неметалл этот оказался коричневым порошком, на который в обычных условиях не действовали никакие кислоты, кроме смеси концентрированных азотной и фтороводородной, которые переводили его в раствор в виде комплексного соединения состава H2[ЭF6]. Соляная кислота реагировала с Э, только когда его смешивали с медным порошком, а потом нагревали, и в результате получалось соединение ЭHCl3. Более охотно Э взаимодействовал со щелочами в водной среде; в результате получалась соль Na4ЭО4 и выделялся водород. Какой же это неметалл?
Рецепт активности
Вот задачка для смекалистых химиков. Обычно неметалл Э при комнатной температуре не реагирует с водой и любыми кислотами. Но можно приготовить его в аморфном (и, добавим, химически активном) состоянии, так что он будет взаимодействовать и с водой, и даже со спиртом. Вот как это делается: порошок соединения данного неметалла с кальцием состава CaЭ2 в среде жидкого тетрахлорида углерода подвергают действию газообразного хлора при слабом нагревании. В результате реакции выпадает осадок Э в виде коричневого порошка. Если нагреть этот порошок до 400-5000С и обработать водяным паром, то получится водород и ЭО2. При аналогичной реакции со спиртом тоже выделится водород, а твердый продукт ЭО2 приобретет черный цвет из-за выделения углерода… Что же это за неметалл Э?
Здесь нужен кругозор
Пять знаменитых химиков XVIII в. Дали некоему неметаллу, который в виде простого вещества представляет собой газ и состоит из двухатомных молекул, пять разных имен. В 1772 г. шотландский химик, ботаник и врач Даниел Резерфорд назвал его «ядовитым воздухом». Английский химик Джозеф Пристли в том же году назвал его «дефлогистированным воздухом». В 1733 г. шведский химик-аптекарь Карл Шееле дал этому газу имя «испорченный воздух». А английский химик Генри Кавендиш в 1774 г. назвал его «удушливый воздух». Наконец, в 1776 г. французский химик Антуан Лавуазье установил, что все названные выше газы- одно и то же вещество, и предложил свое название, в переводе означавшее «безжизненный воздух». Какого сейчас название этого неметалла?
Откройте его имя!
В обычном состоянии этот неметалл с формулой Э2- бесцветный газ, не имеющий запаха и вкуса, негорючий и малорастворимый в воде, не поддерживающий горение и вообще химически весьма инертный. Только с литием он уже при комнатной температуре образует соединение Li3Э, а при нагревании реагирует с магнием, окисляя его до Mg3Э2. Получить Э2 в лаборатории можно из его соединения ЭН3 (действуя бромной водой) или термическим разложением соли состава (ЭН4)(ЭО2). Что такое Э2?
Осторожно с крышкой!
Красный фосфор не обладает способностью самовоспламеняется на воздухе. Поэтому считают, что работа с ним не представляет при комнатной температуре особой пожароопасности. Но однажды при вскрытии банки с красным фосфором произошел несчастный случай: это вещество внезапно воспламенилось, наделав много бед. Почему же это произошло?
Пластилин
Расплавив желтый неметалл, школьники осторожно вылили его из пробирки в холодную воду. Получилась коричневая масса, похожая на пластилин. Но школьники не успели ничего из нее слепить: так быстро эта масса затвердела и превратилась в желтые хрупкие кристаллы. Какой это был неметалл?
Библейское чудо
Во время осады Вавилона в 538 г. до н.э. персидским царем-завоевателем Киром вавилонский царь Валтасар устроил большое пиршество. В самом разгаре веселья таинственная рука начертала на стене зла роковые слова: «Мене, текел, упарсин». Одновременно вспыхнули светильники, окружавшие жертвенник. Призванный на пиршество пророк Даниил объяснил значение слов и предсказал скорую гибель Валтасара. Так и случилось: город был оставлен без охраны, и персы беспрепятственно вошли в него, предав мечу опьяневшего Валтасара со свитой и всех жителей. Некоторые историки считают, что уже в те древние времена мудрецы Вавилона владели секретом получения некоего неметалла (открытие которого в Европе датируется на 21 век позже). И они могли использовать неметалл для того, чтобы предостеречь Валтасара- правда, тот не внял пророчеству.… Какой это неметалл?
Красный незнакомец
в 1803 г. в лаборатории французского химика Клода Бертолле произошла занятная история. Одним из учеников знаменитого химика обнаружил склянку с неизвестным красным порошком и спросил, как поступить с этим веществом. «Конечно, прежде всего, надлежит испытать его!»- воскликнул Бертолле. Ученик взял щепотку красного порошка и попытался растереть его с недавно полученной новой солью, получившей имя Бертолле. Лучше бы он этого не делал – в лаборатории нагремел взрыв. Однако ученик не пострадал и смело продолжил испытания. Внеся красный порошок в азотную кислоты, он отметил выделение красно-бурого газа (диоксида азота): порошок при этом растворился. А при поджигании красного порошка появилось ослепительное пламя, а потто- белый дым. Бертолле похвалил ученика: задание было выполнено правильно. Какое вещество находилось в склянке?
16. Порошок для наследников
В 1840 г. вся Франция с напряженным вниманием следила за судебным процессом по делу Мари Лафарж, которая была заподозрена в убийстве. Мари вышла замуж, польстившись на богатство будущего мужа. Однако вскоре выяснилось, что у Шарля Лафаржа нет никакого состояния. Наоборот, путем женитьбы он надеялся поправить свои финансовые дела… Развод был тогда невозможен, и молодая женщина воспользовалась «порошком для наследников»- оксида неметалла состава Э2О3. Это был белый порошок без вкуса и запаха, а симптомы отравления напоминали признаки холеры. Когда Шарль умер от порошка, который понемногу добавляла в пищу его жена, родственники заподозрили неладное и потребовали рассмотреть дело в суде. Эксперт-химик, проводивший анализы, использовал реакцию Марша и установил факт отравления. Что же представлял сбой «порошок для наследников» и каким образом реакция Марша помогает установить наличие металла Э?
17. Доказательство
Какое из простых веществ- сурьма, висмут или мышьяк- является типичным неметаллом, а какое- амфотерным элементом? Чтобы ответить на вопрос, следует провести реакции этих веществ с концентрированными азотной и серной кислотами.
18. Метал или неметалл
В 1855 г. английский химик ор решил получить электролизом 25%- ного раствора
ЭCl3 в концентрированной соляной кислоте простое вещество. Э. Гор заметил, что
на платиновом катоде осаждается графитноподобная масса. Снятая с электрода
масса после промывки водой и сушки на воздухе стала серебристо-белой и приобрела металлический блеск. Когда химик попытался собрать её с фильтровальной бумаги, серебристая масса с легким хлопком распалась, выделяя белый «дым». Остатки её Гор обработал концентрированной азотной кислотой и увидел выделение красно-бурого газа. В результате у химика получился светло-желтый порошок состава Э2О5. Что за вещество получил Гор?
19. Ошибка алхимика
Чешский писатель Ярослав Гашек в рассказе «Камень жизни» по-своему изложил старинную легенду о происшествии в одном из монастырей в Баварии. Занявшись поисками «философского камня», игумен получил серебристо-белое хрупкое вещество. Остатки веществ, использованных в его опытах, охотно пожирались свиньями, которые, как заметил игумен, при этом быстро прибавляли в весе. Игумен решил сделать монахов своей обители более упитанными и стал добавлять им в еду новое серебристое вещество. Но произошло неожиданное- все монахи умерли в страшных мучениях. Что в этой истории правда, а что вымысел, сказать трудно. Заметим, что вещество, о котором идет речь, реагирует с хлором, образуя трихлорид, а при действии концентрированной азотной кислоты превращается в оксид элемента в степени окисления +V. Как называется вещество, которое уморило монахов баварской обители?
20. Парамагнитный газ
После ряда неудачных опытов Джозеф Пристли 1 августа 1774 г. получил, наконец, неизвестный газ. Позже было установлено, что молекула этого газа состоит из двух атомов. Чтобы, его выделить, можно воспользоваться несколькими способами. Например, шведский химик и аптекарь Карл Шееле получал этот газ, прокаливая соединения элемента-неметалла со ртутью, свинцовый сурик, нитрат калия и перманганат калия либо действуя на пиролюзит серной кислотой. Какой это газ?
21. «Греческий огонь»
Около 680 г. н. э. в морском бою против арабов византийцы впервые применили новое ужасное оружие- «греческий огонь». Галеры византийцев выбрасывали на неприятельские суда заранее подожженную смесь из «пифонов»- установок, подобных огнеметам. Суда пылали как факелы, а огонь нельзя было потушить водой Смесь горела на морских волнах, прилипала к корпусам судов и одежде людей: это было нечто вроде современного напалма. В 941 г. под стенами Царьграда «греческим огнем» был уничтожен флот киевского князя Игоря. Строки летописи в переводе на современный язык звучат так: «Словно молнию, которая в небе, греки имеют у себя и пускают ее, сжигая нас, поэтому мы не одолели их». В состав «греческого огня» входили битум или нефть, а также неметалл Э. Этот неметалл на воздухе горит красивым сине-голубым пламенем, выделяя удушливый и едкий газ. При обработке концентрированной азотной кислоты неметалл Э превращается в сильную кислоту H2ЭО4. При кипячении неметалла с солью состава Na2ЭО3 в растворе появляется другая соль, состава Na2ЭО3Э. Назовите неметалл Э.
22. Обман
Химик синтезировал оранжево-желтые кристаллы нитрида неметалла состава Э4N4 и решил изучить его свойства. Поручив лаборанту растереть кристаллы в порошок, он ушел по делам. А лаборант решил, что лучше всего растирать вещество ударами пестика. Недолго думая, он так и сделал. Раздался взрыв, а самого «умельца» обсыпало с ног до головы желтым порошком. Собрав этот порошок, лаборант скрыл от химика случай с взрывом. Удивленный химик обнаружил, что свойства нитрида ничем не отличаются от свойств исходного Э. Какое вещество в данном случае скрывается за символом Э?
23. Самый, самый…
Первые исследователи, пытавшиеся получить неметалл Э2 путем электролиза, жестоко поплатились своим здоровьем. Как только этот неметалл вступал в контакт с водородом, происходили сильные взрывы, в нем «горела» даже вода. А любые органические вещества (например, ткань, из которой были сделаны защитные перчатки экспериментаторов или вазелиновая смазка пришлифованной аппаратуры) в атмосфере опасного неметалла вспыхивали и загорались… Какой это неметалл?
24. Утраченный талисман
Некий химик, подражавший Пушкину, завел себе сердоликовый перстень и постоянно носил его на указательном пальце, не снимая это талисман даже во время работы в лаборатории. Однажды ему довелось исследовать свойства светло-желтой жидкости состава BrЭ3 (Э- неметалл), которая сильно дымила на воздухе. Случилось так, что перстень-талисман, скользнув с пальца, упал прямо в эту жидкость. Она бурно вспенилась, а перстень разом исчез- и камень-сердолик, и серебряная оправа. Как объяснить причину этого исчезновения?
25. Кто первый?
Студент Гейдельберского университета Карл Левиг в 1825 г. изучал воды минеральных источников Германии. Один из приготовленных им проб воды обладала интересной особенностью- она желтела под действием хлора. Левиг извлек неизвестное вещество, придававшее желтый цвет воде, с помощью диэтилового эфира, а после испарения эфира обнаружил красно-бурую жидкость с резким неприятным запахом. Студент уже собрался опубликовать результаты своих опытов, но научный руководитель посоветовал повременить. Решено было выделить новое вещество в большом количестве, чтобы иметь возможность детально исследовать его свойства. Но именно в это время 23-летний лаборант-химик Антуан Балар из Монпелье во Франции получил то же самое вещество и сразу отправил его образец в Парижскую академию наук. Известный химики Жозеф Гей-Люссак и Луи Тенар подтвердили открытие нового элемента (Балар назвал его «муридом»), но переменили название на производное от греческого «зловонный». Какой неметалл открыли Левиг и Балар?
26. Галоген-хамелеон
Французский химик Жозеф Гей-Люссак в 1813 г. дал химическому элементу номер 53 имя «йод» (от греческого «фиолетовый»). Действительно пары йода имеют такой цвет: растворы его в тетрахлориде углерода, хлороформе и бензоле тоже фиолетовые. Почему же растворы йода в этиловом спирте и диэтиловом эфире красно-коричневого цвета?
27. Йод- пособник грабителей
С золотого прииска в ЮАР исчезло около 1 кг добытого металла. Охрана заявила, что никто из рабочих не мог пронести столько золотого песка за ограждение. Следствие зашло в тупик, но потом охранники вспомнили, что на территорию не так давно был привезен мешок йодида калия и банки с йодом для проведения химических анализов. Следы этих реактивов обнаружили в цехе переработки золотоносной породы и в сточных трубах, м экспертам вскоре стал ясен хитроумный замысел преступников. Какую роль в хищении золота сыграли йод и йодид калия?
28. Убийца в солонке
В начале 1915 г. около города Ипр на западе Фландрии впервые был использован отравляющий газ-неметалл. Он проникал во все щели и укрытия. Газовая атака привела к гибели 5 тысяч французскими английских солдат, более 15 тысяч стали калеками. История этого враждебного всему живого газа начинается с 1668 г., когда голландский химик Иоганн Баптист ван Гельмонт едва не погиб, нагревая смесь некой соли с азотной кислотой. А шведский химик и аптекарь Карл Вильгельм Шееле надышался этого вредного газа, изучая реакцию минерала пиролюзита с муриевой кислотой. Какой это неметалл?
29. Красно-бурый
В 1826 г. в лабораторию немецкого химика Юстуса Дибиха поступили для анализа сразу два образца: датский физик Ханс Кристиан Эрстед прислал блестящие металлические шарики, а немецкий химик Леопольд Гмелин - ампулу с красно-бурой жидкостью. Эти образцы поставили рядом, на виду, чтобы они были под рукой. Однако вскоре произошла неприятная неожиданность: лаборант случайно толкнул и разбил ампулу с жидким веществом. Через несколько секунд над образцами появилось красно-бурое пламя и едкий дым, так что всем пришлось на время покинуть лабораторию. Когда горение прекратилось, а помещение было проветрено, в стакане вместо металлических шариков (впервые полученного Эрстедом алюминия) обнаружили золотистые кристаллы неизвестного вещества. Что же представляла собой красно-бурая жидкость?
30. Кто его поймал?
Получение неметалла Э2 первым осуществил в 1745 г. М.В. Ломоносов. Он действовал на железные опилки жидкостью состава Э2SО4, разбавленной водой. Образовавшийся неметалл Ломоносов называл то «флогистоном», то «горючим паром». Этот же способ выделения Э2 применил в 1783 г. Английский химик Генри Кавендиш. Антуан Лавуазье в этом же году получил Э2, продувая струю газообразного оксида этого неметалла через до красного каления ружейный ствол. Позднее химики разных стран стали использовать для получения этого неметалла реакции алюминия или кремния со щелочами в водной сфере или взаимодействие бинарных соединений этого неметалла и кальция с водой. Какой это неметалл?
123