| Урок по дисциплине «Химия»
Тема: «Алюминий, его соединения и применение»
Цели урока:
Обучающие:
• Продолжить формирование системы знаний о строении и свойствах металлов.
• Расширить знания учащихся об алюминии, как элементе и веществе.
• Способствовать закреплению понимания взаимосвязи строения, свойств и применения металлов.
• Сформировать межпредметные связи с спецтехнологией профессии «Сварщик (электросварочные и газосварочные работы)».
Развивающие:
• Развить умения формулировать гипотезы и проводить их опытную проверку.
• Совершенствовать умения работать с лабораторным оборудованием и реактивами.
• Продолжить формирование умений обрабатывать и анализировать экспериментальные данные, делать выводы о свойствах вещества.
Воспитательные:
• Воспитывать потребности в познавательной деятельности и ценностное отношение к знаниям.
• Воспитать культуру общения через работу в парах “ученик - ученик”, “учитель - ученик”.
• Воспитать у учащихся наблюдательность, внимание, пытливость, инициативу и культуру эксперимента.
• воспитание понимания важности и практической значимости знаний об алюминии и его сплавах для успешного овладения будущей профессией.
ТИП УРОКА:
комбинированный урок с демонстрационными и лабораторными опытами, направлен на объяснение нового материала и межпредметными связями для успешного овладения профессией «Сварщик».
СРЕДСТВА ОБУЧЕНИЯ:
• компьютерная презентация,
• таблица растворимости,
• электрохимический ряд напряжения металлов,
• периодическая система Д. И. Менделеева,
• коллекция “Алюминий”,
• химическое оборудование и химические реактивы;
• рабочие листы.
ХОД УРОКА.
Сами, трудясь, вы сделаете все
и для близких людей и для себя,
а если при труде успеха не будет,
неудача – не беда, попробуйте ещё.
Д. И. Менделеев.
I. Организационный момент:
Приветствие обучающихся, проверка количества обучающихся и их принадлежностей.
Постановка целей урока.
II. Актуализация знаний.
Вопросы для актуализации знаний обучающихся.
1.На какие группы делятся все вещества?
Предполагаемый ответ: металлы и неметаллы.
2.Каково положение металлов в периодической системе химических элементов Д.И. Менделеева?
Предполагаемый ответ: 1. 2. 3. группа ПС, кроме бора; побочные подгруппы всех групп; четные ряды больших периодов.
3.Что общего в строении атомов всех металлов?
Предполагаемый ответ: на последнем электроном слое в основном от 1 до 3х электронов.
4.Как определить число электронов на последнем электронном слое у элементов главных подгрупп?
Предполагаемый ответ: по номеру группы
5.Какой вид связи у металлов?
Предполагаемый ответ: металлическая связь.
6.В чем сущность металлической связи?
Предполагаемый ответ: в узлах кристаллической решетки находятся ионы металлов и некоторое число нейтральных атомов металлов, между которыми продвигаются относительно свободные электроны, которые осуществляют связь между атомами и ионами.
7.Какие свойства металлов обусловлены наличием металлической связи?
Предполагаемый ответ: физические, химические, механические и технологические. 8.Какое из этих свойств самое важное для сварщика?
Предполагаемый ответ: свариваемость
9.Что такое свариваемость?
Предполагаемый ответ: способность металлов и сплавов образовывать прочное неразъемное соединение путем местного нагрева до расплавленного состояния.
ВЫВОД:
*Для атомов всех металлов характерно наличие на внешнем электроном слое малого числа электронов.
*Химические свойства металлов обусловлены отдачей электронов атомами металлов, то есть металлы являются восстановителями.
*Алюминий в этом отношении не исключение. Вследствие притяжения всех свободных электронов всеми положительными ионами металлическая связь в нем очень прочная.
Преподаватель. Сегодня нам предстоит познакомиться с металлом хорошо знакомым вам с детства.
Посмотрите на эти рисунки и скажите, что их объединяет:
(рисунки 1 – 5, слайд№1) (Ответ: Алюминий и его соединения)
Послушайте легенду.
“Однажды к римскому императору Тиберию пришёл незнакомец. В дар императору он принёс изготовленную им чашу из блестящего, как серебро, но чрезвычайно лёгкого металла. Мастер поведал, что получил этот металл из “глинистой земли”. Но император, боясь, что обесценятся его золото и серебро, велел отрубить мастеру голову, а его мастерскую разрушить”.
О каком металле идёт речь? (Ответ: об алюминии)
Преподаватель: значит тема сегодняшнего урока «Алюминий». (слайд№2) Давайте составим с вами план изучения металла алюминия. Что нам нужно включить в план урока?
Обучающиеся: Нахождение в природе, получение и открытие металла, строение атома алюминия, физические и химические свойства, применение, использование при сварочных работах.
План изучения нового материала (слайд№3).
1. Открытие алюминия.
2. Характеристика элемента алюминия по положению в периодической системе Д.И. Менделеева. Строение атома.
3. Строение простого вещества. Физические свойства алюминия
4. Химические свойства алюминия.
5. Нахождение в природе. Способы получения.
6. Применение алюминия.
7. Использование при сварочных работах и особенности сварки алюминия.
Обратите внимание, у вас на партах рабочие листы (Приложение 1.). В течение всего урока вы будете с ним работать, в нем также есть домашнее задание, которое вы выполните дома и на следующий урок сдадите мне на проверку.
III. Изучение нового материала
1. История открытия алюминия. (Сообщение обучающегося).
Алюминий в виде соединений был известен в глубокой древности. По свидетельству античных историков квасцы (по лат. “люмен”), т.е. сульфат алюминия-калия КAl(SO4)2 добывали во многих местах и применяли в качестве протравы при крашении тканей, а потом и в медицинских целях как кровеостанавливающее средство. В начале нашей эры римский полководец Архелай во время войны римлян с персами велел обмазать боевые башни квасцами. Дерево башен стало огнестойким, поэтому все попытки персов сжечь их оказались бесплодными.
Что может быть обыкновеннее глины? Красная глина речного обрыва, коричневая глинистая грязь проселочной дороги, белая и синеватая глина, которая неожиданно оказывается на лопате, когда копают глубокую яму или колодец. В составе любой глины содержится оксид алюминия Al2O3. Поэтому глину относят к классу минералов-алюмосиликатов (каолин, полевой шпат, нефелин) – вулканического происхождения. Минерал осадочного происхождения – боксит, похож на глину, но лишен свойственной ей пластичности. Залежи бокситов находятся на западном и южном склонах Урала и тянутся до степей Северного Кавказа. Крупнейшие месторождения нефелина NaAlSiO4 обнаружены в Красноярском крае.
В середине XIX в Западной Европе начинаются попытки получения алюминия. В 1825 году Х.К. Эрстед (Дания) впервые получил алюминий в чистом виде, используя для этого калий в виде амальгамы. Однако тогда точно не удалось выяснить, какой продукт был получен. Зато два года спустя в этом преуспел Велер (Германия), взявший для восстановления чистый калий. 20 лет упорного труда позволили ученому приготовить алюминий в виде гранул со спичечную головку. Новый металл оказался очень красивым и похож на серебро, но значительно более легким. Именно эти свойства алюминия определили его высокую стоимость: в конце XIX –начале XX в. алюминий ценился выше золота. На протяжении долгого времени он оставался музейной редкостью.
Англичане хотели почтить богатым подарком великого русского ученого Д.И. Менделеева и подарили ему химические весы, в которых одна чашка была изготовлена из золота, а другая – из алюминия. Чашка из алюминия стала дороже золотой.
Полученное “серебро из глины” заинтересовало не только ученых, но и промышленников и даже императора Франции. Впервые алюминий был использован для изготовления нескольких декоративных кирас (лат) для личной охраны (кирасир) Наполеона III и игрушек для его наследника.
Для создания мотива изучения нового материала важно познакомить обучающихся с историей открытия алюминия. Можно дать задание приготовить сообщение по этому вопросу ученику устно или в виде презентации. (Слайд№4)
2. Характеристика элемента алюминия по его положение в ПСХЭ Д.И.Менделеева. Строение атома.
Итак, рассмотрим строение атома алюминия. Предлагаю вам определить пропущенные слова в тексте, который имеется у вас в рабочих листах.
1. Порядковый номер алюминия - _______.
2. Алюминий - элемент __________группы, __________ подгруппы
3. Заряд ядра атома алюминия равен ______
4. В ядре атома алюминия __________протонов.
5. В ядре атома алюминия _________нейтронов.
6. В атоме алюминия ________ электронов.
7. Атом алюминия имеет _________энергетических уровня.
8. Электронная оболочка имеет строение __________.
9. На внешнем уровне в атоме алюминия _________ электронов.
10. Степень окисления атома алюминия в соединениях равна ________.
11. Простое вещество алюминий является ____________.
12. Оксид и гидроксид алюминия имеют ___________________ характер.
Преподаватель: Правильно ли составлена схема строения атома алюминия на следующем слайде? Свой ответ обоснуйте, опираясь на схему (слайд№5)
Обучающийся : Схема составлена правильно. На внешнем уровне у атома алюминия 3 электрона (2s и 1p), следовательно, алюминий проявляет валентность III и степень окисления +3, 0.
3. Строение простого вещества. Физические свойства алюминия
Преподаватель: Какой тип химической связи имеет металл алюминий? Тип кристаллической решетки?
Пользуясь коллекцией “Алюминий” и планом в рабочих листах, составьте характеристику физических свойств этого металла.
План характеристики физических свойств металла алюминия:
1. В каком агрегатном состоянии находится алюминий при данных условиях?
2. Какого цвета? Блеск?
3. Имеет ли алюминий запах?
4. Проявляет ли данный металл пластичность, хрупкость, эластичность?
5. Растворяется ли в воде при данных условиях?
6. Обладает ли алюминий теплопроводностью и электропроводностью?
Проверьте свои результаты, посмотрев на слайд.
Физические свойства алюминия (слайд№6):
• белый металл с серебристым блеском;
• мягкий;
• легкий (плотность = 2,7 г/см3);
• хороший проводник тепла и тока;
• пластичный;
• характерна относительно высокая упругость (не становится хрупким при низких температурах); устойчив к коррозии на воздухе, а также в химических средах;
• плавится при температуре 6600С.
4. Химические свойства алюминия (слайд№7).
Преподаватель: Какими химическими свойствами должен обладать алюминий исходя из его положения в периодической системе Д.И. Менделеева и сравнивая строение атомов элементов III периода?
Свойства атома
Ответы: в периоде с увеличением заряда ядра атома уменьшается радиус атома и способность элемента отдавать электроны тоже уменьшается, поэтому алюминий проявляет более слабые восстановительные (металлические) свойства, чем натрий и магний, он относится к переходным металлам и занимает промежуточное положение между металлами и неметаллами, его соединения являются амфотерными.
Задание1: определите место алюминия в электрохимическом ряду напряжений и сделайте вывод об его активности. (Учащиеся смотрят на электрохимический ряд напряжений).
Ответ: алюминий находится в начале ряда напряжений сразу после щелочных и щелочноземельных металлов. Поэтому он должен проявлять высокую химическую активность.
Преподаватель: алюминий применяется в быту, из него изготавливают бытовые изделия. Известно, что ни кислород, ни вода на него не действуют (учитель опускает алюминиевую пластину в стакан с водой). В результате противоречий между знаниями и жизненными наблюдениями создается такая ситуация:
Почему алюминий, стоящий в начале ряда напряжений проявляет пассивность?
Почему в алюминиевой кастрюле можно сварить суп?
ОТВЕТ: Потому что поверхность алюминия покрывается очень прочной тонкой оксидной пленкой, которая защищает металл от воздействия воздуха и воды.
Ребята, в начале урока мы сказали, что алюминий - это переходный металл. Следовательно, с какими веществами будет взаимодействовать алюминий?
Обучающийся: С неметаллами (галогенами, серой, углеродом и т. д.).
(видеофрагмент «Взаимодействие алюминия с иодом, серой, кислородом»)
Задание2. Написать уравнение реакции взаимодействия алюминия с кислородом. Обучающиеся пишут уравнение реакции: 4Al + 3O2 —2Al2O3
По аналогии ученики пишут уравнения реакций взаимодействия алюминия с другими простыми веществами: серой, галогенами (хлором), азотом:
2Al +3Cl2 — 2AlCl3
2Al + 3S — Al2S3
2Al + N2 — 2AlN
В уравнениях реакций обучающиеся отмечают степени окисления алюминия до и после реакции и делают вывод, что алюминий в реакциях является восстановителем как и другие металлы.
Задание3. Взаимодействие алюминия со сложными веществами.
Преподаватель: если с алюминия удалить оксидную пленку, то алюминий должен проявлять свойства аналогичные щелочно-земельным металлам. Обучающиеся пишут уравнение реакции взаимодействия алюминия с водой по аналогии со щелочными и щелочно-земельными металлами и отмечают условия реакции (удалить с поверхности металла оксидную пленку
2Al + 6H2O — 2Al(OH)3 + 3H2
Преподаватель: Запомните, что в обычных условиях оксидная пленка защищает алюминий от разрушения (коррозии).
Вспомните, с какими сложными веществами взаимодействуют металлы и алюминий в том числе?
Обучающийся: С растворами кислот. Алюминий будет вытеснять водород, т.к. в ряду напряжения металлов он стоит правее водорода.
Преподаватель: Действительно алюминий взаимодействует с растворами кислот с выделением водорода. А концентрированные серная и азотная кислоты пассивируют поверхность алюминия, образуя на его поверхности прочную оксидную пленку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.
Запишите уравнение реакции взаимодействия алюминия с соляной кислотой в рабочих листах. Один обучающийся пишет уравнение реакции у доски.
Проверьте себя.
Основываясь на то, что алюминий - переходный металл, подумайте, с какими еще сложными веществами может взаимодействовать алюминий?
Обучающийся: С растворами щелочей.
Преподаватель: Давайте вместе запишем уравнение реакции взаимодействия алюминия с раствором гидроксида натрия. Что образуется в результате реакции?
Обучающийся: Данная реакция протекает с образованием алюмината натрия и выделением газообразного водорода.
Преподаватель: Что такое алюминотермия?
Обучающийся: Алюминотермия - это способ восстановления многих металлов из их оксидов с помощью алюминия, если в электрохимическом ряду напряжения металл расположен после алюминия.
Преподаватель: Как вы думаете, будет ли протекать следующая реакция?
Al + Fe3O4 = ?
Обучающийся: Данная реакция будет протекать, так как алюминий в электрохимическом ряду напряжений стоит правее железа, то есть он будет вытеснять железо из его оксида.
Преподаватель: Составьте уравнение данной реакции в рабочих листах.
Обобщение по химическим свойствам. (Делают обучающиеся):
Алюминий является активным металлом, реагирует с простыми веществами- неметаллами, восстанавливает металлы до свободного состояния, стоящие в электрохимическом ряду напряжения справа от него. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, так как покрыт защитной оксидной пленкой.
5. Нахождение в природе. Получение (слайд№8).
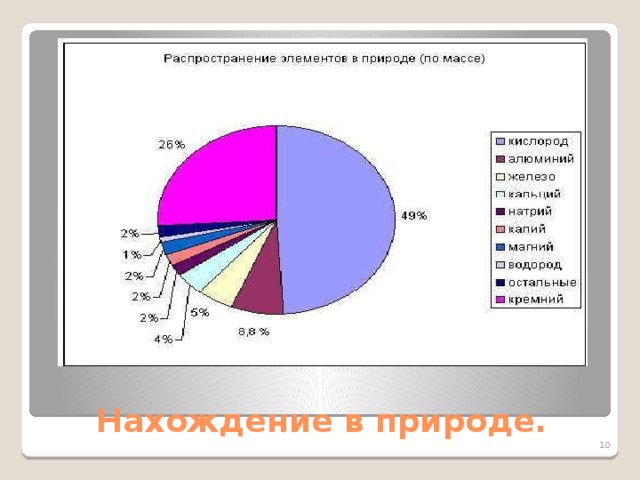
ЗаданиеI. Рассмотрите диаграмму “Распространение элементов в природе”.
Вопрос: определите, какое место занимает алюминий среди других элементов.
ЗаданиеII. Рассмотрите образцы природных соединений. Сравните их по твердости, прочности, цвету. (коллекция)
Ответы: алюминий - самый распространенный металл в природе. Его содержание в земной коре составляет 8,8 %. Он занимает 3 место по распространенности среди других элементов (после кислорода и кремния).
Получение.
Преподаватель: Алюминий очень прочно связан в природных соединениях с кислородом и другими элементами, и выделить его из этих соединений химическими методами очень трудно. Алюминий можно получить электролизом – разложением расплава его оксида Al2O3 с помощью электрического тока. Но температура плавления оксида алюминия около 20500С.
Технически доступным алюминий стал после того , как был найден способ понизить температуру плавления Al2O3 хотя бы до 10000С. Этот способ открыли в 1886 году американец Ч.Холл и француз П.Эру, которые установили, что Al2O3 хорошо растворяется в расплавленном криолите, формула которого Na3AlF6.
Мировое производство алюминия постоянно растет и занимает по объему второе место среди металлов.
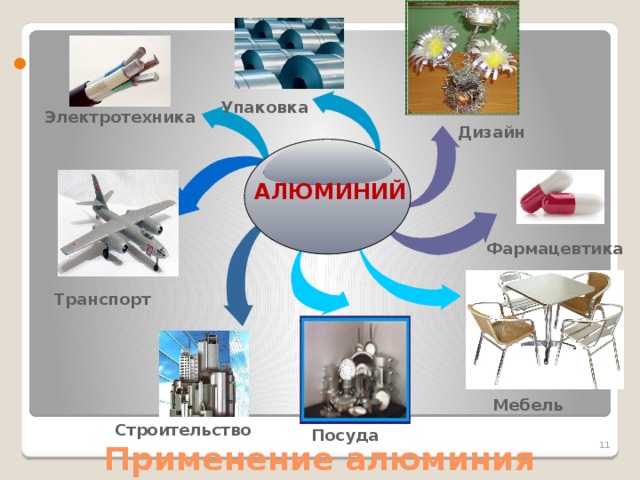
6. Применение (слайд № 9)
Преподаватель: В течение всего урока звучали отрасли применения алюминия. Как вы уже поняли, масштабы применения этого металла широки. И с каждым годом отрасли применения данного металла расширяются. Как вы думаете, с чем связано столь широкое применение алюминия?
Обучающийся:
1. Алюминий - самый распространенный металл в земной коре.
2. Обладает высокой коррозионной стойкостью.
3. Малая плотность.
4. Сплавы на основе алюминия обладают прочностью.
5. Высокая электропроводность и теплопроводность.
6. Высокая химическая активность используется в алюминотермии.
Преподаватель: Давайте рассмотрим основные области применения алюминия и его сплавов.
Ответы: основные области применения алюминия связаны с легкостью, прочностью и устойчивостью. В таком сочетании полезных свойств нуждается в первую очередь транспорт. Главные потребители алюминиевых сплавов – самолетостроение и автомобилестроение.
Свойства алюминиевых сплавов, а также их красивый внешний вид обусловили широкое применение их в строительстве. Алюминий и его сплавы используют при отделке станций метрополитена, фасадов зданий. Гофрированными листами сплавов покрывают крыши.
Высокая электрическая проводимость чистого алюминия используется в электротехнике. Из алюминия изготавливают электропровода. При одинаковом электрическом сопротивлении масса алюминиевого провода значительно меньше массы медного. Это облегчает сооружение опорных мачт, на которые подвешиваются провода.
Широко применяется “серебряная краска” на основе алюминиевого порошка. Она не только придает красивый внешний вид изделиям, но и защищает их от химического разрушения. Для защиты от солнечных лучей покрывают цистерны, предназначенные для перевозки нефтепродуктов.
В быту алюминий используют в виде кухонной посуды. Здесь используются такие свойства как высокая теплопроводность, способность противостоять действию не только холодной, но и кипящей воды и неядовитость его соединений, которые в небольшом количестве могут образоваться при действии на алюминий слабых органических кислот, содержащихся в пище.
Алюминий используют в сварочных работах (слайд№10):
для производства различных сплавов;
в авиа-, авто -, суда -, приборостроении, электротехнике, изготовление корпусов космических ракет, химической аппаратуры, строительстве мостов, зданий, в быту;
алюминием покрывают чугун и сплавы для защиты от коррозии (алитирование);
термит (смесь алюминия и оксидов железа)- для сварки рельсов;
получение металлов особой чистоты (алюмотермия).
Вопросы для актуализации знаний обучающихся по использованию алюминия в сварочных работах.
1.Каким образом можно повысить прочность металлов?
Предполагаемый ответ: добавить примеси.
2.Что называется сплавом?
Предполагаемый ответ: соединение металлов с металлами и неметаллами.
3.Приведите примеры сплавов?
Предполагаемый ответ: сталь, чугун, бронза, латунь.
4.Какие типы соединений образуются в сплавах при затвердевании жидкого раствора?
Предполагаемый ответ: механическая смесь, твердый раствор, химическое соединение.
5.Какое будет соединение, если после затвердевания различают кристаллы соединившихся компонентов?
Предполагаемый ответ: механическая смесь.
ВЫВОД: прочность чистых металлов можно повысить путем легирования.
Все технические сплавы на основе алюминия принято разделять на литейные и деформируемые.
К литейным сплавам относят силумины: Al + Si (10-20%)
Чтобы понять какими свойствами обладают силумины, и какую структуру они будут иметь после затвердевания, рассмотрим диаграмму состояния сплавов Al + Si.
Структура силуминов будет состоять из а - твердого раствора и эвтектики,
содержащей 11,6 % Si. Чем больше в составе силуминов эвтектики, тем лучше
литейные свойства. Эвтектика представляет собой механическую смесь зерен а - твердого раствора и поэтому прочность и пластичность их невысокие: бв = 160 МПа; δ = 4%
Для улучшения строения эвтектики и получения мелкозернистой структуры,
силумины модифицируют металлическим натрием или смесью NaCl и NaF.
Силумины имеют хорошие литейные свойства, удовлетворительную
свариваемость и обрабатываемость резанием. Силумины маркируют, буквами АЛ и цифрами, указывающими порядковый номер. Обучающиеся работают с таблицами: «Сплавы алюминия», делают записи в конспекте.
Силумины применяются для изготовления литых деталей сложной конфигурации: блоки цилиндров двигателей внутреннего сгорания, корпуса компрессоров.
Деформируемые литейные сплавы подразделяются на две группы:
1.Сплавы, не упрочняемые термической обработкой;
2.Сплавы, упрочняемые термической обработкой.
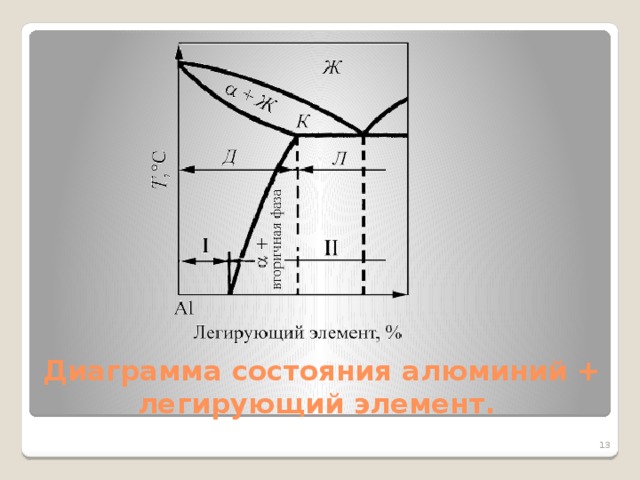
Рассмотрим диаграмму состояния сплавов Al + легирующий элемент. (слайд № 11)
Из диаграммы видно, что все сплавы находящиеся левее точки Д можно перевести в однофазное состояние твердого раствора с помощью нагрева. Эти сплавы пластичны, хорошо обрабатываются давлением. Они делятся на две группы:
1.сплавы (А) - левее точки F. Их структура при любых температурах – однородные зерна а – твердого раствора. Это сплавы, не упрочняемые термической обработкой. Они наиболее важны для сварщика, так обладают хорошей свариваемостью. Эти сплавы маркируются :АМц (Al + Mn) и АМг (Al + Mg). Например: АМг3. Цифра в марке показывает среднее значение элемента в десятых долях. Входя в кристаллическую решетку алюминия, атомы магния и марганца существенно повышают его прочность, при этом пластичность сохраняется. Деформируемые сплавы, не упрочняемые термической обработкой, применяются для изготовления сварных емкостей для горючего, азотной кислоты и других кислот, мало- и средненагруженных деталей конструкций.
2. сплавы (Б) – между точками Д и F. Это сплавы, упрочняемые термической обработкой. Обработка таких сплавов заключается в закалке и последующем старении пересыщенного а – твердого раствора.
Деформируемые сплавы, упрочняемые термической обработкой, маркируют:
Д 16, где буква показывает название сплава – дюралюминий, а цифра – порядковый номер сплава. Эти сплавы имеют высокую прочность, твердость, коррозийную стойкость и применяются в самолетостроении, судостроении, транспортной и пищевой промышленности.
ВЫВОД: (делают обучающиеся, отвечая на вопросы, поставленные перед началом изучения данного раздела).
- Применение алюминия и его сплавов в промышленности основано на следующих свойствах: коррозийной стойкости, пластичности, прочности, отражательной способности, тепло- и электропроводности.
- Наиболее ценные для сварщика сплавы, обладающие хорошей свариваемостью: сплавы АМг и АМц.
VI. Закрепление изученного материала.
Вопросы:
• Ученый, впервые получивший алюминий. (Эрстед).
• Минерал состава Al2O3, обладающий очень высокой прочностью и твердостью. (Корунд).
• Способ получения металлов из оксидов с помощью алюминия. (Алюминотермия).
• Латинское слово, от которого образовано название химического элемента Al. (Алюмен).
• Процесс разложения веществ с участием электрического тока. (Электролиз).
• Чем является алюминий в химических реакциях? (Восстановитель).
(Приложение№2 Тестовое задание)
Проверка теста
ІV. Подведение итогов урока. Рефлексия. Объявляются оценки за устные ответы и работу у доски.
1. Над какой темой мы сегодня работали?
2. Что нового вы узнали об алюминии?
3. Решили ли мы проблему об активности алюминия?
4. Какими путями решали эту проблему?
5. К каким выводам пришли?
6. Оцените свою работу на уроке:
- материал усвоен (на всех этапах урока “4”, “5”)
- материал усвоен недостаточно (оценки “3”, “4”)
V. Домашнее задание.
• Используя материал сегодняшнего урока, составьте цепочку превращений алюминия и его соединений.
• Проделать опыты: поместить в столовый уксус, нашатырный спирт и в воду по кусочку алюминиевой фольги. Описать происходящие изменения с течением времени. Написать уравнения реакций.
Заключение (слайд №12): « Я металл, серебристый и лёгкий,
И зовусь самолётный металл,
И покрыт я оксидною плёнкой
Чтоб меня кислород не достал» |







 2Al 2 O 3 2.Взаимодействие с простыми веществами: 2Al +3Cl 2 — 2AlCl 3 2Al + 3S — Al 2 S 3 2Al + N 2 — 2AlN 3.Взаимодействие со сложными веществами: 2Al + 6H 2 O — 2Al(OH) 3 + 3H 2 2Al + 6 HCl — 2 Al Cl 3 + 3H 2 Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O Химические свойства алюминия . 5" width="640"
2Al 2 O 3 2.Взаимодействие с простыми веществами: 2Al +3Cl 2 — 2AlCl 3 2Al + 3S — Al 2 S 3 2Al + N 2 — 2AlN 3.Взаимодействие со сложными веществами: 2Al + 6H 2 O — 2Al(OH) 3 + 3H 2 2Al + 6 HCl — 2 Al Cl 3 + 3H 2 Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O Химические свойства алюминия . 5" width="640"




![Минералы алюминия Боксит Al 2 O 3 • H 2 O Нефелины KNa 3 [AlSiO 4 ] 4](https://fsd.kopilkaurokov.ru/uploads/user_file_5490ee24daf0f/img_user_file_5490ee24daf0f_2_1.jpg)


![Бирюза CuAl 6 [PO 4 ] 4 (OH) 8 · 5 H 2 O](https://fsd.kopilkaurokov.ru/uploads/user_file_5490ee24daf0f/img_user_file_5490ee24daf0f_2_4.jpg)





















