Муниципальное бюджетное общеобразовательное учреждение Верхнедонского района
Верхнебыковская основная общеобразовательная школа
Методическая разработка урока по химии
Уравнения химических реакций. Реакции обмена.
Выполнила:
учитель химии
Михина Н.М.
2017г.
Содержание
Введение ………………………………………..…………………………3
Конспект урока «Уравнения реакций. Реакции обмена»………...…..…7
Технологическая карта урока «Уравнения реакций. Реакции обмена» 12
Заключение ……………………………………………………………….19
Список литературы ..…………………………………………………….20
Приложения ……………………………………………………………....21
1.Введение.
Эта тема относится к разделу «Изменения, происходящие с веществами», которая идёт после изучения учащимися таких разделов как «Атомы химических элементов», «Простые вещества», «Соединения химических элементов». Значит учащиеся уже могут работать с основными классами неорганических соединений, они могут сами составлять формулы этих соединений, разделять вещества на основные группы, определять типы химических связей между атомами в составе одного вещества.
И только сейчас, опираясь на полученные знания, они начинают овладевать умениями составления уравнений химических реакций. Химия – это наука о веществах, их свойствах и превращениях. В дальнейшем весь школьный курс изучения химии будет базироваться на знаниях, которые были получены учениками при изучении последних тем. То есть, ученики не смогут дальше изучать химию, если не научится составлять уравнения химических реакций, так как именно в уравнениях химических реакций заключена вся информация о свойствах данного вещества. Если же ученик не знает классификацию химических реакций, то он не сможет работать с веществом.
Цель урока: способствовать усвоению обучающимися знаний о типах химических реакций (реакций обмена), умений их определять.
Задачи урока:
Образовательные: повторение знаний о химических реакциях, правилах их составления,
законе сохранения массы веществ, изучение классификаций химических реакций,
научиться определять их тип;
продолжить формирование умений записывать уравнения.
Развивающие: продолжение работы по развитию интеллектуальных и мыслительных умений (умение анализировать, сравнивать и обобщать); развивать познавательный интерес при выполнении лабораторных опытов.
Воспитательные: способствовать воспитанию культуры общения через работу в группах «ученик-ученик», «ученик-учитель» (умение слушать и слышать другого человека);
воспитывать такие личностные качества, как внимание, наблюдательность,
инициатива;
проводить рефлексию собственной деятельности.
Ожидаемые результаты:
Личностные: умение учиться, соблюдать правила ТБ! при работе с химическими реактивами, целеустремленность, быть активной личностью, проявляющей инициативу, умение управлять своей познавательной деятельностью.
Метапредметные: умение логически мыслить, сравнивать, использовать знаково-символические и образные средства для описания химических реакций, выделять проблему, делать выводы, обобщать, определять цели и задачи деятельности, выбирать средства реализации цели и применять их на практике, выполнять самооценку, осуществлять пошаговый и итоговый самоконтроль по результату, участвовать в продуктивном учебном диалоге, умение работать в паре, осуществлять взаимоконтроль и оказывать в сотрудничестве необходимую взаимопомощь.
Предметные: умение давать определение понятиям «реакции обмена», «реакции нейтрализации», выявление условий их протекания до конца, проводить, наблюдать и описывать химический эксперимент, описывать и различать изученные классы сложных веществ, химические реакции, моделировать реакции.
Тип урока: комбинированный
Форма урока: урок-эксперимент.
Методы обучения:
- словесные – рассказ учителя, беседа;
- наглядные – использование презентации;
- практические – лабораторные опыты;
- проблемно - диалогические – постановки проблемы (побуждающий от проблемной ситуации диалог), поиска решения (подводящий от проблемы диалог).
Технологии построения урока: технология проблемного обучения, информационно-коммуникативные технологии, здоровьесберегающие технологии, смысловое чтение, технология обучения в сотрудничестве.
Формы работы: индивидуальная, парная, фронтальная.
Методы: репродуктивный (воспроизведение ранее полученных знаний в процессе беседы, выполнение задания «Диктант»), частично-поисковый, беседа, самостоятельная работа.
Приемы обучения: постановка проблемы, выявление признаков, сравнение, выводы, обобщения.
Средства обучения: компьютер для учителя, интерактивная доска, презентация к уроку, учебник, рабочие листы (маршрут урока), карточки для самопроверки и взаимопроверки, наборы хим. реактивов: растворы веществ: CuSO4, NaOH, HCl, Na2CO3, фенолфталеин; инструкция к лабораторной работе, лист контроля, лист рефлексии.
Структура урока:
На первом этапе (орг. момент) урока мы подготавливаем обучающихся к предстоящей деятельности на уроке: производится обмен предметами с учеником; обсуждается девиз урока подписываются листы «Маршрут урока» и лист «Рефлексия».
На втором этапе урока проводим актуализацию знаний обучающихся о том,
1. Что мы изучаем?
2. Какие признаки химических реакций вы знаете?
3. Перечислите известные типы реакций и дайте им определение.
Применяют свои знания к конкретным заданиям (Диктант).
На третем этапе урока – выявление затруднения в выполнении задания «Диктант», определение проблемного вопроса «Что это за тип химической реакции?», с помощью интерактивного задания – определение темы постановка цели урока. Учащиеся предлагают различные варианты решения проблемы и достижения целей урока.
Следующий этап – открытие нового знания. Этот этап урока проходит в форме работы в паре. Учащиеся проводят лабораторные опыты по инструктивным карточкам и формулируют выводы.
На пятом этапе - учащиеся делятся полученными знаниями, заполняют в «маршруте урока» недостающие сведения, формулируют полное определение реакций обмена.
Учитель проводит демонстрационный опыт и учащиеся учатся определять, всегда ли возможна реакция обмена.
Шестой этап – закрепление, применение нового знания (выполнение упражнений «выбери верное утверждение», найди реакции обмена, идущие до конца).
Седьмой этап – домашнее задание.
Следующий этап – подведение итога, выставление оценки за урок.
Последний этап – рефлексия.
2. Конспект урока «Уравнения химических реакций. Реакции обмена»
I. Оргмомент.
Слайд 1.
Здравствуйте. Садитесь. Я рада видеть вас на уроке химии.
Сегодня я начну урок необычно. Попрошу карандаш у …, а отдам ей свою ручку. Что мы сделали? Попрошу запомнить это.
Слайд 2.
Девиз нашего урока: «Теория – это полководец, а эксперимент – солдаты». Леонардо да Винчи. Как вы понимаете это изречение? (Обсуждение)
Сегодня вы будете оценивать свою работу на каждом этапе урока, используя лист рефлексии. Подпишите его. Подпишите лист «Маршрут урока».
II. Актуализация знаний.
Начнем с повторения теории.
1. Отгадайте загадку: ''Она идет'', ''она прошла'', никто ни скажет, что пришла. Что это? (химическая реакция)
2. Какие признаки химических реакций вы знаете
3. Перечислите известные типы реакций и дайте им определение (фиксирую на доске типы реакций).
4. Примените свои знания к конкретным заданиям. (Учащиеся выполняют задания «Диктант» в листе «Маршрут урока»).
Проведите самопроверку (с образцом) и выставите в лист рефлексии баллы за задания.
Диктант:
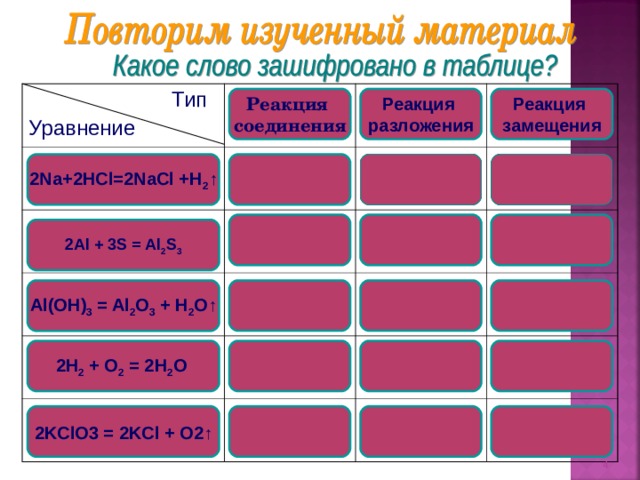
Расставьте коэффициенты и определите тип реакции
1. Ca + O2 = CaO ______________________________
2. Fe2O3 + Mg = MgO + Fe ___________________________
3. Al(OH)3 = Al2O3 + H2O _____________________________
4. Na2SO4 + KCl = K2SO4 + NaCl __________________________
Вставьте пропущенное слово:
5. Реакции, в результате которых из нескольких исходных веществ образуется одно сложное вещество – это _____________________
6. Реакции, в результате которых из одного сложного вещества образуются два или несколько более простых веществ – это ______________________________
7. Это реакции, где атомы простого вещества замещают атомы одного из элементов в сложном веществе __________________________________.
III. Выявление места и причины затруднения. Определение темы урока.
1.У всех ли реакций вы смогли определить тип? (Нет)
Слайд 3.
(Na2SO4 + 2KCl = K2SO4 + 2NaCl)
Побуждение к осознанию:
2. В чем затруднение?
Побуждение к проблеме:
3. Какой возникает вопрос? (фиксирую вопрос на доске).
Дать название новому типу реакции нам помогут знания с предыдущих уроков. Нужно определить тип данной химической реакции по записи и поставить галочку в нужной клеточке (Слайд 4).
IV. Целеполагание и планирование деятельности (выхода из затруднения).
1. Какова цель урока? (Слайд 5)
Какие у вас есть версии решения проблемы? (Ребята предлагают разные варианты)
2. Что является более ценным для приобретения опыта по изучению веществ и реакций? (напоминаю о словах Леонардо да Винчи)
(Ребята выбирают химический эксперимент)
3. Повторение правил техники безопасности. (Слайд 6).
V. Изучение нового материала – открытие нового знания.
1. Предлагается проведение опытов в паре по инструктивным карточкам с формулированием выводов: осуществима практически или нет проведенная реакция. (Заполняется лист «Маршрут урока).
При прогнозировании продуктов реакций, напоминаю о том, что я сделала в начале урока – то же самое делают вещества – реагенты.
Введение понятия «реакция нейтрализации».
2. Каждая пара по очереди описывает свой опыт, записывает уравнение реакции, делает вывод. (учащиеся заполняют необходимым материалом «Маршрут урока».
Лабораторный опыт №1.
1. Возьмите пробирку
2. В пробирку налейте раствор гидроксида натрия (NaOH), добавьте к нему раствор соли сульфата меди (СuSO4).
3. Запишите, что наблюдаете? _________________________________________________
4. Составьте уравнение реакции:
____________________________________________________________________________
Лабораторный опыт №2.
Возьмите пробирку.
В пробирку налейте раствор гидроксида натрия (NaOH), добавьте к нему несколько капель фенолфталеина. Что наблюдаете? ______________________________________________________________________
Почему? ____________________________________________________________________
К полученному содержимому пробирки прилейте немного раствора серной кислоты (H2SO4).
Что наблюдаете? _______________________________________________________
Составьте равнение реакции: ______________________________________________________________________
Лабораторный опыт №3.
В пробирку нальем раствор карбоната натрия (Na2CO3).
Прильем раствор серной кислоты (Н2SO4).
Запишите, что наблюдаете? _____________________________________________
Составьте уравнение реакции:
______________________________________________________________________
Лабораторный опыт №4.
Возьмите пробирку.
В пробирку налейте раствор хлорида натрия (NaCl), добавьте к нему раствор гидроксида натрия (NaOH)
Что наблюдаете?_______________________________________________________
Составьте уравнение реакции: ______________________________________________________________________
VI. Выражение решения.
1. Какой была цель нашего урока?
2. Какой вывод мы можем сделать, что же это такое – реакции обмена?
3. Я предлагаю вам посмотреть ещё один опыт и определить, произошла реакция обмена или нет (Демонстрационный опыт)
4. Какой вывод мы можем сделать? (Учащиеся делают вывод, что такое Реакции обмена, дают определение этому типу реакций).
VII. Применение нового знания.
Используя свои новые знания, выполните на листе «Маршрут урока» задание №1.
Задаиие 1. Выберите верные утверждения.
1. Реакция обмена - это реакция между простыми и сложными веществами.
2. Реакция обмена протекает между сложными веществами, которые обмениваются своими составными частями.
3. Реакция обмена идет до конца, только когда образуется вода.
4. Реакция обмена идет до конца, когда образуется газ, осадок или вода.
5. Реакция обмена идет до конца, только когда образуется газ.
6. Реакция между кислотой и основанием называется реакцией нейтрализации.
7.Любая реакция обмена является реакцией нейтрализации.
8. HNO3 + NaOH → Na NO3 + H2O - это реакция обмена и нейтрализации.
9. CuO + H2SO4 → CuSO4 + H2O - это реакция обмена.
10. Al2O3 + 6HCl → 2AlCl3 + 3H2O - это реакция нейтрализации.
2. Обменяйтесь листами контроля и проверьте у соседа правильность выполненного задания (сверка с образцом). Оцените его и выставите в лист рефлексии (5б).
3. Выполните задание №2 на листе «Маршрут урока».
Задание 2. Среди предложенных реакций выбрать реакции обмена, и определить протекают ли они до конца.
| 1ученик | 2 ученик |
| а) CuO + H2 = Cu + H2O | а) NaCl + AgNO3 = AgCl + NaNO3 |
| б) 3K2CO3 + 2H3PO4 = 2K3PO4 + 3H2O + +3CO2 | б) CaO + H2O → Ca(OH)2 |
| в) MgCl2 + 2KNO3 = Mg(NO3)2 + 2KCl | в) Ca(OH)2 + 2HNO3 → Ca (NO3)2 + +2H2O |
| г) CaO + 2HCl → CaCl2 + H2O | г) 2FeCl2 + Cl2 →2 FeCl3 |
| д) 2H2O = 2H2 + O2 | д) 2NaOH + Li2SO4 =2 LiOH + Na2SO4 |
Проведите самооценку, сверив правильные ответы (с образцом). Оцените задание и выставите в лист рефлексии.
4. В чем испытали затруднение? Причина затруднения? (Обсуждение затруднений)
VIII. Итог урока. Оценка деятельности.
Давайте вспомним цель нашего урока, основной вопрос. Ответили ли мы на него? Достигли ли поставленной цели?
Поставьте в 1-ю колонку балл за устные ответы (оценивает учитель), посчитайте общее количество баллов и выставьте отметку за урок.
IX. Информация о домашнем задании.
Что нужно сделать, чтобы закрепить изученный материал?
Слайд 7.
Домашнее задание - § 32 упр. 3,4
письменно
Записать пять примеров реакций обмена, идущих до конца.
X. Рефлексия учебной деятельности на уроке.
Заполните листы рефлексии, ответив на поставленные перед вами вопросы.
Спасибо за урок! У меня отличное настроение после работы с вами! А у вас? Отметьте смайлик настроения в листе рефлексии.
До свидания!

3.Технологическая карта урока химии 8 класс «Уравнения реакций. Реакции обмена»
| Этапы урока (в соответствии со структурой учебной деятельности) | Деятельность учителя | Планируемая деятельность учащихся | Развиваемые (формируемые) учебные действия |
| предметные | универсальные |
| Организационный момент. Мотивация уч-ся. | Сегодня я начну урок необычно. Попрошу карандаш у …, а отдам ей свою ручку. Что мы сделали? Попрошу запомнить это. Девиз нашего урока: «Теория – это полководец, а эксперимент – солдаты». Леонардо да Винчи. Сегодня вы будете оценивать свою работу на каждом этапе урока, используя лист рефлексии. Подпишите его. Так же подпишите лист «Маршрут урока» |
Отвечают на вопрос: обменялись предметами.
Обсуждение эпиграфа.
Подписывают листы «Маршрута урока» и рефлексии | Понимание роли теории в науке и эксперимента. | Мотивация к учению. Ценностно-смысловая ориентация учащихся. |
| Актуализация знаний. | Начнем с повторения теории. 1. Отгадайте загадку: ''Она идет'', ''она прошла'', никто ни скажет, что пришла. Что это? 2. Какие признаки химических реакций вы знаете? 3. Перечислите известные типы реакций и дайте им определение (фиксирую на доске типы реакций). 4. Примените свои знания к конкретным заданиям (Диктант). Проведите самопроверку (с образцом) и выставите в лист рефлексии баллы за задания– максимум 9б. | Ответ на в. №1: Химическая реакция
Ответ на в. №2: Выделение тепла и света, образование осадка, выделение газа, изменение окраски; Ответ на в.№3: р-ция разложения, соединения, замещения
4. Выполняют задание в тетрадке. Самопроверка, работа с листом рефлексии. | Закрепление знаний по типам химических реакций по числу и составу веществ. Умение использовать знаково-символические и образные средства для описания химических реакций. | Развитие мотивов и интересов познавательной деятельности. Развитие моторной и образной памяти. Умение оценивать правильность выполнения учебной задачи, собственные возможности ее решения.
Контроль и самооценка своих действий. |
| Выявление места и причины затруднения. Определение темы урока. | Задание на новый материал: 1. Определите тип реакции. (Na2SO4 + 2KCl = K2SO4 + 2NaCl) Побуждение к осознанию: 2. Смогли выполнить задание? 3. В чем затруднение? Побуждение к проблеме: 4. Какой возникает вопрос? (фиксирую вопрос на доске). Дать название новому типу реакции нам помогут знания с предыдущих уроков. Нужно определить тип данной химической реакции по записи и поставить галочку в нужной клеточке. | 1. Испытывают затруднения (проблемная ситуация).
2. Нет, не смогли.
3. Мы такой тип не изучали (осознание проблемы).
4. Что это за новый тип реакции? (основной вопрос урока). Выполняют интерактивное задание и получают слово ОБМЕН. | Выявление и осознание противоречия между необходимостью и невозможностью выполнения задания из-за недостатка знаний. | Умение определять способы действий в рамках предложенных условий и требований. Умение формулировать проблему. Участвовать в продуктивном диалоге. Развитие мотивов познавательной деятельности. |
| Целеполагание и планирование деятельности (выхода из затруднения). | 1. Какова цель урока?
Какие у вас есть версии решения проблемы?
2. Что является более ценным для приобретения опыта по изучению веществ и реакций? (напоминаю о словах Леонардо да Винчи) 3. Повторить правила Т.Б. | 1. Рассмотреть новый тип реакций. 2. Дать определение. 3.Определить условия протекания реакций обмена Предполагают различные варианты (спросить у учителя, найти в учебнике, провести эксперимент и др.) 2. Останавливаемся на эксперименте, оформление Л.О. в листе «Маршрут урока». | Овладение основами химической грамотности. | Умение самостоятельно определять цель своего обучения, планировать пути достижения цели. Умение понимать другие позиции.
|
| Изучение нового материала – поиск решения (открытие нового знания). | 1.Предлагается проведение опытов в паре по инструктивным карточкам с формулированием выводов: осуществима практически или нет проведенная реакция. При прогнозировании продуктов реакций, напоминаю о том, что я сделала в начале урока – то же самое делают вещества – реагенты. Введение понятия «реакция нейтрализации». 2. Каждая пара по очереди описывает свой опыт, записывает уравнение реакции, делает вывод.
| Выполняют лабораторную работу по инструктивной карте, описывают опыты, делают выводы, учатся записывать реакции нового типа.
Выводят определение реакции нейтрализации. | Формирование умений безопасного и эффективного использования лабораторного оборудования, практических умений, адекватной оценки полученных результатов. Выявление признаков нового типа реакций с помощью подводящего диалога. Введение понятия «реакция нейтрализации». Умение описывать и различать изученные классы сложных веществ, химические реакции. | Формирование логического мышления, коммуникативной компетенции, умения делать выводы. Развитие словесно-логической и эмоциональной памяти. Владение устной и письменной речью. Умение организовать учебное сотрудничество в парах. |
| Выражение решения. | 1. Какой была цель нашего урока?
2. Какой вывод мы можем сделать, что же это такое – реакции обмена?
3. Я предлагаю вам посмотреть ещё один опыт и определить, произошла реакция обмена или нет.
4. Какой вывод мы можем сделать?
| 1. Рассмотреть новый тип реакции?
2. Реакции обмена. Сверяют свое определение с записью на слайде, с учебником.
3. Почему одни реакции обмена идут до конца, а другие нет?
4. Если в результате образуются осадок, газ или вода.
|
Умение давать определение понятию «реакция обмена», выявление условий их протекания до конца.
| Развитие образной памяти, владение устной речью. Умение выполнять анализ, строить логичные рассуждения и добывать новые знания из наблюдения и эксперимента. Умение контролировать и оценивать свои действия. |
| Применение нового знания. | 1. Используя свои новые знания, выполните на листе контроля задание №1. 2. Обменяйтесь листами контроля и проверьте у соседа правильность выполненного задания (сверка с образцом). Оцените его и выставите в лист рефлексии (5б). 3. Выполните задание №2 на листе контроля. Проведите самооценку, сверив правильные ответы (с образцом). Оцените задание и выставьте в лист рефлексии. 4. В чем испытали затруднение? Причина затруднения?
| 1. Выполнение заданий из листа контроля – выбирают верные утверждения. 2. Сравнивают с правильными ответами, данными на слайде – взаимопроверка. Самооценка в листе рефлексии.
3. Выполняют задание на выбор реакций обмена, идущих до конца. Самоанализ, самооценка в листе рефлексии.
4. Разбор ошибок всем классом – сильные учащиеся делают пояснения для слабых учеников. | Выявление уровня усвоения знаний и способов действий, а также выявление недостатков в знаниях и способах действий, установление причин выявленных недостатков. | Владение основами самоконтроля, взаимоконтроля, самооценки. Умение оценивать правильность выполнения учебной задачи.
Оказание в сотрудничестве необходимой взаимопомощи. |
| Информация о домашнем задании. | Что нужно сделать, чтобы закрепить изученный материал? Домашнее задание - § 32 упр. 3,4 письменно Записать пять примеров реакций обмена, идущих до конца
| Выполнить дома самостоятельно подобные задания.
Записывают д/з. | Обеспечение понимания цели, содержания и способов выполнения домашнего задания. | Умение выполнять выбор. Самоопределение. |
| Рефлексия учебной деятельности на уроке. | Заполните листы рефлексии, ответив на поставленные перед вами вопросы. | Заполняют до конца лист рефлексии, отвечая на вопросы. |
| Умение выполнять рефлексию и оценку процесса и результатов деятельности. |
| Итог урока | Спасибо за урок! У меня отличное настроение после работы с вами! А у вас? Отметьте смайлик настроения в листе рефлексии. До свидания! | Отмечают в листе рефлексии смайлик настроения. |
| Умение выполнять рефлексию. |
В данной разработке урока был использован комплекс средств, формирующих учебные действия, которые помогут школьникам стать полноценной социальной личностью. Личностью, которая будет стремиться реализовать свои возможности и будет способной делать осознанный и ответственный выбор. При системном подходе комплекс средств, использованных на данном уроке, позволяет учителю достичь поставленной цели.
Ценность данной работы состоит в возможности ее использования учителями химии при разработке своих уроков по теме «Уравнения реакций. Реакции обмена».
Литература:
Габриелян О.С. химия 8 класс. – М.: Дрофа, 2008.
Габриелян О.С., Березкин П.Н., Ушакова А.А. химия. 8 класс: контрольные и проверочные работы к учебнику Габриелян О.С., химия 8 класс. – М.: Дрофа, 2007 .
Габриелян О.С., Воскобойников Н.П., Яшукова А.В. химия 8 класс. Настольная книга учителя. – М.: Дрофа, 2007 .
Учебное электронное издание химия (8 – 11 класс). Виртуальная лаборатория.
Приложение 1.
ЛИСТ РЕФЛЕКСИИ уч-ся 8 класса ______________________________________________
Оценочная таблица
| Теория по теме 3б | Выполнение диктанта 9б | Формулирование нового типа реакций 2б | Выбор верных утверждений (оценка товарища) 5б | Выбор реакций обмена среди предложенных (самооценка) 2б | Итого баллов за урок 21 б |
|
|
|
|
|
|
|
Примерная самооценка: 19-21б – «5», 16-18 б – «4», менее 16б – «3».
Рефлексия.
Что вы знали до начала урока? _____________________________________________________________________________________________________________
Что узнали нового? ___________________________________________________________________________________________________________________
Что умели? __________________________________________________________________________________________________________________________
Чему научились? _____________________________________________________________________________________________________________________
Что было интересного? ________________________________________________________________________________________________________________
Что вызвало затруднение и почему? _____________________________________________________________________________________________________
Что необходимо сделать, чтобы устранить незнание? ______________________________________________________________________________________
Выбери смайлик своего настроения после урока:
 удивление
удивление  усталость
усталость  нормальное
нормальное  хорошее
хорошее  отличное
отличное скучно
скучно обидно
обидно
Приложение 2
Образец для самопроверки (Диктант):
1) 3CuCl2 + 2Al = 2AlCl3 + 3Cu
2) Ca + 2 HCl = CaCl2 + H2
3) 2Ca + O2 = 2CaO (соединение)
4) Fe2O3 + 3Mg = 3MgO + 2Fe (замещение)
5) 2Al(OH)3 = Al2O3 + 3H2O (разложение)
6) Na2SO4 + 2KCl = K2SO4 + 2NaCl (???)
7) Соединение
8) Разложение
9) Замещение
Оценивание: максимум 9б за верно расставленные коэффициенты и указанные типы реакций.
Образец для проверки Верных утверждений:
- 1. Реакция обмена - это реакция между простыми и сложными веществами.
+ 2. Реакция обмена протекает между сложными веществами, которые обмениваются своими составными частями.
- 3. Реакция обмена идет до конца, только когда образуется вода.
+ 4. Реакция обмена идет до конца, когда образуется газ, осадок или вода.
- 5. Реакция обмена идет до конца, только когда образуется газ.
+ 6. Реакция между кислотой и основанием называется реакцией нейтрализации.
- 7.Любая реакция обмена является реакцией нейтрализации.
+ 8. HNO3 + NaOH → Na NO3 + H2O - это реакция обмена и нейтрализации.
+ 9. CuO + H2SO4 → CuSO4 + H2O - это реакция обмена.
- 10. Al2O3 + 6HCl → 2AlCl3 + 3H2O - это реакция нейтрализации.
Оценивание: все ответы верны – «5б», один неверный ответ – «4б», два неверных ответа – «3б». Выставите оценку в оценочную таблицу!
Образец для проверки: Среди предложенных реакций выбрать реакции обмена, и определить протекают ли они до конца.
| 1ученик | 2 ученик |
| а) CuO + H2 = Cu + H2O | а) NaCl + AgNO3 = AgCl + NaNO3 + да |
| б) 3K2CO3 + 2H3PO4 = 2K3PO4 + 3H2O + +3CO2 + да | б) CaO + H2O → Ca(OH)2 |
| в) MgCl2 + 2KNO3 = Mg(NO3)2 + 2KCl | в) Ca(OH)2 + 2HNO3 → Ca (NO3)2 + +2H2O + да |
| г) CaO + 2HCl → CaCl2 + H2O + да | г) 2FeCl2 + Cl2 →2 FeCl3 |
| д) 2H2O = 2H2 + O2 | д) 2NaOH + Li2SO4 =2 LiOH + Na2SO4 |
Приложение 3.
Маршрутная карта урока химия в 8 классе
Фамилия Имя____________________________________
Тема урока: ________________________________________________________________
Диктант:
Расставьте коэффициенты и определите тип реакции
1. Ca + O2 = CaO ______________________________
2. Fe2O3 + Mg = MgO + Fe ___________________________
3. Al(OH)3 = Al2O3 + H2O _____________________________
4. Na2SO4 + KCl = K2SO4 + NaCl __________________________
Вставьте пропущенное слово:
5. Реакции, в результате которых из нескольких исходных веществ образуется одно сложное вещество – это _____________________
6. Реакции, в результате которых из одного сложного вещества образуются два или несколько более простых веществ – это ______________________________
7. Это реакции, где атомы простого вещества замещают атомы одного из элементов в сложном веществе __________________________________.
Лабораторный опыт №1.
1. Возьмите пробирку
2. В пробирку налейте раствор гидроксида натрия (NaOH), добавьте к нему раствор соли сульфата меди (СuSO4).
3. Запишите, что наблюдаете? _________________________________________________
4. Составьте уравнение реакции:
____________________________________________________________________________
Лабораторный опыт №2.
Возьмите пробирку.
В пробирку налейте раствор гидроксида натрия (NaOH), добавьте к нему несколько капель фенолфталеина. Что наблюдаете? ______________________________________________________________________
Почему? ____________________________________________________________________
К полученному содержимому пробирки прилейте немного раствора серной кислоты (H2SO4).
Что наблюдаете? _______________________________________________________
Составьте равнение реакции: ______________________________________________________________________
Лабораторный опыт №3.
В пробирку нальем раствор карбоната натрия (Na2CO3).
Прильем раствор серной кислоты (Н2SO4).
Запишите, что наблюдаете? _____________________________________________
Составьте уравнение реакции:
______________________________________________________________________
Лабораторный опыт №4.
Возьмите пробирку.
В пробирку налейте раствор хлорида бария (BaCl2), добавьте к нему раствор гидроксида калия (КaOH)
Что наблюдаете?___________________________________________________________
Составьте равнение реакции: ______________________________________________________________________
Задаиие 1. Выберите верные утверждения.
1. Реакция обмена - это реакция между простыми и сложными веществами.
2. Реакция обмена протекает между сложными веществами, которые обмениваются своими составными частями.
3. Реакция обмена идет до конца, только когда образуется вода.
4. Реакция обмена идет до конца, когда образуется газ, осадок или вода.
5. Реакция обмена идет до конца, только когда образуется газ.
6. Реакция между кислотой и основанием называется реакцией нейтрализации.
7.Любая реакция обмена является реакцией нейтрализации.
8. HNO3 + NaOH → Na NO3 + H2O - это реакция обмена и нейтрализации.
9. CuO + H2SO4 → CuSO4 + H2O - это реакция обмена.
10. Al2O3 + 6HCl → 2AlCl3 + 3H2O - это реакция нейтрализации.
Обменяйтесь листами контроля и ваш сосед по парте проверит правильность выполнения задания.
Оценивание: все ответы верны – «5б», один неверный ответ – «4б», два неверных ответа – «3б». Выставите оценку в оценочную таблицу!
Задание 2. Среди предложенных реакций выбрать реакции обмена, и определить протекают ли они до конца.
| 1ученик | 2 ученик |
| а) CuO + H2 = Cu + H2O | а) NaCl + AgNO3 = AgCl + NaNO3 |
| б) 3K2CO3 + 2H3PO4 = 2K3PO4 + 3H2O + +3CO2 | б) CaO + H2O → Ca(OH)2 |
| в) MgCl2 + 2KNO3 = Mg(NO3)2 + 2KCl | в) Ca(OH)2 + 2HNO3 → Ca (NO3)2 + +2H2O |
| г) CaO + 2HCl → CaCl2 + H2O | г) 2FeCl2 + Cl2 →2 FeCl3 |
| д) 2H2O = 2H2 + O2 | д) 2NaOH + Li2SO4 =2 LiOH + Na2SO4 |
|
|
|
Оцените сами правильность выполненного задания. Оценивание: «2б» - выбраны все реакции обмена, протекающие до конца; «1б» - одна ошибка в выборе реакций обмена, протекающих до конца. Выставите оценку в оценочную таблицу!
14