Урок «Общие свойства металлов»
Цели:
Способствовать формированию компетенции общих свойствах металлов.
Задачи:
- обучающая: создать условия для получения учащимися знаний о положении металлов в периодической системе химических элементов Д.И. Менделеева, физических и химических свойствах металлов, нахождении в природе, основных способах получения и значимости металлов в жизни человека;
- развивающая: способствовать развитию у учащихся логического мышления, умения анализировать и сравнивать, работать с дополнительной информацией; создать условия для развития умения осознанно работать с источниками информации и с химическими терминами; способствовать развитию информационной культуры учащихся через показ возможностей программ Microsoft Word, Microsoft Power Point.
- воспитывающая: содействовать формированию представлений о причинно-следственных связях и отношениях, вырабатывать стремление к коллективизму, подвести учащихся к осознанию практической значимости металлов в жизни человека; формировать мировоззренческое понятие о познаваемости природы.
Тип урока: семинар приобретения новых знаний
Средства обучения:
Таблицы «Виды химической связи», коллекции металлов и сплавов; мультимедийный проектор, презентация урока.
Методы обучения:
Реализация целей в ходе урока осуществляется через систему таких методов и приемов, как совместное планирование будущей деятельности, работа с дополнительными источниками информации. Анализ предложенной информации для осуществления связи обучающимися, самостоятельная работа в группах, тестирование знаний с взаимоконтролем.
Планируемые результаты обучения: учащиеся должны знать понятие металлической связи и металлической кристаллической решетки, способы получения металлов, уметь давать общую характеристику металлов по их положению в периодической системе и строению атомов, объяснять физические свойства металлов исходя из строения металлической кристаллической решетки.
Организационный момент.
Актуализация знаний учащихся.
- какой раздел неорганической химии мы изучили? / неметаллы/
- что предстоит изучить / металлы /
Изучение нового материала.
Тема урока. «Общие свойства металлов»
(это первый урок раздела металлы), сформулируйте цель урока.
Цель урока. Изучить наиболее характерные общие свойства металлов.
В древности и в средние века было известно только семь металлов. Это число соотносилось с числом известных тогда планет: Солнце – золото, Юпитер – олово, Луна – серебро, Марс – железо, Меркурий – ртуть, Сатурн – свинец, Венера – медь. Алхимики считали, что под влиянием лучей планет в недрах Земли рождаются эти металлы. Поэтому они и говорили: «Семь металлов создал свет по числу семи планет».
- а сколько известно металлов?
- какими важными свойствами обладают металлы?
(на эти и другие вопросы мы должны дать ответ)
Составим план работы.
План работы:
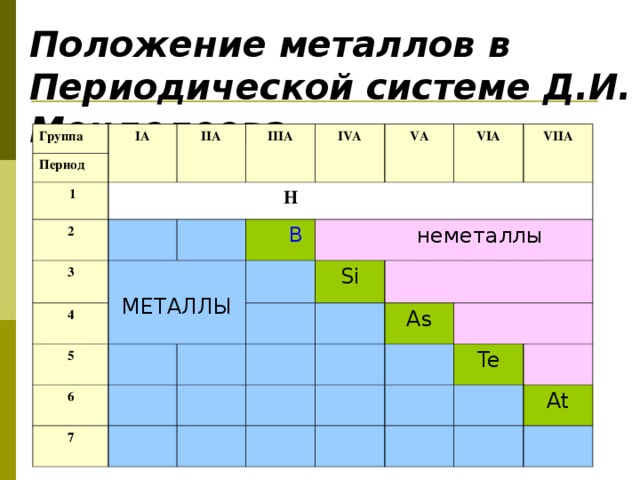
1. Рассмотреть положение металлов в периодической системе химических элементов Д.И. Менделеева и их строение атома.
2. Познакомиться с металлической связью.
3. Выяснить какими физическими и химическими свойствами обладают металлы.
4. Познакомиться с нахождение металлов в природе.
Сегодня на уроке на основании полученных знаний вам предстоит самостоятельно изучить общие свойства металлов.
Работа в группах
/Класс делится на 6 групп. В каждой группе выбирается старший ученик. Он в ходе совместной работы помогает находить требуемый материал по источникам информации, составлять уравнения реакций и предварительно оценивает работу каждого члена группы. Каждая группа получает задание и работает по нему в течение 10-минут. Учащиеся работают по учебнику и дополнительным источникам/
Группа № 1
Положение металлов в периодической системе химических элементов Д.И. Менделеева. Строение атома.
Какое место занимают металлы в периодической таблице химических элементов Д.И. Менделеева?
Постройте графические схемы и электронные формулы атомов натрия, магния, алюминия, укажите:
- какое количество электронов обычно находится на внешнем энергетическом уровне у металлов?
- укажите проявляемую валентность, степень окисления и окислительно-восстановительную способность атомов этих элементов.
- радиус у металлов.
3. Чем отличается строение атомов металлов от атомов неметаллов?
Литература: учебник Рудзитис Г.Е. Химия 9 класс, любая дополнительная литература.
Группа № 2
Металлические кристаллические решётки.
Строение кристаллических решеток металлов.
(использовать таблицу, модели кристаллических решёток)
Чем отличаются по строению кристаллические решетки металлов от
- ионных и атомных?
3. Какова сущность металлической связи?
4. В каких соединениях наблюдается металлическая связь?
Литература: учебник Рудзитис Г.Е. Химия 9 класс, любая дополнительная литература.
Группа № 3
Физические свойства металлов
Объясните физические свойства металлов, основываясь на представлениях о металлической связи.
(основные физические свойства записать на доске в виде схем)
Группа № 4
Химические свойства металлов
Какую роль играют металлы в окислительно-восстановительных процессах?
Приведите примеры химических реакций взаимодействие металлов с простыми веществами:
- а) с галогенами;
- б) с кислородом;
- в) с серой.
Литература: учебник Рудзитис Г.Е. Химия 9 класс, любая дополнительная литература.
Группа № 5
Химические свойства металлов (лабораторные опыты)
Металлы реагируют со сложными веществами:
1. Взаимодействие металлов с растворами кислот (опыт выполняет весь класс, повторить инструктаж при работе с едкими веществами).
К пробиркам с металлами магнием, цинком, алюминием и медью прилейте по 1 мл. раствора соляной кислоты. В пробирку Объясните происходящие процессы, используя знания о ряде напряжения металлов и о скорости химических реакций. Составьте уравнения происходящих реакций с учетом процессов отдачи и присоединения электронов, напишите их на доске и в тетради.
Вывод: все металлы стоящие до водорода, способны вытеснять его из растворов кислот. Исключением является азотная и конц. серная
2. Взаимодействие металлов с растворами солей.
В пробирку с раствором сульфата меди (II) положите железный гвоздь, а с раствором сульфата железа(II) – медную проволоку. Опишите происходящее в обеих пробирках. Чем объяснить эти явления? Составьте уравнения химических реакций.
Вывод: В электрохимическом ряду напряжения металл, стоящий левее, может вытеснить из растворов солей металл, стоящий правее.
3. Взаимодействие активных металлов с водой; (демонстрация опыта)
Составьте уравнения химических реакций.
Литература: учебник Рудзитис Г.Е. Химия 9 класс, любая дополнительная литература.
Меры предосторожности при работе с едкими веществами.
При наливании кислоты будьте осторожны! Пробирку и склянку держите над столом.
Держите склянку так, чтобы этикетка была повернута к ладони.
Если вы случайно польёте кислоту, обращайтесь к учителю.
Группа № 6
Нахождение металлов в природе
В виде каких соединений встречаются металлы в природе?
Выпишите на доске формулы природных соединений: калия, магния, хрома, цинка.
3. Презентация
Литература: учебник Рудзитис Г.Е. Химия 9 класс, любая дополнительная литература.
Оценочно-рефлексивный блок
В течение 10-15 минут идет обсуждение результатов работы в группах. От каждой группы выступают по 2-3 человека поочередно, делают требуемые записи на доске. В процессе выступления очередной группы члены других групп задают вопросы и делают краткие записи в своих тетрадях.
- Давайте проанализируем вашу работу в группах. (Слово предоставляется каждому старшему из 6 групп.)
- Какие вопросы мы сегодня рассмотрели на уроке?
- Какие из этих вопросов вам показались наиболее трудными?
- Какую оценку вы бы поставили себе за участие в работе групп?
(Оценка показывается учащимися с помощью цветовых сигналов: «красный»-отлично, «синий»-хорошо, «зеленый»-удовлетворительно). Поставьте эту оценку себе в тетрадь на полях.
- Чтобы увидеть, какие знания вы получили по теме «Общие свойства металлов», проведем тестирование.
V. Тестовый контроль знаний «Как я усвоил материал»
Вариант 1
1. Более яркими металлическими свойствами обладает:
1) натрий 2) магний 3) алюминий
2. В образовании металлической связи принимают участие…
3. Выберите наиболее тугоплавкий металл:
1) Al 2) Cu 3) W 4) Au
4. Установите соответствие:
Металлы Реакции с серной кислотой
1) платина а) выделяется водород из разбавленной кислоты
2) алюминий б) не идет
5. Из предложенных возможна реакция:
1) Mg + FeCl3 =
2) Cu + Al2(SO)4 =
3) Hg + CuSO4 =
Вариант 2
1. Более яркими металлическими свойствами обладает:
1) магний 2) алюминий 3) калий
2. В образовании металлической кристаллической решетки принимают
участие…
3. Выберите наиболее пластичный металл:
1) Al 2) Cu 3) W 4) Au
4. Установите соответствие:
Металлы Реакции с соляной кислотой
1) калий а) выделяется водород из разбавленной кислоты
2) медь б) не идет
5. Из предложенных возможна реакция:
1) Au + CuSO4 =
2) Al + FeCl3 =
3) Ag + Al2(SO)4 =З
Вариант 3
1. Более яркими металлическими свойствами обладает:
1) натрий 2) кальций 3) алюминий
2. В образовании металлической связи принимают участие…
3. Выберите металл с самой низкой температурой плавления:
1) Hg 2) Cu 3) W 4) Au
4. Установите соответствие:
Металлы Реакции с серной кислотой
1) медь а) выделяется водород из разбавленной кислоты
2) цинк б) не идет
5. Из предложенных возможна реакция:
1) Sn + Pb(NO3)2 =
2) Cu + Al2(SO)4 =
3) Hg + CuCl2 =
Вариант 4
1. Более яркими металлическими свойствами обладает:
1) магний 2) рубидий 3) алюминий
2. В образовании металлической кристаллической решетки принимают
участие…
3. Выберите наиболее твердый металл:
1) Al 2) Cu 3) Cr 4) Au
4. Установите соответствие:
Металлы Реакции с соляной кислотой
1) серебро а) выделяется водород из разбавленной кислоты
2) кальций б) не идет
5. Из предложенных возможна реакция:
1) Ag + CuCl2 =
2) Zn + FeCl3 =
3) Ag + Al2(SO)4 =
Самопроверка (ответы теста на слайде)
Ответы
| 1 – В | 2 - В | 3 – В | 4 - В |
| 1- 1 2- атомы, ионы, свободные ē 3-3 4.1-б 2-а 5-1 | 1-3 2-атомы, ионы, свободные ē 3-4 4.1-а 2-б 5-2 | 1-1 2-атомы, ионы, свободные ē 3-1 4.1-б 2-а 5-1 | 1-2 2-атомы, ионы, свободные ē 3-3 4.1-б 2-а 5-2 |
Слайд
Критерии оценивания:
«5»-0 ошибок.
«4»-1.
«3»-2.
«2»-3 и больше.
Домашнее задание.
§ 34-37 упр.2-3 стр.112
По желанию найти дополнительную информацию о применении металлов и их сплавов, сделать презентацию по этой теме.
Учитель:
- что нового вы узнали о металлах, их свойствах?
- пригодиться вам приобретенные знания о металлах в вашей жизни?