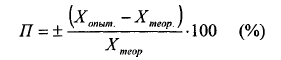методические рекомендации для выполнения практических и лабораторных работ для выполнения практикума по химии в группе "Механизация сельского хозяйства". пособие содержит подробные указания для выполнения работ студентами.а также материал для самостоятельной подготовки студентов к выполнению работ
- Меню
- Главная
- Дошкольное образование
- Начальные классы
- Астрономия
- Биология
- География
- Информатика
- Математика
- Алгебра
- Геометрия
- Химия
- Физика
- Русский язык
- Английский язык
- Немецкий язык
- Французский язык
- История
- Естествознание
- Всемирная история
- Всеобщая история
- История России
- Право
- Окружающий мир
- Обществознание
- Экология
- Искусство
- Литература
- Музыка
- Технология (мальчики)
- Технология (девочки)
- Труд (технология)
- Физкультура
- ИЗО
- МХК
- ОБЗР (ОБЖ)
- Внеурочная работа
- ОРК
- Директору
- Завучу
- Классному руководителю
- Экономика
- Финансовая грамотность
- Психологу
- ОРКиСЭ
- Школьному библиотекарю
- Логопедия
- Коррекционная школа
- Всем учителям
- Прочее
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Методические рекомендации для выполнения практических и лабораторных работ
Просмотр содержимого документа
«методические рекомендации для выполнения практических и лабораторных работ »
Государственное бюджетное образовательное учреждение
среднего профессионального образования
«Комаричский механико-технологический техникум»
МЕТОДИЧЕСКИЕ
РЕКОМЕНДАЦИИ
ДЛЯ СТУДЕНТОВ ПО ВЫПОЛНЕНИЮ
ПРАКТИЧЕСКИХ ЗАНЯТИЙ И ЛАБОРАТОРНЫХ РАБОТ
ДИСЦИПЛИНА ОДБ.06 «ХИМИЯ»
общеобразовательного цикла
специальности: Механизация сельского хозяйства
ДЛЯ СТУДЕНТОВ ОЧНОЙ ФОРМЫ ОБУЧЕНИЯ
П. Комаричи, 2015 г
Составитель: Кащеева Ольга Викторовна, преподаватель государственного бюджетного образовательного учреждения среднего профессионального образования «Комаричский механико-технологический техникум»
Методические рекомендации для выполнения практических занятий и лабораторных работ являются частью основной профессиональной образовательной программы государственного бюджетного образовательного учреждения среднего профессионального образования «Комаричский механико-технологический техникум» по специальностям СПО 110809 Механизация сельского хозяйства в соответствии с требованиями ФГОС СПО.
Методические указания по выполнению практических занятий и лабораторных работ адресованы студентам очной формы обучения.
Методические указания включают в себя учебную цель, перечень образовательных результатов, заявленных во ФГОС СПО, задачи, обеспеченность занятия, краткие теоретические и учебно-методические материалы по теме, вопросы для закрепления теоретического материала, задания для практического занятия или лабораторной работы студентов и инструкцию по ее выполнению, методику анализа полученных результатов, порядок и образец отчета о проделанной работе.
СОДЕРЖАНИЕ
| Название практических занятий и лабораторных работ |
| 1.Расчет по химическим формулам 2.Моделирование построения Периодической таблицы химических элементов. 3. Изготовление моделей простых и сложных веществ, кристаллических решеток. 4. Приготовление и изучение свойств суспензий, эмульсий,золей,гелей.Коагуляция
5. Приготовление раствора заданной концентрации.
6. Испытание растворов индикаторами. 7. Решение задач по неорганической химии. Составление реакций ионного обмена. 8. Решение экспериментальных задач. 9. Свойства металлов. 10. Составление моделей молекул органических соединений 11.Качественное определение углерода, водорода в органических соединениях 12.Решение экспериментальных задач на получение органических веществ и изучение их свойств( Получение и свойства карбоновых кислот. Синтез бромэтана из спирта.) 13. Решение задач на распознавание пластмасс и волокон 14. Решение задач на распознавание органических веществ |
УВАЖАЕМЫЕ СТУДЕНТЫ!
Содержание этого учебного блока направлено на достижение следующих целей химического образования:
овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, оценки роли химии в развитии современных технологий и получении новых материалов;
развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием эксперимента;
воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
При выполнении данного вида работ Вы должны освоить экспериментальные основы химии. В частности:
Правила безопасности при работе с едкими, горючими и токсичными веществами.
Проведение химических реакций в растворах.
Проведение химических реакций при нагревании.
Качественный и количественный анализ веществ.
Определение характера среды.
Индикаторы.
Качественные реакции на неорганические вещества и ионы.
Отдельные классы органических соединений.
Данные методические указания предназначены для закрепления теоретических знаний и приобретения необходимых практических навыков и умений по программе дисциплины ОДБ.06 "Химия" для специальности «Механизация сельского хозяйства».
В сборнике содержатся методические указания по выполнению лабораторных работ и практических занятий, указанных в содержании.
Требования к знаниям и умениям при выполнении
лабораторных работ и практических занятий
При выполнении лабораторных работ и практических занятий студент должен:
Знать:
– основные классы неорганических соединений и их свойства, строение атома, типы химических реакций и связей, Теорию электролитической диссоциации, Периодический закон и Периодическую систему химических элементов Д. И. Менделеева;
– Теорию химического строения органических соединений А. М. Бутлерова, названия представителей гомологических рядов органических соединений, их строение, свойства и, способы получения;
– Правила по технике безопасности при работе в химической лаборатории.
Уметь:
– проводить реакции ионного обмена и качественные реакции ионов, определять реакцию среды растворов солей;
– охарактеризовывать свойства металлов на основании их положения в Периодической системе химических элементов Д. И. Менделеева, строения атомов в электрохимическом ряду напряжений металлов;
– проводить реакции лабораторных способов получения углеводородов: метана и этилена, альдегидов, карбоновых кислот и сложных эфиров;
– распознавать органические вещества (изученные по программе) на основе их строения и свойств;
– описывать свойства органических веществ, составлять уравнения реакций.
Правила выполнения лабораторных работ и практических занятий
1. Студент должен прийти на лабораторное занятие подготовленным по данной теме.
2. Каждый студент должен знать правила по технике безопасности при работе в химической лаборатории (и при работе с реактивами в данной работе).
3. После проведения работы студент представляет письменный отчет.
4. До выполнения лабораторной работы у студента проверяют знания по выявлению уровня его теоретической подготовки по данной теме.
5. Отчет о проделанной работе следует выполнять в рабочей тетради в клетку. Содержание отчета указано в описании лабораторной работы или практического занятия.
6. Таблицы и рисунки следует выполнять карандашом, записи – синим или чёрным цветом пасты или чернил. Рисунки выполняются в левой половине листа, наблюдения и выводы в правой части листа. Уравнения реакций записываются во всю строку (после наблюдений и выводов).
7. Зачет по данной лабораторной работе или практическому занятию студент получает при положительных оценках за теоретические знания и отчет по лабораторной работе или практическому занятию, общий зачет – при наличии зачетов по всем лабораторным работам и практическим занятиям.
ПРАВИЛА РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
ОБЩИЕ ПРАВИЛА РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
Лабораторные работы и некоторые практические занятия проводят в специально оборудованной химической лаборатории.
При работе в лаборатории необходимо знать и строго соблюдать установленные правила.
Работать разрешается только после ознакомления с правилами по технике безопасности и правилами работы в химической лаборатории.
1. Рабочее место содержите в чистоте и порядке, не загромождайте его посторонними предметами.
2. Не допускайте попадания химических реактивов на кожу и одежду. Нельзя брать вещества руками и пробовать на вкус
3. Не уносите на свои рабочие места реактивы общего пользования. Если нет указаний по дозировке реактивов для данного опыта, то берите их в минимальном количестве.
4. Запрещается пользоваться реактивами без этикеток или с сомнительными этикетками.
5. Во всех опытах используйте дистиллированную воду. Сухие реактивы берите только чистым шпателем. Не путайте пробки от склянок с различными реактивами. Излишки реактивов не высыпайте и не выливайте в склянки, из которых они взяты.
6. Особую осторожность соблюдайте при работе ядовитыми и вредными веществами, с концентрированными кислотами и щелочами. Работать с ними следует в вытяжном шкафу.
7. При нагревании жидкости в пробирке необходимо держать ее так, чтобы в случае разбрызгивания жидкость не попала на самого экспериментатора и рядом работающих студентов, т.е. отверстие пробирки должно быть направлено в сторону от себя и товарищей. Лучше всего направить его на стенку вытяжного шкафа. Не забывайте пользоваться при этом держателем.
8. После опытов остатки реактивов сливайте в раковину после разбавления водой. Металлы собирайте в отведенную для этого склянку. Остатки агрессивных и дорогостоящих реактивов собирайте в специальные склянки.
9. Не трогайте, не включайте и не выключайте без разрешения рубильники и электрические приборы.
10. В лаборатории соблюдайте тишину, не занимайтесь посторонними делами, не проводите опыты, не относящиеся к данной лабораторной работе или практическому занятию и не описанные в методическом указании.
Студентам следует заранее готовиться к лабораторной работе или практическому занятию. Выполнению лабораторной работы или практического занятия предшествует собеседование с преподавателем. Подготовку рекомендуется начинать с изучения теоретического материала, относящегося к данной работе. Необходимо твердо усвоить основные теоретические положения, законы и их математические выражения.
Перед выполнением работы следует ознакомиться с методикой проведения эксперимента, изучить принцип действия приборов и установок, понять цель работы. При выполнении лабораторной работы или практического занятия внимательно следите за ходом опыта. В случае неудачной постановки опыта, прежде чем его повторить, установите причину неудачи. После окончания работы необходимо вымыть посуду, привести в порядок рабочее место.
За чистоту и порядок на рабочем месте отвечает студент, а в лаборатории - дежурный студент. Дежурный принимает рабочее место у студентов, закончивших выполнение лабораторной работы или практического занятия, и сдает лабораторию лаборанту. Кроме того, дежурный студент должен получить у лаборанта все необходимое для проведения данной лабораторной работы или практического занятия, а после окончания работы или занятия - сдать. После выполнения лабораторной работы или практического занятия студент должен оформить отчет и сдать его преподавателю.
Отчет должен содержать следующие сведения:
1. Название работы или занятия.
2. Цель работы или занятия.
3. Ответы на контрольные вопросы
4. Номер и название опыта.
5. Краткое описание хода работы или занятия с указанием условий проведения опыта.
6. Рисунки и схемы используемых приборов.
7. Наблюдения и уравнения реакций.
8. Расчеты, таблицы, графики.
9. Вывод.
Если в лабораторных работах или практических занятиях необходимо проводить расчёты, следует иметь в виду, что излишняя точность в расчетах, значительно превышающая экспериментальную погрешность, не повышает точность результата. Для числовых значений рассчитываемых величин достаточно 3-4 значащие цифры (число знаков, стоящих после предшествующих им нулей). Число значащих цифр не следует путать с числом знаков после запятой. Так в числах: 101,3; 21,73; 0,4385; 0,004500 имеется четыре значащих цифры. В расчетах принято указывать значащие цифры и в том случае, когда это нули, стоящие в конце числа. Поэтому правильной будет запись с точностью до четвертой значащей цифры - 0,2500, а не 0,25.
Результаты измерений неизбежно будут отклоняться от истинных значений соответствующих величин. Для определения ошибки необходимо получить 4-5 параллельных результатов измерений и найти среднее арифметическое значение, которое будет больше всего приближаться к истинному значению.
При обработке результатов следует определять абсолютную и относительную ошибку измерения данной величины.
| Абсолютная ошибка показывает, на сколько данная измеряемая величина больше или меньше истинной величины |
|
| Отношение абсолютной ошибки к истинной величине, умноженное на 100 %, дает относительную ошибку определения (в процентах) или погрешность: |
|
ЛАБОРАТОРНАЯ ХИМИЧЕСКАЯ ПОСУДА
В химической лаборатории очень часто приходится работать с посудой из стекла и фарфора. Лабораторную посуду можно подразделить на следующие виды:
1. Посуду общего назначения;
2. Посуду специального назначения;
3. Мерную посуду;
4. Фарфоровую посуду.

Посуда общего назначения
Пробирки (рис.1.) используют для проведения химических опытов с небольшим количеством веществ. Пробирки могут быть цилиндрические и конические. Хранят пробирки в штативах. Перемешивание веществ в них проводят встряхиванием пробирки, нанося небольшой удар пальцем по нижней части пробирки. Моют пробирки с помощью ерша.
Колбы (рис.2.) бывают разной вместимости (от 1-2 литров до 25 миллилитров) и разной формы: плоскодонные, круглодонные, конические, колбы Вюрца.
Стаканы (рис.3.) могут быть разной вместимости (от 1 литра до 25 миллилитров), разной формы, разные по высоте и ширине, термостойкие и нетермостойкие.
Воронки (рис.4.) бывают различной формы и размеров, и в зависимости от этого имеют разное назначение.
1.2.2. Посуда специального назначения
Эксикаторы (рис.5.) применяют для хранения веществ, легко поглощающих влагу, и для высушивания веществ. Для этого в нижнюю часть эксикатора помещают вещества, которые способны поглощать воду: СаCl2 (безводный), H2SO4 (концентрированная), Р2О5.
Промывные склянки (рис.6.) используют для промывания, очистки и высушивания газов.
1.2.3. Мерная посуда
Мерная посуда (рис.7.) - мерной называют посуду, применяемую для измерения объема жидкости с разной точностью.
Для измерения объема с небольшой точностью применяют мерные цилиндры и мензурки.
Для точного измерения объема жидкости используют пипетки, бюретки и мерные колбы.
Мерная посуда может быть разной вместимости. В зависимости от объема, который должен быть измерен, подбирается посуда соответствующей вместимости. Мерная посуда градуируется в миллилитрах (мл.) или литрах (л). 1 мл соответствует 1 см3, а 1 л - 1 дм3.
При измерении объема жидкости мерный сосуд необходимо держать в вертикальном положении, а отсчёты вести по нижней части вогнутой поверхности мениска жидкости. Причем глаз наблюдателя должен находиться на одной горизонтальной линии с нижним краем мениска (рис.8.).
Пипетки (рис.7.) используют для отмеривания и переноса, точно определенного объема жидкости. Обыкновенная пипетка представляет собой стеклянную трубку небольшого диаметра с расширением посередине или без него, если пипетка небольшой вместимости (от 0,1 до 2-5 мл). Нижний конец пипетки оттянут в капилляр, а на верхнем конце имеется метка, до которой набирают жидкость. Для отмеривания необходимого объема жидкости нижний конец пипетки, соответствующей вместимости, опускают в жидкость до дна сосуда и с помощью груши (или рта, если раствор не опасен) набирают жидкость, следя за тем, чтобы кончик пипетки все время находился в жидкости. Жидкость набирают выше метки на 2-3 см, затем быстро закрывают верхнее отверстие указательным пальцем, придерживаю пипетку большим и средним пальцами. Затем, слегка ослабив нажим указательного пальца, дают жидкости медленно вытекать из пипетки. Как только нижний мениск жидкости дойдет до метки, палец снова плотно прижимают к верхнему отверстию пипетки. Таким образом, с помощью пипетки отбирается необходимый объем жидкости. Затем пипетку вводят в колбу (или стакан), в которую нужно перенести жидкость, отнимают указательный палец от верхнего отверстия пипетки и дают жидкости стечь по стенке колбы. Оставшуюся при этом жидкость в пипетке не выдувают, так как объем пипетки рассчитан на свободное истечение жидкости.
Бюретки (рис.7.) применяют при титровании или для того, чтобы отмерить объем жидкости с точностью до 0,05 мл. Бюретка – стеклянная градуированная трубка, нижний конец которой оттянут и на него надета резиновая трубка со стеклянным шариком. Могут быть и бюретки с притертым стеклянным краном.
Перед началом работы бюретки закрепляют в штативе. Заполняют бюретку жидкостью сверху через воронку так, чтобы внутри находился раствор без пузырьков воздуха. Для удаления пузырьков воздуха резиновую трубку изгибают таким образом, чтобы кончик капилляра был направлен вверх, и вытесняют жидкостью весь воздух. Затем бюретку заполняют до нулевой отметки.
Мерные колбы (рис.7.) используют для приготовления растворов точной концентрации. Для этого в колбу вносят точную навеску сухого вещества или рассчитанный объем исходного раствора. Затем до половины объема колбы наливают дистиллированную воду. Раствор тщательно перемешивают и доливают дистиллированную воду до метки, (последние 1-2 мл лучше по каплям с помощью пипетки). Потом плотно закрывают колбу пробкой и тщательно перемешивают раствор, переворачивая колбу несколько раз.
1.2.4. Фарфоровая посуда
К фарфоровой посуде относят тигли, чашки, ступки, кружки, стаканы и т. д. (рис. 9). Чашки и тигли используют для выпаривания жидкостей и прокаливания твердых веществ. Они выдерживают температуру выше 1000°С. для измельчения твердых веществ используют ступки.
1.3. ПЕРВАЯ ПОМОЩЬ ПРИ НЕСЧАСТНЫХ СЛУЧАЯХ
В лаборатории бывают случаи, требующие неотложной медицинской помощи, - порезы рук стеклом, ожоги горячими предметами, кислотами, щелочами. В особо серьезных случаях необходимо обратиться к врачу.
Для оказания первой помощи в лаборатории имеется аптечка.
1. При ранении стеклом удалите осколки из раны, смажьте края раны раствором йода и перевяжите бинтом.
2. При ожоге рук или лица реактивом смойте реактив большим количеством воды, затем либо разбавленной уксусной кислотой (в случае ожога щелочью), либо раствором соли (в случае ожога кислотой), а затем опять водой.
3. При ожоге горячей жидкостью или горячим предметом обожженное место обработайте свежеприготовленным раствором перманганата калия, смажьте обожженное место мазью от ожога или вазелином. Можно присыпать ожог содой и забинтовать.
4. При химических ожогах глаз обильно промойте их водой, используя глазную ванночку, а затем обратитесь к врачу.
ЧТОБЫ ОПЫТ ПОЛУЧИЛСЯ…
…ознакомьтесь с каждым пунктом правил и старайтесь точно их выполнять.
В химический кабинет заходите только после того, как разрешит преподаватель. Не трогайте и не переставляйте на столе приготовленные реактивы и оборудование – это может затруднить вашу дальнейшую работу.
Прежде чем приступить к выполнению химических опытов, обязательно изучите описание лабораторной работы или практического занятия и внимательно выслушайте объяснения преподавателя. Проверьте, все ли необходимое для работы есть на вашем столе.
В ходе выполнения работы координируйте свои действия с действиями группы. Разговаривайте шепотом, чтобы не мешать работать другим. Если возникнут какие-либо затруднения, которые вы не можете разрешить самостоятельно, обратитесь за помощью к преподавателю.
Вещества берите только шпателем или ложечкой и в тех количествах, которые указаны в описании работы; если таких указаний нет, то объемы веществ не должны превышать 1 мл. (3-4 капли).
Чтобы не перепутать пробки, не открывайте одновременно несколько склянок.
Если вы случайно взяли вещества больше, чем нужно для данного опыта, лишнее вылейте в специальную склянку для слива веществ или, если вещество твердое, отсыпьте в коробку для мусора.
В химической лаборатории (кабинете) очень важно быть предельно аккуратным во всем – тут нет мелочей. Прежде чем начать работать руками, продумайте, как разместить оборудование на столе, чтобы было удобно, и работать, и наблюдать за ходом эксперимента.
Не забывайте, что за этим же столом с этими же реактивами и оборудованием будут работать студенты других групп, - не создавайте им дополнительных трудностей, оставив свое рабочее место в беспорядке.
Введение
Методические указания по дисциплине «ХИМИЯ» для выполнения практических занятий и лабораторных работ созданы Вам в помощь для работы на занятиях, подготовки к практическим занятиям и лабораторным работам, правильного составления отчетов.
Приступая к выполнению практического занятия или лабораторной работы, Вы должны внимательно прочитать цель и задачи занятия или работы, ознакомиться с требованиями к уровню Вашей подготовки в соответствии с федеральными государственными стандартами третьего поколения (ФГОС-3), краткими теоретическими и учебно-методическими материалами по теме практического занятия или лабораторной работы, ответить на вопросы для закрепления теоретического материала.
Все задания к практическому занятию или лабораторной работе Вы должны выполнять в соответствии с инструкцией, анализировать полученные в ходе занятия результаты по приведенной методике.
Отчет о практическом занятии или лабораторной работе Вы должны выполнить по приведенному алгоритму, опираясь на образец.
Наличие положительной оценки по практическим занятиям и лабораторным работам необходимо для получения зачета по дисциплине «Химия» и допуска к дифференцированному зачёту, поэтому в случае отсутствия на уроке по любой причине или получения неудовлетворительной оценки за практическое занятие или лабораторную работу Вы должны найти время для ее выполнения или пересдачи.
Внимание! Если в процессе подготовки к практическим занятиям или лабораторным работам или при решении задач у Вас возникают вопросы, разрешить которые самостоятельно не удаётся, необходимо обратиться к преподавателю для получения разъяснений или указаний в дни проведения дополнительных занятий.
Время проведения дополнительных занятий можно узнать у преподавателя.
Желаем Вам успехов!!!
Раздел 1. Общая и неорганическая химия.
Тема: «Основные понятия и законы химии».
Название практического занятия №1 «Расчёты по химическим формулам».
Учебная цель: формировать умение производить расчёты по химическим формулам.
Учебные задачи:
Научиться пользоваться алгоритмом решения задач.
Уметь грамотно оформлять и решать задачи.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен:
иметь практический опыт: применения основных законов химии при решение задач;
знать: основные законы химии;
уметь: выполнять расчёты по химическим формулам;
владеть: навыками работы с калькулятором.
Задачи практического занятия:
Повторить теоретический материал по теме практического занятия.
Ответить на вопросы для закрепления теоретического материала.
Выполнить задания по теме.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Таблица «Периодическая система химических элементов Д.И. Менделеева».
Тетрадь для практических занятий и лабораторных работ в клетку.
Карточки – задания.
Калькулятор.
Ручка.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Химическая формула – это выражение состава (качественного и количественного) вещества при помощи химических знаков и индексов.
Молярная масса (М) – величина, равная отношению массы вещества (m) к соответствующему количеству вещества (n). М = m : n (г/моль)
Количество вещества (n) - это число структурных частиц этого вещества (атомов, молекул, электронов, ионов и др.), заключённых в данном образце.
n = N : NA = N : 6,02 * 1023(моль)
n = m : M (моль) → m = n * M (гр.)
n = v : VМ = v : 22,4 (моль)
В Международной системе единиц (Си) за единицу количества вещества принят моль.
Моль – количество вещества, которое содержит столько частиц (атомов, молекул, ионов и др.) сколько содержится атомов углерода в 0,012 кг. (12г.) 126С, примерно 6*1023 частиц.
Величина 6*1023 моль-1 относиться к фундаментальным физическим постоянным и называется постоянной Авогадро (NА). NA = n * 6,02 * 1023(молекул)
Молярный объём газа – величина равная отношению объёма (v) вещества к количеству (n) этого вещества: VM = V : n → V = n * VМ (л.)
Относительная плотность одного газа по другому (D) – это отношение плотностей двух газов при одинаковых условиях.
Относительная плотность одного газа по другому равна отношению их молекулярных или относительных молекулярных масс.
Относительная плотность – величина безразмерная – показывает, во сколько раз один газ тяжелее другого.
D(H2) = M (X) : M (H2) = M (X) :2; D(воздуху) = M (X) : M (воздуха) = M (X) : 29
Вопросы для закрепления теоретического материала к практическому занятию
Какую информацию даёт формула СО2?
Сформулируйте основные положения атомно – молекулярного учения.
Какие величины могут находиться рядом с химическим знаком?
Приведите примеры простых веществ и назовите их формулы.
Приведите примеры сложных веществ и назовите их формулы.
Сформулируйте законы: постоянства состава вещества, сохранения массы вещества, Авогадро.
Задания для практического занятия:
Произведите расчёты согласно заданиям в карточке.
Инструкция по выполнению практического занятия
Напишите молекулярную формулу указанного вещества.
Используя таблицу «Периодическая система химических элементов Д.И. Менделеева», вычислите молекулярную массу указанного вещества.
Определите количество вещества в данной порции газа.
Вычислите массу данного вещества.
Вычислите объём данного вещества.
Определите число частиц, содержащихся в данной порции газа.
Определите плотность газа по водороду.
Определите плотность газа по воздуху.
Методика анализа результатов, полученных в ходе практического занятия
Заполните известные Вам пункты плана из инструкции.
Найдите неизвестные данные.
Вычисления производите в Международной системе единиц (Си).
Порядок выполнения отчёта по практическому занятию
В тетради для практических занятий и лабораторных работ напишите номер, название и
учебную цель занятия.
Ответьте на вопросы для закрепления теоретического материала к практическому занятию.
Запишите условие Задания № 1 и произведите расчёты по плану инструкции по выполнению
практического занятия с учётом методики анализа результатов, полученных в ходе
выполнения задания № 1.
Выполните Задания № 2, 3, 4, 5.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с учебными задачами практического занятия и реализованы ли образовательные результаты, заявленные во ФГОС третьего поколения.
Образец отчёта по практическому занятию
Практическое занятие №1 «Расчёты по химическим формулам».
Учебная цель: формировать умение производить расчёты по химическим формулам.
Ответы на вопросы для закрепления теоретического материала
к практическому занятию
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
Задание №1 Диоксид углерода, н.у., 4 моль
СО2 (по условию)
М(СО2) = М(С) + М(О)*2 = 12 + 16*2 = 44г/моль
n(CO2) = 4 моль (по условию)
m(CO2) = n*M = 4*44 = 176 г.
v(CO2) = n*Vm = 4*22,4 = 89,6 л.
N = n* NA = 4*6,02*1023 = 24,08 молекул
D(H2) = М(СО2) : M(H2) = 44 : 2 = 22
D(воз.) = М(СО2) : M(воз.) = 44 : 29 = 1,5
Задания № 2, 3, 4, 5 выполняются и записываются согласно инструкции по выполнению практического занятия с учётом методики анализа результатов, полученных в ходе выполнения задания № 2, 3, 4, 5.
Вывод: Выполнив задания практического занятия я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2011.
Тема «Периодический закон и периодическая система химических элементов Д.И. Менделеева».
Практическая работа №2
Моделирование построения Периодической системы (таблицы) элементов.
Учебная цель: формировать умения работать с периодической системой Д. И. Менделеева, учить выявлять законы по таблице элементов.
Учебные задачи:
Научиться видеть, что Периодическая таблица химических элементов – графическое отображение периодического закона.
Рассмотреть структуру периодической таблицы: периоды (малые и большие), группы (главная и побочная).
Уметь определять строение электронных оболочек атомов элементов малых периодов и особенности строения электронных оболочек атомов элементов больших периодов (переходных элементов) по положению химического элемента в Периодической системе.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: составления схем строения атомов химических элементов по
предложенному образцу;
знать: закон периодичности;
уметь: применять знания о законе периодичности при составлении схем строения атомов химических элементов на практике;
владеть: навыками работы с таблицей: «Периодическая система химических элементов Д.И. Менделеева».
Задачи практического занятия:
1. Повторить теоретический материал по теме практического занятия.
2. Ответить на вопросы для закрепления теоретического материала.
3. Определить местоположение химического элемента в таблице «Периодическая система химических элементов Д.И. Менделеева».
4. Составить электронные и электронно – графические схемы строения атомов химических элементов.
5. Оформить отчет.
Обеспеченность занятия (средства обучения)
1. Таблица «Периодическая система химических элементов Д.И. Менделеева».
2. Тетрадь для практических занятий и лабораторных работ в клетку.
3. Ручка.
4. Простой карандаш.
5. Линейка.
6. Карточки размером 6х10 см для элементов с порядковыми номерами с 1-го по 20 –й в Периодической системе Менделеева
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Периодическая система – это графическое изображение закона периодичности.
Сведения, которые можно получить о каждом элементе из периодической таблицы элементов: порядковый (атомный номер), символ элемента, название элемента, относительная атомная масса, распределение электронов по слоям.
Порядковый номер = Численный заряд ядра = Число протонов = Число электронов
Основными структурными единицами системы элементов являются период и группа.
Период – это горизонтальный ряд элементов, в котором имеет место закономерное изменение свойств элементов от типично металлических к типично неметаллическим и далее к благородным газам.
Номер периода = Число заполненных электронных слоёв = Номер внешнего электронного слоя
В таблице семь периодов. В 1-м периоде всего два элемента. Во 2-м и 3-м периодах содержится по восемь элементов. Это малые периоды. Затем идут большие периоды: в 4-м и 5-м периодах – восемнадцать элементов, в 6-м – тридцать два элемента, а в 7-м (последнем) пока известно двадцать восемь химических элементов.
В системе 10 рядов. Малые периоды состоят из одного ряда. Большие периоды – из двух рядов: верхний ряд – чётный, нижний – нечётный.
Группы периодической системы (вертикальные столбцы) содержат элементы, свойства которых подобны. Каждая группа состоит из двух подгрупп: главной и побочной.
Подгруппы, в которые входят элементы малых и больших периодов, называются главными.
Подгруппы, в которые входят элементы только больших периодов, называются побочными.
Элементы, имеющие одинаковое число внешних электронов, стоят в одной и той же группе.
Номер группы = Число внешних электронов
Правила написания электронной формулы
1.Число электронных слоёв в атоме определяется номером периода, в котором находится элемент.
2.Число электронов на внешнем уровне для элементов главных подгрупп равно номеру группы.
3.У атомов элементов побочных подгрупп сначала заполняется предвнешний уровень, а затем снова внешний.
Вопросы для закрепления теоретического материала к практическому занятию:
Сформулируйте закон периодичности.
Почему число элементов в периодах соответствует ряду чисел 2-8-18-32?
На основе теории строения атомов поясните, почему группы элементов разделены на главные и побочные.
По каким признакам различают s-; p-; d-; f-элементы?
Почему численное значение валентности не всегда совпадает с числом электронов на наружных энергетических уровнях?
Задания для практического занятия
В карточке указаны химические элементы, определите их положение в Периодической системе и составьте схемы строения их атомов по предложенному образцу.
Инструкция по проведению практической работы:
Заготовьте 20 карточек размером 6 х 10 см для элементов с порядковыми номерами с 1-го по 20 –й в Периодической системе Менделеева. На каждую карточку запишите следующие сведения об элементе:
- химический символ
- название
- значение относительной атомной массы
- формулу высшего оксида (в скобках укажите характер оксида- основный, кислотный или амфотерный)
- формулу высшего гидроксида (для гидроксидов металлов также укажите в скобках характер - основный или амфотерный)
- формулу летучего водородного соединения (для неметаллов).
Расположите карточки по возрастанию значений относительных атомных масс.
Расположите сходные элементы, начиная с 3-го по 18-й друг под другом. Водород и калий над литием и под натрием соответственно, кальций под магнием, а гелий над неоном. Сформулируйте выявленную вами закономерность в виде закона.
Поменяйте в полученном ряду местами аргон и калий. Объясните почему.
Еще раз сформулируйте выявленную вами закономерность в виде закона.
Порядок выполнения отчёта по практическому занятию
В тетради для практических занятий и лабораторных работ напишите номер, название и
учебную цель занятия.
Ответьте на вопросы для закрепления теоретического материала к практическому занятию.
Запишите вывод о проделанной работе, отразите успешно ли Вы справились с учебными задачами практического занятия и реализованы ли образовательные результаты, заявленные во ФГОС третьего поколения.
Образец отчёта по практическому занятию
Практическое занятие №2 «Моделирование периодической системы ».
Учебная цель: формировать умение работать с таблицей «Периодическая система химических элементов Д.И. Менделеева».
Ответы на вопросы для закрепления теоретического материала
к практическому занятию
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
……………………………………………………………………………………………………
Вывод: Выполнив задания практического занятия я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2011
Тема: «Строение вещества».
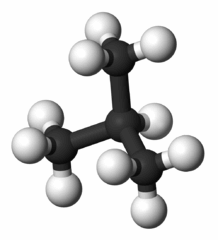
Название лабораторной работы № 3 «Изготовление моделей молекул простых и сложных веществ. кристаллических решеток»
Учебная цель: закрепить знания о строении веществ. имеющих кристаллические решетки.
Учебные задачи: .
Закрепить знания о структуре вещества.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: составления уравнений химических реакций в молекулярном и ионном виде;
уметь: работать в лаборатории с соблюдением правил ТБ;
знать: классификацию веществ, строение, типы решеток;
владеть: навыками экспериментальной работы при работе в кабинете химии.
Задачи лабораторной работы:
Повторить теоретический материал по теме лабораторной работы.
Ответить на вопросы для закрепления теоретического материала.
Провести эксперимент, соблюдая правила техники безопасности.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Пластилин, спички или шаростержневые наборы
Краткие теоретические и учебно-методические материалы
по теме лабораторной работы
Химические свойства оснований: Молекулы или кристаллические решетки простых веществ образованы атомами одного химического элемента. В состав сложных веществ входят атомы разных химических элементов. Не следует путать сложные вещества со смесями. Смеси состоят из нескольких разных веществ.
Примерами простых веществ являются куски чистых металлов (железо, медь, свинец и т. д.), газы, образованные одинаковыми атомами (кислород - O2, водород - H2, азот - N2 и т. д.), жидкий бром, твердые уголь, йод, сера и т.д.
Для простых веществ может быть характерна аллотропия. Это явление, при котором разные простые вещества образуются из атомов одного и того же химического элемента. Например, кислород (O2) и озон (O3), алмаз и графит (имеют различное строение кристаллической решетки из атомов углерода C). Различные вещества, образованные из одних и тех же атомов называют аллотропными модификациями.
Разнообразных сложных веществ намного больше, чем простых.
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой.
Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные,атомные, молекулярные и металлические.
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изображают, как показано на рис  , где указывается только взаимное расположение частиц, но не их размеры.
, где указывается только взаимное расположение частиц, но не их размеры.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl-, NanCln, где n - большое число . Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз - одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4 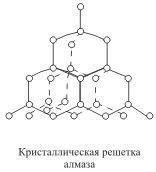 . В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
. В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
Примерами их являются лед, твердый оксид углерода (IV) ("сухой лед"), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Сl2, Br2, I2, Н2, О2, N2), трех- (О3), четырех- (Р4), восьми- (S8) атомными молекулами. Молекулярная кристаллическая решетка йода показана на рис 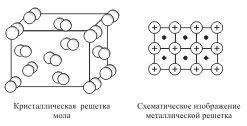 . Большинство кристаллических органических соединений имеют молекулярную решетку.
. Большинство кристаллических органических соединений имеют молекулярную решетку.
Вопросы для закрепления теоретического материала к лабораторной работе:
Чем отличаются простые вещества от сложных?
В каких агрегатных состояниях могут находится вещества, имеющие кристаллическую решетку?
Перечислите известные вам типы решеток.
Силы, действующие в решетках
Задания для лабораторной работы:
Задание № 1. Изготовить модели простого и сложного вещества по заданию преподавателя.
Задание № 2. Изготовить модель кристаллической решетки по заданию преподавателя
Инструкция по выполнению лабораторной работы
Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
Изготовить модели простого и сложного вещества по заданию
Изготовить модель кристаллической решетки.
Порядок выполнения отчёта по лабораторной работе
В тетради для практических занятий и лабораторных работ напишите номер, название и
учебную цель работы.
Ответьте на вопросы для закрепления теоретического материала к лабораторной работе.
Выполните задание.
Запишите вывод о проделанной работе.
Образец отчёта по лабораторной работе
Лабораторная работа № 3 «изготовление моделей сложного и простого вещества , моделей кристаллической решетки».
Учебная цель: отработать навыки экспериментальной работы.
Ответы на вопросы для закрепления теоретического материала
к лабораторной работе
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
| задание | результаты |
|
|
Вывод: Выполнив задания лабораторной работы я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Название практического занятия № 4 «Приготовление суспензий и эмульсий, аэрозолей, гелей. Коагуляция».
Учебная цель: практически познакомиться со свойствами и способами приготовления суспензий и эмульсий, аэрозолей, гелей.
Учебные задачи:
Изучить способы приготовления суспензий,эмульсий.
Научиться отличать коллоидный раствор от истинного;
Отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
Образовательные результаты, заявленные во ФГОС третьего поколения
Студент должен
иметь практический опыт: получения суспензии карбоната кальция и эмульсии моторного маслав воде;
уметь: применять знания о способах получения дисперсных систем на практике;
знать: основные состояния веществ и способы приготовления суспензий и эмульсий;
владеть: навыками экспериментальной работы при работе в кабинете химии.
Задачи практического занятия:
Повторить теоретический материал по теме практического занятия.
Ответить на вопросы для закрепления теоретического материала.
Выполнить эксперимент, соблюдая правила техники безопасности при работе в кабинете химии.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Ступка с пестиком, ложка-шпатель, стакан, стеклянная палочка, фонарик, пробирка; вода, карбонат кальция (кусочек мела), масло.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Суспензия иначе взвесь (англ. suspension) — дисперсная система, в которой твердые частицы дисперсной фазы находятся во взвешенном состоянии в жидкой дисперсионной среде.
Суспензии подразделяют на грубодисперсные (размер частиц — от 1 мкм до долей миллиметра) и мелкодисперсные (от 100 до 1000 нм). Первые неустойчивы и склонны к коагуляции. Суспензии, в которых частицы двигаются свободно, называют золями; если же частицы дисперсной фазы связаны в пространственную структуру, суспензию называют гелем. Суспензии получают методом диспергирования (измельчение твердых тел в жидкости) или конденсации (выделение твердой фазы из пересыщенных растворов). Суспензии имеют ряд общих свойств с порошками, они подобны по дисперсности. Если порошок поместить в жидкость и перемешать, то получится суспензия, а при высушивании суспензия снова превращается в порошок. Поэтому способы получения суспензий и порошков одинаковы, лишь при получении суспензий появляется дополнительная технологическая стадия – смешивание порошка с дисперсионной средой. Концентрированные суспензии (пасты) могут быть получены как в результате оседания более разбавленных суспензий, так и непосредственно растиранием порошков или массивных твердых тел с жидкостями.
Коагуляция иначе агрегация; флокуляция (англ. coagulation) — слипание коллоидных частиц друг с другом и образование из них более сложных агрегатов.
Коагуляция представляет собой процесс укрупнения частиц, а седиментация является конечным результатом этого процесса, однако термин «коагуляция» часто используют для обозначения данного явления в целом.
Золь иначе лиозоль; аэрозоль; коллоидный раствор (англ. sol) — высокодисперсная коллоидная система (коллоидный раствор) с жидкой (лиозоль) или газообразной (аэрозоль) дисперсионной средой, в объеме которой распределена другая (дисперсная) фаза в виде мелких твердых частиц, капелек жидкости или пузырьков газа.
Примером аэрозоля на основе жидкости является туман — взвесь капель воды в воздухе; находящийся в воздухе дым или пыль — пример твердотельного аэрозоля.
Гель (англ. gel) — (от лат. gelo - застываю или gelatus - замороженный, неподвижный): Гель представляет собой студенистое тело, способное сохранять форму и обладающее упругостью и эластичностью. Примеры веществ, образующих гели: аморфный (гелеобразный) гидроксид алюминия переменного состава Al2O3·nH2O, гидрогели кремниевых кислот (nSiO2·mH2O). При их высушивании получают, соответственно, алюмогель и силикагель — пористые вещества, используемые в качестве сорбентов и носителей для катализаторов.
Вопросы для закрепления теоретического материала к практическому занятию:
Назовите частицы, содержащиеся в водном растворе карбоната натрия, из какого числа компонентов состоит эта система?
Назовите составные части дисперсной системы и их отличия друг от друга.
Назовите основной признак, отличающий коллоидные системы от других видов дисперсных систем.
Поясните, чем гели отличаются от золей; приведите по одному примеру таких коллоидных систем.
Что такое коагуляция, назовите её виды, приведите по одному примеру различных видов коагуляции.
Задания для практического занятия(опыт 1):
Задание № 1. Приготовьте суспензию карбоната кальция в воде.
Задание № 2. На что похожа полученная смесь?
Инструкция по выполнению практического занятия
Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
В ступке из кусочка мела приготовить порошок.
В стакан насыпать ложку порошка мела и постепенно при помешивании стеклянной палочкой добавить воды.
Запишите наблюдения в таблицу.
Выполните задание № 2.
Методика анализа результатов, полученных в ходе практического занятия
Используя инструкцию по выполнению практического занятия, проведите эксперимент, соблюдая правила техники безопасности при работе в кабинете химии.
Порядок выполнения отчета по практическому занятию
В тетради для практических занятий и лабораторных работ напишите номер, название и
учебную цель занятия.
Ответьте на вопросы для закрепления теоретического материала к практическому занятию.
Выполните эксперимент, руководствуясь, инструкция по выполнению практического занятия.
Ответьте на вопрос задания № 2.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с учебными задачами практического занятия и реализованы ли образовательные результаты, заявленные во ФГОС третьего поколения.
Образец отчёта по практическому занятию
Практическое занятие № 4 «Приготовление суспензии карбоната кальция в воде (опыт 1)».
Учебная цель: практически познакомиться со свойствами и способами приготовления
суспензий.
Ответы на вопросы для закрепления теоретического материала
к практическому занятию
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
Задание №1
| Название опыта | Рисунок того что делаете | Наблюдения и их объяснения
|
| Приготовление суспензии карбоната кальция в воде. |
|
|
Задание №2 ……………………………………………………………………………………………..
Вывод: Выполнив задания практического занятия я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Название практического занятия № 4 «Получение эмульсии моторного масла(опыт 2)».
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: получения эмульсии моторного масла;
уметь: применять знания о способах получения дисперсных систем на практике;
знать: основные состояния веществ и способы получения эмульсий;
владеть: навыками экспериментальной работы при работе в кабинете химии.
Задачи практического занятия:
Повторить теоретический материал по теме практической работы.
Ответить на вопросы для закрепления теоретического материала.
Выполнить эксперимент, соблюдая правила техники безопасности при работе в кабинете химии.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Ступка с пестиком, ложка-шпатель, стакан, стеклянная палочка, фонарик, пробирка; вода, масло. ПАВ, молоко.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Эму́льсия (новолат. emulsio, от лат. emulgeo — дою, выдаиваю) — дисперсная система, состоящая из микроскопических капель жидкости (дисперсной фазы), распределенных в другой жидкости (дисперсионной среде).
Эмульсии могут быть образованы двумя любыми несмешивающимися жидкостями; в большинстве случаев одной из фаз эмульсий является вода, а другой - вещество, состоящее из слабополярных молекул (жидкие углеводороды, жиры). Например, молоко — одна из первых изученных эмульсий: в нём капли молочного жира распределены в водной среде.
Эмульсии относятся обычно к грубодисперсным системам, поскольку капельки дисперсной фазы имеют размеры от 1 до 50 мкм. Эмульсии низкой концентрации — неструктурированные жидкости. Высококонцентрированные эмульсии — структурированные системы.
Тип эмульсии зависит от состава и соотношения ее жидких фаз, от количества и химической природы эмульгатора, от способа эмульгирования и некоторых других факторов.
Прямые, с каплями неполярной жидкости в полярной среде (типа «масло в воде»)
Для эмульсих типа м/в хорошими эмульгаторами могут служить растворимые в воде мыла (натриевые и калиевые соли жирных кислот).
Обратные, или инвертные (типа «вода в масле»). Для эмульсии типа в/м хорошими эмульгаторами могут быть нерастворимые в воде мыла (кальциевые, магниевые и алюминиевые соли жирных кислот).
Так же эмульсии разделяются на лиофильные и лиофобные:
Лиофильные эмульсии образуются самопроизвольно и термодинамически устойчивы.
Лиофобные эмульсии возникают при механическом, акустическом или электрическом эмульгировании (диспергировании), а также вследствие конденсационного образования капель дисперсной фазы в пересыщенных растворах или расплавах. Они термодинамически неустойчивы и длительно существуют лишь в присутствии эмульгаторов — веществ, облегчающих диспергирование и препятствующих коалесценции (слипанию).
Эмульсии широко используют в различных отраслях промышленности:
Пищевая промышленность (сливочное масло, маргарин);
Мыловарение;
Переработка натурального каучука;
Строительная промышленность (битумные материалы, пропиточные композиции);
Автомобильная промышленность (получение смазочно-охлаждающих жидкостей);
Сельское хозяйство (пестицидные препараты);
Медицина (производство лекарственных и косметических средств);
Живопись.
В водной среде молока эмульгированы мелкие капельки жира. Они постепенно поднимаются на поверхность, поскольку их плотность меньше, чем плотности воды. В молоке за несколько часов образуется слой сливок. Молоко является не устойчивой эмульсией.
Вопросы для закрепления теоретического материала к практическому занятию:
Назовите основные признаки истинного раствора.
Поясните, чем растворитель отличается от растворённого вещества.
Чем насыщенный раствор отличается от: а) разбавленного; б) концентрированного;
в) пересыщенного; г) ненасыщенного.
Поясните, чем лиофильные эмульсии отличаются от лиофобных; приведите по одному примеру таких систем.
Какова роль эмульсий в сельском хозяйстве?
Задания для практического занятия (опыт 2):
Задание №1. Получите эмульсию моторного масла.
Задание №2. Молоко, поступающее в продажу с предприятий молочной промышленности, должно быть более устойчиво к расслоению. Каким образом можно повысить устойчивость данной эмульсии.
Инструкция по выполнению практического занятия
Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
В пробирку налейте ¼ часть воды и столько же масла. Тщательно перемешайте.
Добавьте каплю ПАВ (эмульгатора) и перемешайте ещё раз.
Сравните результаты. Запишите наблюдения в таблицу.
Выполните задание № 2.
Методика анализа результатов, полученных в ходе практического занятия
Используя инструкцию по выполнению практического занятия, проведите эксперимент, соблюдая правила техники безопасности при работе в кабинете химии.
Порядок выполнения отчёта по практическому занятию
В тетради для практических занятий и лабораторных работ напишите номер, название и
учебную цель занятия.
Ответьте на вопросы для закрепления теоретического материала к практическому занятию.
Выполните эксперимент, руководствуясь, инструкция по выполнению практического занятия.
Ответьте на вопрос задания № 2.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с учебными задачами практического занятия и реализованы ли образовательные результаты, заявленные во ФГОС третьего поколения.
Образец отчёта по практическому занятию
Практическое занятие № 4 «Получение эмульсии моторного масла (опыт 2)».
Учебная цель: практически познакомиться со свойствами и способами получения эмульсий.
Ответы на вопросы для закрепления теоретического материала
к практическому занятию
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
| Название опыта | Рисунок того что делаете | Наблюдения и их объяснения
|
| Получение эмульсии моторного масла. |
|
|
Задание №2 …………………………………………………………………………………………….
Вывод: Выполнив задания практического занятия я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения
Название практического занятия № 4 «Ознакомление со свойствами дисперсных систем(опыт 3)».
Учебная цель: практически познакомиться со свойствами дисперсных систем.
Учебные задачи:
Ознакомиться со свойствами дисперсных систем.
Научиться отличать коллоидный раствор от истинного;
Отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: получения дисперсных систем;
уметь: применять знания о способах получения дисперсных систем;
знать: основные состояния веществ и способы их получения;
владеть: навыками экспериментальной работы при работе в кабинете химии.
Задачи практического занятия:
Повторить теоретический материал по теме практического занятия.
Ответить на вопросы для закрепления теоретического материала.
Выполнить эксперимент, соблюдая правила техники безопасности при работе в кабинете химии.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Ступка с пестиком, ложка-шпатель, стакан, стеклянная палочка, фонарик, пробирка; мука, молоко, зубная паста, раствор крахмала, раствор сахара.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Организмы животных и растений, гидросфера, земная кора и недра, космическое пространство часто представляют собой вещества в раздробленном, или, как говорят, дисперсном, состоянии. Большинство веществ окружающего нас мира, существует в виде дисперсных систем: почвы, ткани живых организмов, пищевые продукты и др. Читая эту главу, постоянно думайте, когда и где вы встречаете описываемое явление в природе, быту или производстве, а также, как можно его использовать.
Дисперсные системы – это системы, в которых мелкие частицы вещества, или дисперсная фаза, распределены в однородной среде (жидкость, газ, кристалл), или дисперсионной фазе
|
| Размер частиц дисперсной фазы характеризуется дисперсностью. В зависимости от неё дисперсные системы можно разделить на высокодисперсные, или собственно коллоидные, и низкодисперсные (грубодисперсные). Размер частиц низкодисперсных систем составляет 10–3 мм. и больше. Размер частиц высокодисперсных систем лежит в интервале 10–6–10–4 мм (от 1 до 100 нм), что, как минимум, на порядок больше размера частиц в истинных растворах (10–7 мм). |
Химия дисперсных систем изучает поведение вещества в сильно раздробленном, высокодисперсном состоянии, характеризующемся очень высоким отношением общей площади поверхности всех частиц к их общему объему или массе (степень дисперсности).
Важнейшая особенность дисперсного состояния вещества состоит в том, что энергия системы главным образом сосредоточена на поверхности раздела фаз. При диспергировании, или измельчении, вещества происходит значительное увеличение площади поверхности частиц (при постоянном суммарном их объеме). При этом энергия, затрачиваемая на измельчение и на преодоление сил притяжения между образующимися частицами, переходит в энергию поверхностного слоя – поверхностную энергию. Чем выше степень измельчения, тем больше поверхностная энергия. Поэтому область химии дисперсных систем (и коллоидных растворов) считают химией поверхностных явлений.
Свойства вещества в раздробленном, или дисперсном, состоянии значительно отличаются от свойств того же вещества, находящегося в недисперсном состоянии, т.е. в виде куска твердого тела или некоторого объема жидкости.
Классификация дисперсных систем
| Дисперсная фаза | Дисперсионная среда | Название системы | Примеры |
| Газ | Газ | (Дисперсная система не образуется) | - |
| Жидкость | Пена | Пена газированной воды, пузырьки газа в жидкости, мыльная пена | |
| Твердое тело | Твердая пена | Пенопласт, микропористая резина, пемза, хлеб, сыр | |
| Жидкость | Газ | Аэрозоль | Туман, облака, струя из аэрозольного баллона |
| Жидкость | Эмульсия | Молоко, сливочное масло, майонез, крем, мазь | |
| Твердое тело | Твердая эмульсия | Жемчуг, опал | |
| Твердое тело | Газ | Аэрозоль, порошок | Пыль, дым, мука, цемент |
| Жидкость | Суспензия, золь (коллоидный раствор) | Глина, паста, ил, жидкие смазочные масла с добавкой графита или MoS | |
| Твердое тело | Твердый золь | Сплавы, цветные стекла, минералы |
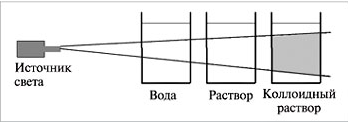
Конус Тиндаля тем ярче, чем выше концентрация и больше размер частиц. Интенсивность светорассеяния усиливается при коротковолновом излучении и при значительном отличии показателей преломления дисперсной и дисперсионной фаз. С уменьшением диаметра частиц максимум поглощения смещается в коротковолновую часть спектра, и высокодисперсные системы рассеивают более короткие световые волны и поэтому имеют голубоватую окраску. На спектрах рассеяния света основаны методы определения размера и формы частиц.
| | Методы исследования дисперсных систем (определение размера, формы и заряда частиц) основаны на изучении их особых свойств, обусловленных гетерогенностью и дисперсностью, в частности оптических. Коллоидные растворы обладают оптическими свойствами, отличающими их от настоящих растворов, – они поглощают и рассеивают проходящий через них свет. При боковом рассматривании дисперсной системы, через которую проходит узкий световой луч, внутри раствора на темном фоне виден светящийся голубоватый так называемый конус Тиндаля. |
Вопросы для закрепления теоретического материала к практическому занятию:
Назовите признаки, характеризующие систему и отличающие её от группы объектов, содержащихся в среде.
Назовите основные части систем и поясните, чем фаза отличается от компонента.
Назовите основной признак, отличающий грубые взвеси от других видов дисперсных систем.
Назовите вид грубых взвесей по перечисленным признакам:
а) дисперсионная среда – газ, а дисперсная фаза – твёрдое вещество;
б) дисперсионная среда – жидкость, а дисперсная фаза –газ;
в) дисперсионная среда – жидкость, а дисперсная фаза – твёрдое вещество;
г) дисперсионная среда и дисперсная фаза – жидкие, нерастворимые друг в друге вещества.
Приведите по одному примеру суспензий, эмульсий, дымов, туманов.
Задания для практического занятия(опыт 3):
Задание №1. Изучите образцы дисперсных систем и заполните таблицу № 1.
Задание №2. Заполните таблицу № 2.
Инструкция по выполнению практического занятия
Изучите образцы дисперсных систем
Заполните таблицы.
Методика анализа результатов, полученных в ходе практического занятия
Используя инструкцию по выполнению практического занятия, проведите
эксперимент, соблюдая правила техники безопасности при работе в кабинете химии.
Порядок выполнения отчёта по практическому занятию
В тетради для практических занятий и лабораторных работ напишите номер, название и
учебную цель занятия.
Ответьте на вопросы для закрепления теоретического материала к практическому занятию.
Выполните эксперимент, руководствуясь, инструкция по выполнению практического занятия.
Заполните таблицы.
Запишите вывод о проделанной работе.
Образец отчёта по практическому занятию
Практическое занятие № 4 «Ознакомление со свойствами дисперсных систем (опыт 3)».
Учебная цель: практически познакомиться со свойствами дисперсных систем.
Ответы на вопросы для закрепления теоретического материала
к практическому занятию
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
Таблица №1.
| Характеристика дисперсных систем | Виды дисперсных систем. | |||||
| Аэрозоли | Эмульсии | Суспензии | Коллоидные растворы | Истинные растворы | ||
| Состав | Дисперсная фаза |
|
|
|
|
|
| Дисперсионная среда |
|
|
|
|
| |
| Примеры (дополнить список) | Мука | Молоко | Зубная паста | Раствор крахмала | Раствор сахара | |
| Размеры частиц |
|
|
|
|
| |
| Внешний вид. Эффект Тиндаля. |
|
|
|
|
| |
| Способность осаждаться |
|
|
|
|
| |
| Значение |
|
|
|
|
| |
Таблица№2
| Название опыта | Рисунок того что делаете | Наблюдения и их объяснения
|
| Ознакомление со свойствами дисперсных систем. |
|
|
Вывод: Выполнив задания практического занятия я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2005.
Тема: «Вода. Растворы. Электролитическая диссоциация».
Название практического занятия № 5 «Приготовление раствора заданной концентрации».
Учебная цель: научиться готовить раствор с заданной молярной концентрацией.
Учебные задачи:
1. Проверить на практике действенность теоретических знаний о способах выражения концентрации веществ в растворе.
2. Уметь грамотно оформлять и решать задачи.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: приготовления растворов с заданной концентрацией;
уметь: применять знания о способах получения растворов с заданной концентрацией на практике;
знать: алгоритм приготовления определённого объёма раствора с заданной молярной концентрацией;
владеть: навыками экспериментальной работы при работе в кабинете химии.
Задачи практического занятия:
Повторить теоретический материал по теме практического занятия.
Ответить на вопросы для закрепления теоретического материала.
Решить 2 задачи по теме практического занятия.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Методические указания для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Калькулятор.
Весы, разновесы, мерные колбы объёмом 0,5 л. и 1 л., пипетки, хлорид натрия, соляная кислота, ложка-шпатель, стакан, стеклянная палочка.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Концентрацией раствора называется весовое содержание растворённого вещества в определённом весовом количестве или в определённом объёме раствора.
В химии применяют следующие способы выражения концентрации раствора: процентная, молярная, моляльная и нормальная.
Процентная концентрация выражается числом граммов растворённого вещества, содержащимся в 100 г. раствора. Например, 20%-ный раствор поваренной соли – это раствор, в 100 г. которого содержится 20 г. соли и 80 г. воды.
Молярная концентрация выражается количеством молей растворённого вещества, содержащимся в 1 л. раствора. Раствор, содержащий 1 моль растворённого вещества в литре, называется одномолярным (1 М раствор), содержащий 0,1 моля, называется децимолярным (0,1 М раствор) и т.д.
Моляльная концентрация – концентрация растворённого вещества в молях на 1000 г. растворителя.
Нормальная концентрация выражается числом грамм-эквивалентов растворённого вещества, содержащимся в 1 л. 1 г-экв. растворённого вещества, называется одномолярным (1 н. раствор), содержащий 0,1 г-экв. в 1 л. называется децинормальным (0,1 н. раствор) и т.д.
Вопросы для закрепления теоретического материала к практическому занятию:
Объясните, в чём сущность процесса растворения?
Почему процесс растворения бывает эндотермическим?
Чем насыщенный раствор отличается от: а) разбавленного; б) концентрированного;
в) пересыщенного; г) ненасыщенного?
Перечислите известные вам способы выражения концентрации раствора.
Что такое нормальность и молярность раствора?
Задания для практического занятия:
Задание № 1. Приготовить 1 л раствора хлорида натрия с молярной концентрацией 0,155 М.
Задание № 2. Приготовить 0,5 л раствора соляной кислоты с молярной концентрацией 0,10 М из раствора с массовой долей соляной кислоты 20% (р = 1,1 г/см3). Помните: m = ρV
Инструкция по выполнению практического занятия
Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
Рассчитайте массу хлорида натрия. Для расчетов используйте формулы:
C = ν : V; ν = C *V; m = ν *M; m = C *V* M
Взвесьте на весах рассчитанную навеску.
Перенести навеску соли в мерную колбу.
Прилейте в колбу немного воды и перемешать стеклянной палочкой до полного растворения соли.
Налейте в мерную колбу воды до метки.
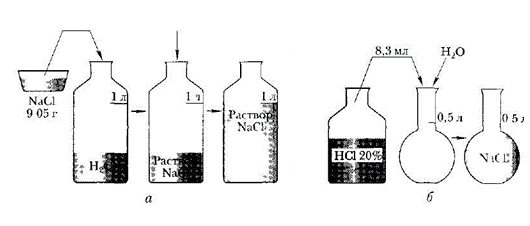
Чтобы не перелить воду, последние капли добавлять с помощью пипетки.
Методика анализа результатов, полученных в ходе практического занятия
Используя инструкцию по выполнению практического занятия, проведите
эксперименты, соблюдая правила техники безопасности при работе в кабинете химии.
Порядок выполнения отчёта по практическому занятию
В тетради для практических занятий и лабораторных работ напишите номер, название и
учебную цель занятия.
Ответьте на вопросы для закрепления теоретического материала к практическому занятию.
Выполните эксперимент - задание №1, руководствуясь, инструкция по выполнению практического занятия.
Выполните эксперимент - задание №2, руководствуясь, инструкция по выполнению практического занятия.
Заполните таблицу.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с учебными задачами практического занятия и реализованы ли образовательные результаты, заявленные во ФГОС третьего поколения.
Образец отчёта по практическому занятию
Практическое занятие № 6 «Приготовление растворов заданной концентрации».
Учебная цель: научиться готовить раствор с заданной молярной концентрацией.
Ответы на вопросы для закрепления теоретического материала
к практическому занятию
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
| Номер и содержание задачи | Что делали? | Расчёты | Наблюдения |
|
|
|
|
|
Вывод: Выполнив задания практического занятия я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2005.
Тема: «Классификация неорганических соединений и их свойства».
Название лабораторной работы № 6 «Испытание растворов кислот и оснований индикаторами.».
Учебная цель: отработать навыки составления уравнений химических реакций в молекулярном и ионном видах.
Учебные задачи:
Познакомиться экспериментально с химическими свойствами кислот и оснований.
Закрепить умения составлять уравнения реакций в молекулярном и ионном видах.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: составления уравнений химических реакций в молекулярном и ионном видах;
уметь: работать в лаборатории с соблюдением правил ТБ;
знать: химические свойства и способы получения неорганических кислот, оснований;
владеть: навыками экспериментальной работы при работе в кабинете химии.
Задачи лабораторной работы:
Повторить теоретический материал по теме лабораторной работы.
Ответить на вопросы для закрепления теоретического материала.
Провести эксперимент, соблюдая правила техники безопасности.
Оформить отчет
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Таблица «Растворимость кислот, солей и оснований в воде».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Растворы: серной кислоты, соляной кислоты,гидроксида натрия; индикатора синий лакмус,фенолфталеина метилоранж; кювета для капельного анализа, пипетка, стеклянная палочка, универсальная индикаторная бумага.
Краткие теоретические и учебно-методические материалы
по теме лабораторной работы
Кислоты изменяют окраску индикаторов: лакмус-красный, метилоранж-красный (только для растворимых кислот).
Вопросы для закрепления теоретического материала к лабораторной работе
Какие вещества называют кислотами?
Приведите по две формулы кислот разной основности и назовите их.
Укажите валентность кислотных остатков, входящих в состав солей, формулы которых MgBr2; Ca3(PO4)2; KMnO4; Na2CО3; AlPO4; CuSO4; Fe(NO3)3; Al2S3; PbCl4; KI
Краткие теоретические и учебно-методические материалы
по теме лабораторной работы
Химические свойства оснований:
Диссоциация:
КОН + nН2О ![]() К+×mН2О + ОН–×dН2О или сокращенно: КОН
К+×mН2О + ОН–×dН2О или сокращенно: КОН![]() К+ + ОН–.
К+ + ОН–.
Многокислотные основания диссоциируют по нескольким ступеням (в основном диссоциация протекает по первой ступени). Например, двухкислотное основание Fe(OH)2 диссоциирует по двум ступеням: Fe(OH)2![]() FeOH+ + OH– (1 ступень);
FeOH+ + OH– (1 ступень);
FeOH+![]() Fe2+ + OH– (2 ступень).
Fe2+ + OH– (2 ступень).
Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
индикатор + ОН– (щелочь) ![]() окрашенное соединение.
окрашенное соединение.
Вопросы для закрепления теоретического материала к лабораторной работе:
Какие вещества называют основаниями?
Перечислите известные вам классификации оснований.
От чего зависит число гидроксильных групп в основаниях?
Задания для лабораторной работы:
Задание № 1. Экспериментально исследуйте свойства кислот и оснований и индикаторов капельным методом.
Инструкция по выполнению лабораторной работы(кислоты)
Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
В кювет для капельного анализа внести по 4 капли серной кислоты. Затем добавьте в кювету:
- опыт № 1. индикатор метиловый оранжевый
- опыт № 2. индикатор лакмус синий;
опыт № 3. индикатор универсальный;
- опыт № 4. индикатор метиловый оранжевый, а далее гидроксид натрия;
В пять кювет для капельного анализа внесите по 2 капли щёлочи. Затем добавьте в кювету:
- опыт № 5. индикатор метиловый оранжевый
- опыт № 6. индикатор лакмус синий
- опыт № 7. индикатор универсальный
- опыт № 8. индикатор фенолфталеин
- опыт № 9. индикатор метиловый оранжевый, а далее кислоту.
Запишите наблюдаемые явления в таблицу.
Методика анализа результатов, полученных в ходе лабораторной работы
Используя инструкцию по выполнению практического занятия, проведите опыты.
Следующий опыт следует начинать только после полного разбора предыдущего опыта.
Порядок выполнения отчёта по лабораторной работе
В тетради для практических занятий и лабораторных работ напишите номер, название и
учебную цель работы.
Ответьте на вопросы для закрепления теоретического материала к лабораторной работе.
Выполнив опыты № 1-9, запишите наблюдения в таблицу и выполните задание.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с
учебными задачами лабораторной работы и реализованы ли образовательные результаты, заявленные во ФГОС третьего поколения.
Образец отчёта по лабораторной работе
Лабораторная работа № 6 «Испытание растворов кислот и оснований индикаторами».
Учебная цель: отработать навыки проведения эксперимента.
Ответы на вопросы для закрепления теоретического материала
к лабораторной работе
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
| Название опыта | Рисунок того что делаете | Наблюдения и их объяснения | Уравнения реакций |
| Испытание растворов кислот индикаторами.
|
| Цвет фенолфталеина-
Цвет лакмуса -
Цвет метилоранжа- |
_____________ |
| Испытание растворов щелочей индикаторами.
|
| Цвет метилоранжа
Цвет синего лакмуса-
Цвет универсального -
Цвет фенолфталеина-
Цвет метилоранжа в кислоте - | ------------------------------------- |
Вывод: Выполнив задания лабораторной работы я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2011.
Название лабораторной работы № 7 «Реакции ионного обмена».
Учебная цель: отработать навыки составления уравнений реакций в молекулярной и ионной формах.
Учебные задачи:
Закрепить знания по теме "Реакции ионного обмена";
Исследовать необратимые реакции;
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: составления уравнений химических реакций в молекулярной и ионной формах;
уметь: работать в лаборатории с соблюдением правил ТБ;
знать: условия необратимости реакций ионного обмена;
владеть: практическими навыками проведения реакций ионного обмена.
Задачи лабораторной работы:
Повторить теоретический материал по теме лабораторной работы.
Ответить на вопросы для закрепления теоретического материала.
Провести реакции ионного обмена.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Таблица «Растворимость кислот, солей и оснований в воде».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Растворы: кислот - соляной, серной; гидроксида натрия, индикаторов - фенолфталеина, метилоранжа, синего лакмуса; солей - карбонат натрия, нитрат бария, сульфат алюминия, сульфат меди (II), хлорид аммония, хлорид кальция; дистиллированная вода; кювета для капельного анализа, пипетка, стеклянная палочка, универсальная индикаторная бумага.
Краткие теоретические и учебно-методические материалы
по теме лабораторной работы
Распад электролитов на ионы при растворении в воде или расплавлении называется электролитической диссоциацией. Электролиты – вещества, проводящие электрический ток в растворенном или расплавленном состоянии. К электролитам относятся вещества с ионной связью: соли, основания и полярные молекулы кислот.
Вещества, которые в растворенном или расплавленном состоянии не проводят электрического тока, называются неэлектролитами.
| Классификация электролитов
| Электролитическая диссоциация: I. Кислот 1. HCl D H+ + Cl-, II. Щелочей NaOH D Na+ + OH-, III. Солей BaCl2 D Ba2+ + 2Cl-, | ||||||||||||||||||||||||||
| Реакции обмена между растворами электролитов идут до конца, если образуется малодиссоциирующее вещество, или вещество, практически нерастворимое, выделяющееся из раствора в виде осадка или газа. | |||||||||||||||||||||||||||
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
| 1). Записываем уравнение РИО в молекулярном виде:
| Взаимодействие серной кислоты и хлорида бария: II II I I H2SO4 + BaCl2 = BaSO4 + 2HCl |
| 2). Используя ТР указываем растворимость веществ воде: - Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓; - Если продукт является газом, справа от химической формулы ставим знак ↑. | Р Р Н Р H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl Молекулярный вид |
| 3). Записываем уравнение РИО в полном ионном виде. | 2H+ + SO42- + Ba2+ + 2Cl- = BaSO4 ↓+ 2H+ + 2Cl- Полный ионный вид |
| 4). Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции. | SO42- + Ba2+ + = BaSO4 ↓ Краткий ионный вид Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок BaSO4 ↓ |
Вопросы для закрепления теоретического материала к лабораторной работе
Как называются реакции между кислотой и основанием? Почему?
Составить молекулярные уравнения для реакций, если краткие ионные уравнения имеют
вид: a) Ca2+ + CO32- → CaCO3↓, б) 2H+ + SO32- → H2O + SO2↑.
Для уравнений реакций составьте ионные уравнения:
а) Fe(OH)3$ + 3HCl → FeCl3 + 3H2O, б) Ca(OН)2 + 2HNO3 → Ca(NO3)2 + 2H2O.
Задания для лабораторной работы:
Задание № 1. Проведите реакции ионного обмена.
Задание № 2. Составьте соответствующие уравнения химических реакций в молекулярном и ионном видах.
Инструкция по выполнению лабораторной работы
Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
Капельным методом проведите опыты:
– опыт № 1 Образование малорастворимых веществ.
В кювету для капельного анализа добавьте по одной капле следующих растворов: № 1 -сульфата меди (II), № 2 - хлорида кальция, № 3 - сульфата алюминия.
Добавьте к ним растворы: в первую - гидроксид натрия, ко вторую - карбонат натрия, к третью - нитрат бария.
В таблицу запишите наблюдения (цвет и характер осадка). Составьте уравнения происходящих реакций в молекулярном и ионном видах. Назовите полученные вещества.
- опыт № 2 Реакции с образованием газов.
В 4-ю кювету для капельного анализа добавьте 1 каплю раствора карбоната натрия, в 5-ю кювету – 1 каплю раствора хлорида аммония (NH4Cl).
Добавьте к ним растворы: в 4-ю - 1 каплю серной кислоты, в 5-ю -1 каплю раствора щелочи.
В таблицу запишите наблюдения (цвет и запах газов). Составьте уравнения происходящих реакций в молекулярном и ионном видах. Назовите полученные вещества.
- опыт № 3 Реакции, идущие с образованием малодиссоциирующих веществ.
В 6-ю кювету для капельного анализа добавьте 1 каплю раствора гидроксида натрия и добавьте индикатор - фенолфталеин.
В таблицу запишите наблюдения. Объясните причину изменения окраски индикатора.
Добавьте по каплям в 6-ю кювету раствор соляной кислоты до обесцвечивания. Объясните причину обесцвечивания.
В 7-ю кювету для капельного анализа добавьте 1 каплю раствора сульфата меди и немного гидроксида натрия. Запишите наблюдения.
Прилейте в 7-ю кювету кислоты до растворения осадка. Запишите наблюдения.
Поясните, почему в 6-ой кювете произошло обесцвечивание, а в 7-ой кювете - растворение осадка. Составьте уравнения происходящих реакций в молекулярном и ионном видах. Назовите полученные вещества.
Методика анализа результатов, полученных в ходе лабораторной работы
Используя инструкцию по выполнению лабораторной работы, проведите опыты.
Следующий опыт следует начинать только после полного разбора предыдущего опыта.
Порядок выполнения отчёта по лабораторной работе
В тетради для практических занятий и лабораторных работ напишите номер, название и
учебную цель работы.
Ответьте на вопросы для закрепления теоретического материала к лабораторной работе.
Выполнив опыты № 1, 2, 3 запишите наблюдения и выполните задание.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с
учебными задачами лабораторной работы и реализованы ли образовательные результаты,
заявленные во ФГОС третьего поколения.
Образец отчёта по лабораторной работе
Лабораторная работа № «Реакции ионного обмена».
Учебная цель: отработать навыки составления уравнений реакций в молекулярной и ионной формах.
Ответы на вопросы для закрепления теоретического материала
к лабораторной работе
1.…………………………………………………………………………………………………….
2.…………………………………………………………………………………………………….
3.…………………………………………………………………………………………………….
| Название опыта | Уравнение реакции ионного обмена | Качественный признак реакции |
|
|
|
|
Вывод: Выполнив задания лабораторной работы я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2005.
Название практического занятия №8 «Решение экспериментальных задач».
Учебная цель: закрепить навыки составления уравнений химических реакций.
Учебные задачи:
Повторить знания по теме "Галогены";
Научиться распознавать соли – галогениды.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: составления уравнений химических реакций;
уметь: работать в лаборатории с соблюдением правил ТБ;
знать: научные методы распознавания солей – галогенидов;
владеть: практическими навыками проведения экспериментов по доказательству наличия водорода и хлора в составе соляной кислоты.
Задачи практического занятия:
Повторить теоретический материал по теме практического занятия.
Ответить на вопросы для закрепления теоретического материала.
Провести качественные реакции на галогены входящие в состав предложенных для анализа кислот.
Подтвердить опытным путём качественный состав соляной кислоты.
Предложить способы получения хлорида меди (II). Составить уравнения соответствующих химических реакций.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Пробирки, штатив для пробирок; растворы: иодида калия, бромида натрия, хлорида натрия, нитрата серебра; индикаторов – лакмус, фенолфталеина, метилоранжа; хлор, медь
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Галогены (от греч. halos - соль и genes - образующий) - элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
1) Общая электронная конфигурация внешнего энергетического уровня - nS2nP5.
2) С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
3) Молекулы галогенов состоят из двух атомов.
4) С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
5) Сила галогеноводородных кислот возрастает с увеличением атомной массы.
6) Галогены могут образовывать соединения друг с другом (например, BrCl)
Вопросы для закрепления теоретического материала к практическому занятию:
Составьте формулы всех кислот, образованных галогенами, запишите их названия.
Поставьте знак или = вместо *:
а) заряд ядра: Cl * Br; I * F; Cl * P;
б) число электронных слоёв: Cl * Br; I * F; Cl * P;
в) число электронов на внешнем уровне: Cl * Br; I * F; Cl * P;
г) радиус атома: Cl * Br; I * F; Cl * P;
д) восстановительные свойства: Cl * Br; I * F; Cl * P;
е) окислительные свойства: Cl * Br; I * F; Cl * P.
3. Дайте характеристику соляной кислоты:
а) по наличию кислорода - ……………………………………………
б) по основности - ……………………………………………………..
в) по растворимости в воде - ………………………………………….
г) по степени электролитической диссоциации - ................................
д) по летучести - ……………………………………………………….
е) по стабильности - ……………………………………………………
Задания для практического занятия:
Задание №1. Провести качественные реакции на галогены.
Задание №2. Определить качественный состав соляной кислоты.
Задание №3. Предложить способы получения хлорида меди (II). Составить соответствующие уравнения химических реакций.
Инструкция по выполнению практического занятия
Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
Посмотрите видео – эксперимент к опыту № 1: Качественные реакции галогенидов - солей галогенводородных кислот HCl, HBr, HI.
Опыт №1 Качественные реакции галогенидов - солей галогенводородных кислот HCl, HBr, HI.
- В три пробирки прилейте по 1-2мл растворов хлорида натрия, бромида натрия и йодида калия;
- В каждую пробирку добавьте несколько капель раствора нитрата серебра;
- Заполните таблицу № 1.
Посмотрите видео – эксперименты: «Обнаружение хлорид-ионов» и «Действие кислот на индикаторы» к опыту № 2: Определение качественного состава соляной кислоты.
Опыт № 2 Определение качественного состава соляной кислоты
- В три пробирки прилейте по 1-2 мл раствора соляной кислоты;
- В первую пробирку добавьте несколько капель лакмуса; во вторую – метилоранжа, а в третью пробирку – фенолфталеин;
- Заполните таблицу № 2.
6. Определите наличие хлорид-иона в растворе соляной кислоты:
– В пробирку прилейте 1 -2 мл раствора соляной кислоты;
- Добавьте к раствору соляной кислоты раствор нитрата серебра;
- Заполните таблицу № 3.
7. Посмотрите видео – эксперимент «Взаимодействие хлора с медью» к опыту № 3 Получение
хлорида меди (II).
8. Предложите ещё два различных способа получения хлорида меди (II). Составьте уравнения соответствующих химических реакций.
Методика анализа результатов, полученных в ходе практического занятия
Используя инструкцию по выполнению практического занятия, проведите опыты.
Следующий опыт следует начинать только после полного разбора преведущего опыта.
Порядок выполнения отчёта по практическому занятию
В тетради для практических занятий и лабораторных работ напишите номер, название и
учебную цель занятия.
Ответьте на вопросы для закрепления теоретического материала к практическому занятию.
Выполнив опыты № 1 и № 2 запишите наблюдения и выполните задания.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с
учебными задачами практического занятия и реализованы ли образовательные результаты,
заявленные во ФГОС третьего поколения.
Образец отчёта по практическому занятию
Практическое занятие №8 «Решение экспериментальных задач».
Учебная цель: закрепить навыки составления уравнений химических реакций.
Ответы на вопросы для закрепления теоретического материала
к практическому занятию
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
Таблица № 1
| Название опыта | Что делали? Что наблюдали? Выводы. | Составьте уравнения реакций между веществами |
| Качественные реакции галогенидов солей галогенводородных кислот HCl, HBr, HI. | | NaCl + AgNO3→ |
| | NaBr + AgNO3→ | |
| | KI+ AgNO3→ |
Таблица № 2
| Название индикатора | Цвет индикатора в нейтральной среде | Цвет индикатора в кислой среде |
| лакмус |
|
|
| метилоранж |
|
|
| фенолфталеин |
|
|
Таблица № 3
| Название опыта | Что делали? Что наблюдали? Выводы. | Составьте уравнения реакций между веществами |
| Определение хлорид - иона |
| HCl + AgNO3 → |
Вывод: Выполнив задания практического занятия я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2005
Тема: «Классификация неорганических соединений и их свойства».
Название лабораторной работы № 9 «Взаимодействие металлов с кислотами; кислот с оксидами, основаниями и солями».
Учебная цель: отработать навыки составления уравнений химических реакций в молекулярном и ионном видах.
Учебные задачи:
Познакомиться экспериментально с химическими свойствами металлов.
Закрепить умения составлять уравнения реакций в молекулярном и ионном видах.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: составления уравнений химических реакций в молекулярном и ионном видах;
уметь: работать в лаборатории с соблюдением правил ТБ;
знать: химические свойства металлов;
владеть: навыками экспериментальной работы при работе в кабинете химии.
Задачи лабораторной работы:
Повторить теоретический материал по теме лабораторной работы.
Ответить на вопросы для закрепления теоретического материала.
Провести эксперимент, соблюдая правила техники безопасности.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Растворы: серной кислоты, образцы металлов, сера, пробирки,штатив
Краткие теоретические и учебно-методические материалы
по теме лабораторной работы
Взаимодействие с простыми веществами
С кислородом большинство металлов образует оксиды – амфотерные и основные:
4Li + O2 = 2Li2O,
4Al + 3O2 = 2Al2O3.
Щелочные металлы, за исключением лития, образуют пероксиды:
2Na + O2 = Na2O2
С галогенами металлы образуют соли галогеноводородных кислот, например,
Cu + Cl2 = CuCl2.
С водородом самые активные металлы образуют ионные гидриды – солеподобные вещества, в которых водород имеет степень окисления -1.
2Na + H2 = 2NaH.
С серой металлы образуют сульфиды – соли сероводородной кислоты:
Zn + S = ZnS
С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании:
3Mg + N2 = Mg3N2.
С углеродом образуются карбиды:
4Al + 3C = Al3C4.
С фосфором – фосфиды:
3Ca + 2P = Ca3P2.
Металлы могут взаимодействовать между собой, образуя интерметаллические соединения:
2Na + Sb = Na2Sb,
3Cu + Au = Cu3Au.
Металлы могут растворяться друг в друге при высокой температуре без взаимодействия, образуя сплавы.
1. Взаимодействие с кислотами
H2SO4 + Ca = CaSO4 + H2 2HCl + Ca = CaCl2 + H2
Вопросы для закрепления теоретического материала к лабораторной работе
Какие вещества называют металлами?
Все ли металлы способны вытеснять водород из кислот?
С чем могут взаимодействовать металлы?
Отличаются ли металлы по химической активности?.
Задания для лабораторной работы:
Задание № 1. Экспериментально исследуйте свойства металлов.
Задание № 2. Составьте соответствующие уравнения химических реакций.
Инструкция по выполнению лабораторной работы
Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
Проведение химической реакции: окисление металлов
-Для этого внести в пламя спиртовки очищенную медную проволоку, после чего видно, что на проволоке появился черный налет. (2Сu +O2 =2CuO )
оксид меди (черного цвета)
-Внести в пробирку стружки железа и порошок серы, аккуратно встряхнуть, нагреть пробирку. Видно, что образовалась масса сульфида железа.
-Провести химическую реакцию между раствором соляной кислоты и таблетками цинка.
-Налейте в фарфоровую тарелку дистиллированной воды, осторожно внести пинцетом очищенный кусочек натрия. В результате видно бурное выделение водорода, а при помощи фенолфталеина можно обнаружить образование щелочи.
-Внести в пробирку кусочки железа, добавить 10 % раствор сульфата меди. Через некоторое время можно заметить появление бурого налета на кусочках железа. Это говорит о том, что произошла химическая реакция между металлом и солью более слабого металла.
запишите наблюдаемые явления.
Методика анализа результатов, полученных в ходе лабораторной работы
Используя инструкцию по выполнению практического занятия, проведите опыты.
Следующий опыт следует начинать только после полного разбора предыдущего опыта.
Порядок выполнения отчёта по лабораторной работе
В тетради для практических занятий и лабораторных работ напишите номер, название и
учебную цель работы.
Ответьте на вопросы для закрепления теоретического материала к лабораторной работе.
Выполнив опыты, запишите наблюдения в таблицу и выполните задание.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с
учебными задачами лабораторной работы и реализованы ли образовательные результаты, заявленные во ФГОС
Образец отчёта по лабораторной работе
Лабораторная работа № 9 «свойства металлов».
Учебная цель: отработать навыки составления уравнений химических реакций.
Ответы на вопросы для закрепления теоретического материала
к лабораторной работе
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
| Название опыта | Рисунок того что делаете | Наблюдения и их объяснения | Уравнения реакций |
| .
|
|
|
|
Вывод: Выполнив задания лабораторной работы я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2011.
Раздел 2. Органическая химия.
Тема: «Основные понятия органической химии и теория строения органических соединений».
Название практического занятия № 10 «Составление моделей молекул органических веществ».
Учебная цель: научиться составлять модели молекул различной сложности.
Учебные задачи:
Изучить особенности строения молекул органических веществ.
Найти общие признаки и различия гомологов и изомеров.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: составления моделей молекул органических веществ;
уметь: применять полученные знания о строении органических веществ на практике;
знать: основные положения теории строения органических веществ А.М. Бутлерова;
владеть: технологией изготовления моделей молекул органических веществ.
Задачи практического занятия:
Повторить теоретический материал по теме практического занятия.
Ответить на вопросы для закрепления теоретического материала.
Выполнить задания практического занятия.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Пластилин.
Спички.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Для того чтобы понять сущность работы, надо знать, что:
| 1. Простейшим представителем насыщенных углеводородов является метан, структурная формула которого |
|
| 2. sp3- гибридизация характерна для атомов углерода в (алканах) – в частности, в метане. | Рисунок 1 |
| 3. Атом углерода в молекуле метана расположен в центре тетраэдра, атомы водорода – в его вершинах. 4. Валентные углы между направлениями связей равны между собой и составляют угол 109°28'. | |
| 5. В этане есть углерод - углеродные связи.. L (С-С) = 0,154 нм. | Рисунок 2 |
Вопросы для закрепления теоретического материала к практическому занятию:
Какие вещества называют органическими?
В чем отличие органических веществ от неорганических веществ?
Что общего и в чём различия в строении а) гомологов, б) изомеров
Определите молекулярную формулу вещества, если оно содержит С-20%, Н-80%, а плотность вещества по водороду примерно равна 15.
Задания для практического занятия:
Задание № 1. Составьте сокращённые структурные формулы углеводородов: метана, этана, пропана, бутана, изобутана, пентана и всех его изомеров.
Задание № 2. Изготовьте модели молекул углеводородов: метана, этана, пропана, бутана, изобутана, пентана и всех его изомеров.
Инструкция по выполнению практического занятия
Составьте сокращённые структурные формулы углеводородов: метана, этана, пропана, бутана, изобутана, пентана и всех его изомеров.
2. Изготовьте модели молекул углеводородов:
- Модель молекулы метана. Соберите модель молекулы метана, используя для этого спички и пластилин. Для этого из пластилина (в наборе 16 шариков) выберите четыре шарика, а из пластилина (в наборе 7 шариков) – один шарик. В качестве стержней можно использовать спички. Учтите, что в молекуле метана угол между химическими связями С–Н составляет 109°28', т. е. молекула имеет тетраэдрическое строение (см. рис. 1).
- Модель молекулы этана. Соберите модель молекулы этана, используя для этого спички и пластилин. Учтите, что в молекуле этана угол между химическими связями С–Н составляет 109°28', а углерод-углеродные связи L (С-С) = 0,154 нм. (см. рис. 2).
- Модель молекулы пропана. Соберите модель молекулы пропана, используя для этого спички и пластилин.
- Модели молекул бутана и изобутана. Соберите модель молекулы н-бутана, используя пластилин. Подумайте и переделайте модель н-бутана в модель молекулы изобутана. Учтите, что в бутане атомы углерода расположены по отношению друг к другу под углом 109°, т. е. углеродная цепь должна иметь зигзагообразное строение. В молекуле изобутана все связи центрального атома углерода направлены к вершинам правильного тетраэдра. Сравните строение этих углеводородов.
- Модели молекул пентана и всех его изомеров. Соберите модель молекулы н-пентана и всех его изомеров последовательно, используя пластилин.
Методика анализа результатов, полученных в ходе практического занятия
Используя инструкцию по выполнению практического занятия, выполнете задания.
Собирать модель следующего органического соединения следует начинать только после полной сборки преведущей модели.
Порядок выполнения отчёта по практическому занятию
В тетради для практических занятий и лабораторных работ напишите номер, название и
учебную цель занятия.
Ответьте на вопросы для закрепления теоретического материала к практическому занятию.
Выполните задания № 1 и № 2. Сколько моделей: а) гомологов, б) изомеров было собрано во время практического занятия?
Заполните таблицу.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с
учебными задачами практического занятия и реализованы ли образовательные результаты,
заявленные во ФГОС третьего поколения.
Образец отчёта по практическому занятию
Практическое занятие № 10 «Составление моделей молекул органических веществ».
Учебная цель: научиться составлять модели молекул различной сложности.
Ответы на вопросы для закрепления теоретического материала
к практическому занятию
………………………………………………………………………………………………………
……………………………………………………………………………………………………....
………………………………………………………………………………………………………
……………………………………………………………………………………………………....
| № задания | Название вещества | Шаростержневая модель молекулы | Сокращенная структурная формула | Молекулярная формула |
|
|
|
|
|
|
Вывод: Выполнив задания практического занятия я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2005.
Тема: «Углеводороды и их природные источники».
Название лабораторной работы №11 «Качественное определение углерода, водорода и хлора в органических соединениях».
Учебная цель: формировать умения проводить наблюдения и делать выводы, записывать уравнения соответствующих реакций в молекулярном и ионном видах.
Учебные задачи:
Научиться определять содержание в органических соединениях углерода, хлора, водорода в органических соединениях.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: исследования свойств органических соединений, в лаборатории соблюдая правила техники безопасности;
уметь: записать уравнения химических реакций; провести эксперимент, соблюдая правила по технике безопасности;
знать: свойства органических соединений(парафинов);
владеть: навыками экспериментальной работы при работе в кабинете химии.
Задачи лабораторной работы:
Повторить теоретический материал по теме лабораторной работы.
Ответить на вопросы для закрепления теоретического материала.
Изучение качественного состава алканов.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Штатив с пробирками, пробки с газоотводными трубками, лабораторный штатив, стеклянная палочка, химические стаканы (2 шт.) емкостью не менее 150 мл, горелка (спиртовка), спички.
Парафин, вазелин, хлороформ (или дихлорэтан), сульфат меди (II) безводный, раствор гидроксида кальция, оксид меди (II), спирт и галогенопроизводные органические вещества — склянки № 1 и № 2.
Краткие теоретические и учебно-методические материалыпо теме лабораторной работы
Алканы являются простейшими из углеводородов. Это насыщенные ациклические углеводороды. Их молекулы не содержат кратных связей или замкнутых цепей из атомов углерода. Алканы чаще, чем другие углеводороды, встречаются в быту. Природный газ, топливо для зажигалок, бензин, вазелин, парафин состоят главным образом из алканов.
Благодаря теории химического строения А. М. Бутлерова мы можем прямо сейчас предсказать состав и строение алканов, отталкиваясь от четырёхвалентности углерода. Рассмотрим некоторые из этих углеводородов и проследим взаимосвязь их строения и свойств.
Метан — первый из алканов. Углеродный скелет его молекулы содержит всего один атом углерода, поэтому все четыре его валентности заняты атомами водорода, что соответствует составу CH4:
Пространственная модель молекулы метана
Связи C—H малополярны, а молекула симметрична, поэтому взаимодействие между молекулами в метане слабое. В совокупности с небольшой молекулярной массой это приводит к низкой температуре кипения метана (—162°C), поэтому при обычных условиях метан представляет собой газ. Метан является основным компонентом природного газа и используется главным образом как топливо, потому что при его сжигании выделяется очень много энергии:
CH4 + 2O2 → CO2 + 2H2O + 891 кДж
Чистый метан при поджигании на воздухе спокойно сгорает голубым пламенем. Но если метан предварительно перемешался с воздухом, наверняка произойдёт взрыв. Именно поэтому при утечке газа запрещается включать и выключать электроприборы, так как при срабатывании выключателя между контактами проскакивает искра.
Метан почти не растворяется в воде и лишён окраски и запаха. Газ, поступающий по трубам в газовые плиты, пахнет благодаря добавкам специальных веществ (одорантов), позволяющих быстро обнаружить утечку газа по запаху.
В химическом отношении метан — весьма инертное вещество, потому что связи C—H в его молекуле прочны и малополярны. При обычных условиях он почти ни с чем не взаимодействует, однако при небольшом нагревании вступает в реакцию с кислородом (сгорает), а под действием света реагирует с наиболее активными галогенами:
CH4 + Cl2 ![]() CH3Cl + HCl
CH3Cl + HCl
Очень сильное нагревание приводит к термическому разложению метана — пиролизу:
2CH4 ![]() HC≡CH + 3H2
HC≡CH + 3H2
Большое промышленное значение имеет конверсия метана — взаимодействие с водяным паром при высокой температуре:
CH4 + H2O ![]() CO + 3H2
CO + 3H2
Образующаяся смесь угарного газа и водорода — синтез-газ — является сырьём для получения многих органических веществ.
Этан — следующий углеводород ряда алканов. В его молекуле два атома углерода, поэтому структурная формула этана CH3—CH3:
Пространственная модель молекулы этана
Во многом этан подобен метану: состав близок, в молекуле содержатся такие же связи C—H. И действительно, этан — горючий газ без цвета и запаха, плохо растворим в воде, химически малоактивен, взаимодействует с хлором на свету:
CH3—CH3 + Cl2 ![]() CH3—CH2Cl + HCl
CH3—CH2Cl + HCl
Однако есть и отличия: молекулярная масса этана выше, поэтому выше температура кипения (—89°C); наличие же связи C—C позволяет этану участвовать в реакции дегидрирования без изменения углеродного скелета:
CH3—CH3 ![]() CH2═CH2 + H2
CH2═CH2 + H2
Пропан — алкан, углеродный скелет которого содержит три атома углерода. Поскольку углеродная цепь не должна быть замкнутой, два из трёх атомов будут находиться на концах цепи, а третий — в середине: CH3—CH2—CH3.
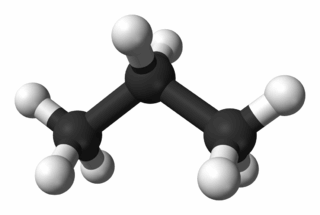
Пространственная модель молекулы пропана
Пропан «наследует» свойства этана, только температура кипения пропана ещё выше (—42°C), а взаимодействие с хлором даёт уже два продукта (замещение идёт как на центральном атоме углерода, так и на крайнем).
Обратите внимание: структурно пропан отличается от этана появлением звена —CH2— в середине молекулы, и точно таким же звеном отличается этан от метана. Оказывается, что принцип «наследования» свойств при появлении в углеродном скелете нового звена —CH2— соблюдается для самых разных органических веществ. Такие «родственные» друг другу вещества называются гомологами, отличающее их звено —CH2— называетсягомологической разностью, а всё семейство родственных соединений — гомологическим рядом. Все члены такого ряда отличаются друг от друга по молекулярному составу на целое число звеньев —CH2—, поэтому можно вывести общую молекулярную формулу для всех членов гомологического ряда. В частности, состав любого алкана подчиняется общей формуле CxH2x+2, где x — натуральное число.
Интересно знать! Факт принадлежности всех алканов одному гомологическому ряду можно доказать строго. Возьмём произвольный алкан, молекула которого содержит x атомов углерода, и заменим любой концевой фрагмент —CH3 на атом водорода. Таким образом мы перейдём к алкану, содержащему на один атом углерода меньше, а состав уменьшится на гомологическую разность. Повторяя эту операцию, рано или поздно мы получим молекулу метана, а из неё — молекулу водорода H2. Итак, мы отняли x раз звено —CH2— и получили H2. Значит, исходный алкан имеет состав CxH2x+2 и является гомологом метана (водород H2 в гомологический ряд не включают).
Оказывается, что среди всех углеводородов только в молекулах алканов соотношение H:C по числу атомов превышает 2:1. Благодаря этому алканы отличаются от остальных углеводородов тем, что массовая доля водорода в них превышает 1/7 ≈ 14.3%, а при полном сгорании алкана воды образуется большее количество моль, чем углекислого газа. Это позволяет легко определить состав алкана CxH2x+2 по продуктам полного сгорания при решении задач:
![]()
Бутан содержит четырёхатомный углеродный скелет и имеет молекулярную формулуC4H10. Однако четыре атома углерода можно соединить уже двумя способами: либо в линейную цепь, либо в разветвлённую. В результате получается два вещества одного и того же молекулярного состава, но с разной структурой, — два структурных изомера:
|
|
|
Пространственные модели молекул бутана (tкип = —1°C) и изобутана (tкип = —12°C)
Изомер с разветвлённым скелетом был назван изобутаном. За счёт более компактной структуры межмолекулярное взаимодействие в нём слабее и температура кипения ниже. Отличаются изомеры и по химическим свойствам; более того, изобутан можно получить из бутана:
CH3CH2CH2CH3 ![]() (CH3)3CH
(CH3)3CH
Дальнейшее увеличение числа атомов углерода приводит к росту количества возможных изомеров и плавному изменению физических свойств. Алканы, содержащие от 5 до 10 атомов углерода в молекуле, представляют собой, как правило, бесцветные горючиежидкости с характерным запахом, хорошо растворимые друг в друге и в неполярных органических растворителях, но не смешивающиеся с водой (алканы всплывают на её поверхность). При ещё большем увеличении молекулярной массы растут температуры плавления и кипения, уменьшается летучесть и ослабевает запах. Например, алканы диапазона C18 — C35 входят в состав твёрдого парафина, из которого делают свечи.
Получать алканы проще всего из нефти и природного газа, где они содержатся в большом количестве. Из химических способов получения наиболее распространённым является гидрирование ненасыщенных ациклических углеводородов при нагревании на никелевом катализаторе.
Вопросы для закрепления теоретического материала к лабораторной работе
Какие органические соединения относятся к алканам?
Что такое гомологи и изомеры
Чем обусловлены основные свойства алканов?
Реакции горения алканов?
Задания для лабораторной работы:
Задание № 1. Определить содержание водорода и углерода в парафинах
Задание № 2. Определить содержание хлора в хлороформе
Инструкция по выполнению лабораторной работы
Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
Выполните опыт № 1 определение качественного состава парафина
Зажгите газовую горелку (спиртовку). Подержите 2—3 с над пламенем сухой стакан в перевернутом состоянии. Почему запотел стакан?
Смочите (сполосните) стакан раствором гидроксида кальция и снова в таком же состоянии подержите над пламенем. Объясните причину появления белых пятен на стенках стакана.
На основании обнаруженных воды и оксида углерода (IV) сделайте вывод о качественном составе Crоревшего вещества.
2. Зажгите парафиновую свечу и аналогичным путем установите качественный состав парафина. Проведите опыт по обнаружению свободного углерода в пламени свечи.
Составьте уравнение реакции горения парафина свечи, приняв, что в его молекуле содержится 16 атомов углерода.
Примечание: опыты 1 или 2 проводятся по выбору.
3. Соберите прибор, как указано на рисунке 22.5, и испытайте его на герметичность.

. В сухую пробирку поместите 2— 2,5 г оксида меди и немного вазелина, чтобы его хватило только для пропитки подогретого оксида меди (II). Закрепите пробирку в штативе горизонтально и внесите в нее не более 0,5 г сульфата меди (II), разместив около отверстия пробирки. Закройте пробирку пробкой с газоотводной трубкой, конец которой
опустите в пробирку с известковой водой. Нагревайте пламенем горелки (спиртовки) смесь оксида меди (II) с вазелином.
Наблюдайте, какие изменения происходят с известковой водой. По окончании опыта, прежде чем погасить пламя горелки, поднимите вверх лапку штатива с прибором и выньте газоотводную трубку из пробирки. (Почему это надо проделать?)
На основании результатов опыта сделайте вывод о качественном составе вазелина. Составьте уравнение реакции полного окисления оксидом меди предельного углеводорода, в состав которого входит 16 атомов углерода
Методика анализа результатов, полученных в ходе лабораторной работы
Используя инструкцию по выполнению лабораторной работы, проведите опыты, соблюдая правила техники безопасности при работе в кабинете химии.
Следующий опыт следует начинать только после полного разбора предыдущего опыта.
Порядок выполнения отчёта по лабораторной работе
В тетради для практических занятий и лабораторных работ напишите номер, название и учебную цель работы.
Ответьте на вопросы для закрепления теоретического материала к лабораторной работе.
Выполните опыты № 1, согласно инструкции по выполнению лабораторной работы. Запишите наблюдения в таблицу.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с
учебными задачами лабораторной работы и реализованы ли образовательные результаты, заявленные во ФГОС третьего поколения.
Образец отчёта по лабораторной работе
Лабораторная работа № 11 «качественное определение углерода, водорода в органических соединениях».
Учебная цель: формировать умения проводить наблюдения и делать выводы, записывать уравнения соответствующих реакций в молекулярном и ионном видах.
Ответы на вопросы для закрепления теоретического материала
к лабораторной работе
………………………………………………………………………………………………………
……………………………………………………………………………………………………....
………………………………………………………………………………………………………
………………………………………………………………………………………………………
……………………………………………………………………………………………………....
| Название опыта | Рисунок того что делаете | Наблюдения и их объяснения | Уравнения реакций |
| Определение состава оргнических соединений |
|
|
|
Вывод: Выполнив задания лабораторной работы я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2011
Название лабораторной работы № 12 «Решение экспериментальных задач на получение и распознавание органических соединений. (Синтез бромэтана из спирта)».
Учебная цель: повторить метод получения алкилгалогенидов из спирта, механизм этого процесса и способы смещения химического равновесия на примере лабораторного эксперимента.
Учебные задачи:
1. Познакомиться со способом непрямого галогенирования спиртов.
2. Научиться выделять полученный продукт из реакционной массы.
3. Развивать умение формулировать выводы из проделанной работы.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: получения галогенуглеводородов;
уметь: обращаться с химической посудой, реактивами;
знать: способы получения и химические свойства спиртов и галогенуглеводородов, способы утилизации отработанных реактивов;
владеть: навыками работы со справочной литературой.
Задачи лабораторной работы:
Повторить теоретический материал по теме лабораторной работы.
Ответить на вопросы для закрепления теоретического материала.
Провести опыты.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Колба химическая круглодонная (50 мл), газоотводная трубка-холодильник (2 прямые трубки с пробкой и резиновым шлангом), химический стакан, делительная воронка в железном штативе на демонстрационном столе, железный штатив с кольцом, лапкой, асбестовой сеткой, спиртовая горелка, спички, водяная баня (электрическая), штатив с пробирками, санитарная склянка, промывная склянка с дистиллированной водой (80 мл); охлаждающая смесь (H2O, лед, NaCl); С2Н5ОН (этанол), H2SO4 (конц.), H2O (дистил.), KBr (крист., 5 г).
Краткие теоретические и учебно-методические материалы
по теме лабораторной работы
Реакция спиртов с галогеноводородами обратимая:
R–OH + H–Hal ![]() R–Hal + H2O.
R–Hal + H2O.
Щелочная среда (рН 7) способствует сдвигу равновесия влево за счет связывания
Н–Наl, а кислая среда (рН
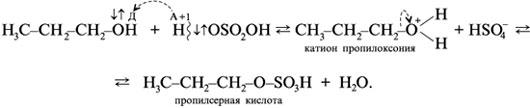
Синтез галогенуглеводородов может быть осуществлен из алканов (по радикальному механизму), из алкенов (по механизму радикального или электрофильного присоединения), из ароматических углеводородов (электрофильным замещением), из спиртов (нуклеофильным замещением гидроксила), взаимодействием карбонильных соединений с галогенидами фосфора, тионилом, фосгеном. В реакциях нуклеофильного замещения реакционная способность спиртов изменяется следующим образом: в третичных спиртах гидроксил замещается легче, чем во вторичных, а вторичные спирты более реакционноспособные, чем первичные.
Электрофильное присоединение к алкенам протекает по правилу Марковникова, радикальное – против правила Марковникова. В реакциях радикального замещения наиболее активный атом водорода у третичного атома углерода. Бромистый этил и другие галогенуглеводороды применяют в органическом синтезе для алкилирования. Галогеналкилы вступают в реакцию со многими классами органических соединений и поэтому нашли применение как в промышленном, так и в препаративном синтезе. В лабораторных условиях галогеналкилы часто получают нуклеофильным замещением гидроксила в спирте на галоген.
Для получения бромистого этила применяют этиловый спирт:
t
C2H5OH + KBr + H2SO4 → C2H5Br + KHSO4 + H2O
При этом также протекают и побочные реакции:
t
2HBr + H2SO4 t → Br2 + 2H2O + SO2↑,
t
CH3CH2OSO3H + HOCH2CH3 → H2SO4 +CH3CH2OCH2CH3
Вопросы для закрепления теоретического материала к лабораторной работе:
Какие меры техники безопасности следует соблюдать при получении бромэтана?
Сформулируйте правила образования названий спиртов и галогенуглеводородов по рациональной номенклатуре и номенклатуре ИЮПАК. Приведите примеры.
Укажите особенности строения молекул этилового спирта и бромэтана.
Напишите уравнения реакции получения всеми возможными способами: а) этилового спирта; б) глицерина; в) бромэтана; г) 1,2-дихлорэтана.
Охарактеризуйте химические свойства спиртов (на примере этилового спирта и глицерина). Приведите уравнения реакций, укажите условия: а) окисления; б) дегидратации; в) кислотно-основные свойства.
Охарактеризуйте химические свойства галогенуглеводородов (на примере бромэтана). Приведите уравнения реакций и укажите условия: а) взаимодействия с металлическим натрием, магнием; б) реакций нуклеофильного замещения; в) дегидрогалогенирования.
Укажите области применения галогенуглеводородов и спиртов.
Предложите реакции, при помощи которых можно обнаружить и разделить смесь первичного и многоатомного спиртов.
Предложите реакции, при помощи которых можно обнаружить и разделить смесь моногалогенуглеводорода и полигалогенуглеводородов (бромэтана и 1,2-дихлорэтана).
Предложите схему получения этилового спирта и бромэтана из неорганических веществ.
Задания для лабораторной работы:
Задание 1. Рассмотреть обратимую реакцию спиртов с галогеноводородами и объяснить сдвиг химического равновесия с точки зрения принципа Ле Шателье на следующих примерах:
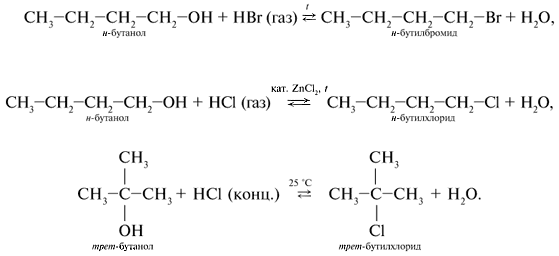
Пояснить большую реакционноспособность бромоводорода, чем хлороводорода, и третичных спиртов, чем первичных, учитывая характер химических связей, строение веществ и взаимное влияние атомов.
Задание 2. Галогеноводороды используют для синтеза различных углеводородов. Привести конкретные примеры получения из 1-бромпропана: а) н-гексана (указать именную реакцию);
б) пропена; в) пропана. Записать соответствующие уравнения реакций, используя структурные формулы веществ.
Инструкция по выполнению лабораторной работы
О
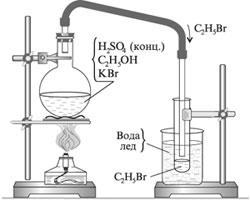 знакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
знакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.Проведите опыт №1 Синтез бромистого этила.
- В круглодонную колбу налейте 40 см3 этилового спирта, 35 см3 воды и осторожно, небольшими порциями 75 см3 концентрированной серной кислоты.
- Раствор охладите под струей воды до комнатной температуры, перемешивая его вращательными движениями.
- Затем небольшими порциями (через воронку, чтобы не загрязнить горловину колбы) всыпьте тонко растертый порошок бромистого калия. Разбавление спирта и измельчение бромистого калия необходимо проводить при охлаждении (лед) для избежания побочной реакции, протекающей с выделением брома и диоксида серы.
- К колбе присоедините дефлегматор, холодильник Либиха и алонж. Конец алонжа опустите в коническую колбу, в которую налейте воды и поместите кусочки льда. Конец алонжа погрузите в воду на 2-3 см.
- Реакционную смесь нагрейте на песчаной бане.
3. Проведите опыт № 2 Выделение и очистка бромистого этила.
- Содержимое конической колбы-приемника перенесите в делительную воронку, предварительно проверьте герметичность крана.
- Нижний слой бромистого этила слейте из воронки в приемник.
- Для осушки добавьте прокаленный хлористый кальций.
- Колбу закройте пробкой с хлоркальциевой трубкой. Сушите в течение 20 мин.
- Затем бромистый этил отделите от хлористого кальция фильтрованием и перегоните.
- Температура кипения чистого бромистого этила 38°С. Полученный бромистый этил может содержать примеси диэтилового эфира и спирта. Для освобождения от спирта и эфира бромистый этил можно промыть серной кислотой. Необходимость в такой операции можно определить хроматографически.
4. Проведите опыт № 3 Качественное определение галогеналкина.
- Каплю пробы прибавьте к 2 см3 2% раствора нитрата серебра в этиловом спирте. Если не будет заметно никакой реакции по истечении 5 мин стояния при комнатной температуре, то раствор подогрейте до кипения и обратите внимание на образование и цвет осадка.
- Затем прибавьте две капли разбавленной 5 % азотной кислоты и наблюдайте, растворился ли осадок. Галогениды серебра не растворяются в разбавленной азотной кислоте.
5. Проведите опыт № 4 Определение галогенпроизводных раствором йодистого натрия в ацетоне.
- Две капли пробы прибавьте к 2 см3 ацетонового раствора йодида натрия. Для приготовления реактива необходимо 5 г йодида натрия растворить в 100 г чистого ацетона.
- Пробирку встряхните и раствору дайте постоять 3 мин при комнатной температуре. Обратите внимание на то, образовался ли осадок и принял ли раствор красно-бурую окраску вследствие выделения свободного йода.
Методика анализа результатов, полученных в ходе лабораторной работы
Опыт №1. Правильность сборки установки проверяет преподаватель или лаборант. В случае сильного вспенивания из-за развития побочных реакций нагрев смеси уменьшают. После выделения основной части бромистого этила в колбе создаётся разрежение, и вода через алонж из приёмника поднимается в холодильник и может попасть в колбу с нагретой серной кислотой. Необходимо быть внимательным при проведении синтеза, и в случае подъема жидкости в алонже сдвинуть его с холодильника. В колбе создастся атмосферное давление, и жидкость опустится. После этого ставят алонж в первоначальное положение и продолжают работу. Реакцию ведут до прекращения выделения маслянистых капель бромистого этила.
Для уменьшения потери продукта необходимо соблюдать условия проведения реакции.
Опыт №3 Таким методом не могут быть обнаружены галогенарилы, галогенвинилы, четыреххлористый углерод.
Опыт №4 Галоидные винилы и арилы не могут быть обнаружены этой реакцией и некоторые аналогичные по строению соединения.
Порядок выполнения отчёта по лабораторной работе
В тетради для практических занятий и лабораторных работ напишите номер, название и учебную цель работы.
Ответьте на вопросы для закрепления теоретического материала к лабораторной работе.
Выполните опыты № 1,2, 3, 4 согласно инструкции по выполнению лабораторной работы.
Заполните таблицу.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с
учебными задачами лабораторной работы и реализованы ли образовательные результаты,
заявленные во ФГОС третьего поколения.
Образец отчёта по лабораторной работе
Лабораторная работа № 12 «Синтез бромэтана из спирта».
Учебная цель: повторить метод получения алкилгалогенидов из спирта, механизм этого процесса и способы смещения химического равновесия на примере лабораторного эксперимента.
Ответы на вопросы для закрепления теоретического материала
к практическому занятию
………………………………………………………………………………………………………
……………………………………………………………………………………………………....
………………………………………………………………………………………………………
………………………………………………………………………………………………………
……………………………………………………………………………………………………....
………………………………………………………………………………………………………
………………………………………………………………………………………………………
……………………………………………………………………………………………………....
………………………………………………………………………………………………………
………………………………………………………………………………………………….
| Порядок работы | Задания | Наблюдения и выводы |
|
|
|
|
Вывод: Выполнив задания лабораторной работы я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2005.
Название практического занятия №13 «Исследование свойств термопластичных полимеров».
Учебная цель: формировать умения работать в химической лаборатории, самостоятельно определять ход работы.
Учебные задачи:
Научиться различать термопластичные полимеры друг от друга по продуктам горения, по отношению к кислотам, щелочам, бромной воде и раствору перманганата калия.
Закрепить умения самостоятельно проводить химические эксперименты.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: исследования свойств разных термопластичных полимеров;
уметь: проводить качественные реакции на распознавание полимеров, давать называния различным видам полимеров ;
знать: отличительные свойства органических полимеров друг от друга и других соединений;
владеть: технологией проведения экспериментов по определению свойств и видов полимеров.
Задачи практического занятия:
Повторить теоретический материал по теме практического занятия.
Ответить на вопросы для закрепления теоретического материала.
Исследовать свойства термопластичных полимеров.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Прокладка огнезащитная керамическая, щипцы тигельные (или пинцет), штатив для пробирок, пробирки ПХ -14 (16–20 шт), стеклянная палочка, спиртовка, спички, промывалка, сосуд для отходов, пипетки (или стеклянные трубочки с оплавленными краями, диаметр трубки 2-3 мм, длина 100-120 мм) - 4 шт., гранулы (или кусочки): полиэтилена, поливинилхлорида, полистирола, полиметилметакрилата; раствор гидроксида натрия (5%), раствор серной кислоты (1:5), раствор перманганата калия (розовый), бромная (или йодная вода), дистиллированная вода.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Пластмассами называют материалы, изготовляемые на основе полимеров. Пластмассы,
сочетают в себе разнообразные ценные качества, такие как лёгкость, прочность, химическая
стойкость и др., которые обусловили проникновение их в различные отрасли народного хозяйства. Кроме полимеров (их часто называют смолой) в пластмассах почти всегда содержатся другие компоненты, придающие материалу определённые качества. Полимерное вещество является для них связующим.
В пластмассы входят наполнители (древесная мука, ткань, асбест, стекловата и др.), которые улучшают их механические свойства.
Пластификаторы – повышают эластичность, устраняют хрупкость.
Стабилизаторы – способствуют сохранению свойств пластмасс в процессе их переработки и использования; красители придают необходимую окраску.
Обычные способы получения полимеров – это реакции полимеризации, лежащие в основе получения термопластичных пластмасс, и реакции поликонденсации, лежащие в основе получения термореактивных пластмасс.
Термопластичные полимеры при нагревании размягчаются и в этом состоянии легко изменяют форму, которую сохраняют при охлаждении. При следующем нагревании они снова размягчаются и могут принимать новую форму.
Термореактивные полимеры при нагревании сначала становятся пластичными, при дальнейшем нагревании утрачивают пластичность, становятся неплавкими. Повторно переработать такой полимер в новое изделие невозможно.
Наиболее типичными способами получения изделий из термопластичных пластмасс является литьё под давлением и экструзия (выдавливание), а из термореактивных пластмасс – горячее прессование.
Краткая характеристика некоторых пластмасс
Полиэтилен – твёрдый, жирный на ощупь, белого цвета термопластичный полимер. Стоек по отношению к агрессивным средам. Благодаря высокой температуре плавления, обладает существенными преимуществами перед другими материалами (полиэтиленом, полиметилметакрилатом, поливинилхлоридом), близким по свойствам.
Полипропилен идёт на изготовление высокопрочной изоляции, труб, деталей машин, химической аппаратуры. Благодаря высокой механической прочности, его используют для изготовления канатов, сетей, технических тканей.
Поливинилхлорид – обладает большой химической стойкостью, хорошими электроизоляционными свойствами и большой механической прочностью. Термопластичный полимер, на его основе изготавливают два вида пластмасс: винипласт, обладающий значительной жесткостью и пластикат – более мягкий материал.
Винипласт идёт на изготовление химически стойкой аппаратуры, ванн для никелирования, жестких плёнок. Пластикат используется для изоляции, для производства предметов широкого потребления (плащей, сумок, линолеума, клеенок, для получения материалов, заменяющих кожу – в производстве обуви).
Полистирол – стоек, к действию кислот и щелочей (кроме концентрированной азотной кислоты), обладает очень хорошими электроизоляционными свойствами, термопластичен. Его применяют в электротехнике, радиотехнике, а также в быту (посуда, шкатулки, пуговицы и др.)
Пенополистирол – лёгкий и прочный материал, имеет широкое применение в строительстве, в вагоностроении, самолётостроении, судостроении; в качестве изоляции в холодильниках, в переправочных спасательных средствах.
Получают поропласты путём нагревания высокомолекулярной смолы (полистирола и др.) с веществом, размягчающимся при высокой температуре (например, с карбонатом аммония). При нагревании образуется газ, вспенивающий смолу, которая после охлаждения остаётся пронизанной мелкими порами, в результате чего полученный материал становится легче воды и является прекрасным тепло- и звуко- изолятором.
Полиметилметакрилат – за свою прозрачность называется органическим стеклом. Обладает удовлетворительной прочностью и значительно меньшей хрупкостью, чем обычное силикатное стекло, способностью пропускать ультрафиолетовые лучи. Термопластичный полимер, находит применение в строительстве, в часовом деле, различных отраслях промышленности и в быту.
Фенолформальдегидная смола – обычно используется в смеси с наполнителями, красителями и т.п., а затем уже производят формование изделий способом горячего прессования. Термореактивный полимер. Введение различных наполнителей позволяет получить материалы, имеющие ценные свойства. Так текстолит и стеклотекстолит, армированные текстильными тканями и стеклотканью, по прочности близки к дюралюминию и стали.
Текстолит – хлопчатобумажная ткань, пропитанная фенолформальдегидной смолой и спрессованная при повышенной температуре. Устойчив к нагрузкам. Легко поддаётся механической обработке. Применяется для изготовления шарикоподшипников, шестерёнки для машин, предусмотренных для больших нагрузках.
Стеклотекстолит – стеклянная ткань и стеклянное волокно, пропитанные фенолформальдегидной смолой и спрессованные. Механически и коррозионноустойчивый материал. Применяют для изготовления деталей больших размеров (автоцистерны, кузова автомобилей и т.д.)
Вопросы для закрепления теоретического материала к практическому занятию:
Дайте определения следующим понятиям: полимеры, структурное звено, степень полимеризации.
В чем разница между реакциями полимеризации и поликонденсации?
Какие полимеры называются термопластичными?
Какие полимеры называются термореактивными?
Дайте классификацию волокон.
Задания для практического занятия:
Задание № 1. Исследовать свойства термопластичных полимеров.
Задание № 2. Составить формулы полимеров.
Задание № 3. Составить уравнения соответствующих реакций.
Инструкция по выполнению практического занятия
Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
Выполните опыт № 1 Исследование термопластичности полимеров:
- Зажмите в тигельных щипцах (или пинцетом) гранулу (кусочек) полиэтилена и подержите его над пламенем горелки. Что наблюдаете?
- Положите нагретый полиэтилен на керамическую прокладку (при отсутствии керамической прокладки можно использовать кусочки кафельной плитки) и с помощью стеклянной палочки (свободным от наконечника концом) попытайтесь изменить его форму. Меняется ли она?
- Попытайтесь изменить форму гранулы после остывания. Удалось ли это?
- Проведите подобные исследования с образцами поливинилхлорида, полистирола, полиметилметакрилата.
Внимание! Нагревание образцов проводить осторожно (под пламенем спиртовки до появления изменений). Не доводить до разложения.
Сделайте выводы.
Выполните опыт № 2 Исследование горючести полимеров:
- Зажмите в тигельных щипцах или с помощью пинцета кусочек (гранулу) полиэтилена, внесите его в пламя спиртовки и держите до загорания полиэтилена.
- Удалите щипцы с гранулой полиэтилена из пламени. Продолжает ли полиэтилен гореть вне пламени?
- Исследуйте горючесть поливинилхлорида, полистирола, полиметилметакрилата, обратите внимание на характер их горения в пламени горящих полимеров.
Сделайте выводы.
Выполните опыт № 3 Отношение полимеров к растворам кислот и щелочей:
- Разместите в штативе для пробирок 8 пробирок ПХ-14 (в два ряда).
- Налейте в четыре пробирки первого ряда по 1-2 мл (20 – 40 капель) раствора серной кислоты (1:5).
- Поместите в пробирки поочерёдно по грануле (кусочку) полиэтилена, поливинилхлорида, полистирола, полиметилметакрилата.
- Налейте в четыре пробирки второго ряда по 1-2 мл (20 – 40 капель) раствора гидроксида натрия (5%) и поместите в них по грануле (кусочку) вышеперечисленных полимеров.
Для вливания в пробирки растворов кислот и щелочей используйте пипетки или стеклянные трубочки. При использовании трубочек, их следует опускать в склянки с растворами кислот.
5. Выполните опыт № 4 Отношение полимеров к бромной воде и раствору перманганата калия:
- Освободите штатив от использованных пробирок и разместите в нём 8 чистых пробирок в 2 ряда.
- Налейте в 4 пробирки первого ряда 1-2 мл бромной воды.
- Поместите в них поочерёдно по грануле (кусочку) полиэтилена, поливинилхлорида, полистирола, полиметилметакрилата налейте в 4 пробирки второго ряда по 1-2 мл розового раствора перманганата калия. Поместите в них по грануле (кусочку) перечисленных выше полимеров.
- Оставьте полимеры в растворах поочерёдно встряхните пробирки с содержимым. Что наблюдаете? Произошли ли какие либо изменения с бромной водой и раствором перманганата калия? Сделайте выводы.
- Оставьте содержимое всех пробирок на 8-10 минут.
- Слейте (спустя 8-10 минут) растворы кислоты и щелочи из пробирок с полимерами в сосуд для отходов.
- Промойте тщательно образцы дистиллированной водой из промывалки и слейте воду после промывки в сосуд для отходов. Что наблюдаете? Произошли ли какие либо изменения с образцами?
Сделайте выводы.
* при отсутствии бромной воды можно использовать йодную воду: растворить в сосуде (пробирке) с водой несколько капель йодной настойки до образования желтого раствора и щелочей до дна. Свободный конец трубочки плотно зажать указательным пальцем. Затем, не отпуская пальца, перенести трубочку с жидкостью в пробирку и, слегка ослабив палец, выпускать жидкость в пробирку по каплям. При необходимости, операцию повторить несколько раз.
Методика анализа результатов, полученных в ходе практического занятия
Для определения продуктов разложения необходимо провести подготовительную работу:
Разместить в штативе для пробирок 8 пробирок и заполнить их по 1-2 мл следующими реактивами: в первом ряду – 3 пробирки с бромной (или йодной) водой, четвёртая с раствором нитрата серебра; во втором ряду – 3 пробирки с раствором перманганата калия, четвёртая с раствором лакмуса или метилоранжа.
Для горения пластмасс использовать тигельные щипцы или пинцет. Горящие пластмассы держать над отверстиями соответствующих пробирок. Для распознавания пластмасс использовать готовую заполненную таблицу
Порядок выполнения отчета по практическому занятию
В тетради для практических занятий и лабораторных работ напишите номер, название и учебную цель занятия.
Ответьте на вопросы для закрепления теоретического материала к практическому занятию.
Выполните опыты № 1, 2, 3, 4, согласно инструкции по выполнению практического занятия. Запишите наблюдения в таблицу.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с
учебными задачами практического занятия и реализованы ли образовательные результаты,
заявленные во ФГОС третьего поколения.
Образец отчета по практическому занятию
Практическое занятие № 13 «Исследование свойств термопластичных полимеров».
Учебная цель: формировать умения работать ив химической лаборатории, самостоятельно определять ход работы
Ответы на вопросы для закрепления теоретического материала
к практическому занятию
………………………………………………………………………………………………………
……………………………………………………………………………………………………....
………………………………………………………………………………………………………
………………………………………………………………………………………………………
……………………………………………………………………………………………………....
| Что делали | Признаки реакции | Уравнение реакции | Выводы |
|
|
|
|
|
Вывод: Выполнив задания практического занятия я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений, 2011
Название лабораторной работы № 14(Вариант 1) «Взаимодействие глюкозы и сахарозы с гидроксидом меди (II). Качественные реакции на крахмал».
Учебная цель: практически познакомиться с важнейшими химическими свойствами глюкозы, сахарозы и крахмала.
Учебные задачи:
Провести эксперимент, соблюдая правила по технике безопасности.
Записать уравнения химических реакций в молекулярном виде.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: осуществления химических реакций характерных для глюкозы, сахарозы и крахмала;
уметь: проводить качественные реакции на распознавание представителей углеводов;
знать: строение молекул, физические и химические свойства, способы получения и применение углеводов;
владеть: навыками экспериментальной работы в химической лаборатории.
Задачи лабораторной работы:
Повторить теоретический материал по теме лабораторной работы.
Ответить на вопросы для закрепления теоретического материала.
Выполнить опыты.
Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Раствор глюкозы, крахмал, растворы CuSO4 и NaOH, раствор йода (I2), кусочек чёрного хлеба; штатив с пробирками, прибор для нагревания, держатель, спички.
Краткие теоретические и учебно-методические материалы
по теме лабораторной работы
Углеводы - природные соединения. Являясь основным компонентом пищи, углеводы поставляют большую часть энергии, необходимой для жизнедеятельности. Некоторые углеводы входят в состав нуклеиновых кислот, осуществляющих биосинтез белка и передачу наследственных признаков.
Углеводы широко распространены в природе и играют большую роль в биологических процессах живых организмов и человека. К ним относятся, например, виноградный сахар или глюкоза, свекловичный (тростниковый) сахар или сахароза, крахмал и клетчатка. Название "углеводы" возникло в связи с тем, что химический состав большинства соединений этого класса выражался общей формулой Сn(H2O)m. Дальнейшее исследование углеводов показало, что такое название является неточным. Во-первых, найдены углеводы, состав которых не отвечает этой формуле. Во-вторых, известны соединения (формальдегид СН2О, уксусная кислота С2Н4О2), состав которых хотя и соответствует общей формуле Сn(H2O)m, но по свойствам они отличаются от углеводов.
Углеводы в зависимости от их строения можно подразделить на моносахариды, дисахариды и полисахариды.
В молекулах моносахаридов может содержаться от четырех до десяти атомов углерода. Названия всех групп моносахаридов, а также названия отдельных представителей оканчиваются на - оза. Поэтому в зависимости от числа атомов углерода в молекуле моносахариды подразделяют на тетрозы, пентозы, гексозы и т. д. Наибольшее значение имеют гексозы и пентозы.
Классификация углеводов
| Простые (не подвергаются гидролизу) | Сложные (подвергаются гидролизу) | |
| Моносахариды | Олигосахариды (Дисахариды) | Полисахариды |
| Глюкоза С6Н12О6 Фруктоза С6Н12О6 Рибоза С5Н10О5 | Сахароза (дисахарид) С12Н22О11 | Крахмал (С6Н10О5)n Целлюлоза (С6Н10О5)n |
Глюкоза C6H12O6, химическое строение глюкозы можно выразить формулой:
O
//
CH2OH - CHOH - CHOH - CHOH - CHOH - C
\
H
Вывод: глюкоза - многоатомный альдегидоспирт. Изомер глюкозы - фруктоза - кетоноспирт.
В водном растворе глюкозы находятся в динамическом равновесии три изомерные формы: α-форма, альдегидная и β-форма.
К дисахаридам относятся: сахароза (сахар), мальтоза, лактоза. Все они имеют молекулярную формулу С12Н22О11. Часто сведения о строении веществ можно получить путём расщепления - гидролиза молекул. Анализ продуктов гидролиза позволяет обнаружить фруктозу и глюкозу. (Молекулы сахарозы состоят из остатков α-глюкозы и β-фруктозы).
Крахмал - полисахарид. Это белый аморфный порошок, не растворимый в воде. В горячей воде крахмальные зёрна набухают и образуют коллоидный раствор, называемый крахмальным клейстером. Крахмал - природное высокомолекулярное соединение, формула (С6Н10О5)n (n - от нескольких сотен до нескольких тысяч). О строении крахмала можно судить по продуктам его гидролиза. Гидролиз обычно проходит постепенно: в начале образуются продукты с меньшей молекулярной массой, чем крахмал, - декстрины, затем дисахарид - мальтоза и, наконец, глюкоза. Схема гидролиза:
(С6Н10О5)n → (С6Н10О5)n-x → C12H22O11 → C6H12O6.
Установлено, что в результате гидролиза крахмала образуется α-глюкоза. Отсюда вывод: макромолекулы крахмала состоят из остатков α - глюкозы. (При неполном гидролизе получается смесь декстринов и глюкозы, называемая патокой).
Вопросы для закрепления теоретического материала к лабораторной работе:
Какие вещества относятся к углеводам, и почему им было дано такое название?
2. Какие химические свойства для глюкозы и глицерина являются общими, и чем эти вещества отличаются друг от друга? Напишите уравнения соответствующих реакций.
3. Составьте уравнения реакций при помощи, которых сахарозу можно превратить в этанол.
Задания для лабораторной работы:
Задание № 1. Определите что общего в свойствах глицерина и глюкозой? Что доказывает опыт с глюкозой? Наличие какой функциональной группы доказывают опыты, к какому классу веществ относится глюкоза.
Задание № 2. Определите конечный продукт ферментативного гидролиза крахмала.
Инструкция по выполнению лабораторной работы
Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
Выполните опыт № 1. Свойства глюкозы и сахарозы.
а) В пробирку внесите 5 капель раствора глюкозы, каплю раствора соли меди (II) и при взбалтывании несколько капель раствора гидроксида натрия до образования светло - синего раствора. Такой опыт проделывали с глицерином.
б) Полученный раствор нагрейте. Что наблюдаете?
3. Выполните опыт №2. Свойства крахмала.
При помощи шпателя поместите в пробирку крахмал и прилейте 2 мл воды. Содержимое взболтать. Далее вылейте небольшими порциями содержимое пробирки (при помешивании) в стакан с 5-6 мл горячей воды. Полученный крахмальный клейстер - коллоидный раствор - использовать для проведения последующих опытов.
а) Качественная реакция на крахмал. К 5-6 каплям крахмального клейстера в пробирке прибавьте каплю спиртового раствора йода.
б) Ферментативный гидролиз крахмала. Под действием пищеварительного фермента амилазы происходит гидролиз крахмала. Хорошо разжеванный маленький кусочек чёрного хлеба пометите в пробирку. Прилейте к нему каплю раствора соли меди (II) и несколько капель раствора NaOH до появления слабо-голубого окрашивания. Содержимое пробирки нагрете.
Методика анализа результатов, полученных в ходе лабораторной работы
Используя инструкцию по выполнению лабораторной работы, проведите опыты, соблюдая правила техники безопасности при работе в кабинете химии.
Следующий опыт следует начинать только после полного разбора преведущего опыта.
Порядок выполнения отчёта по лабораторной работе
В тетради для практических занятий и лабораторных работ напишите номер, название и учебную цель работы.
Ответьте на вопросы для закрепления теоретического материала к лабораторной работе.
Выполните опыты № 1, согласно инструкции по выполнению лабораторной работы. Запишите наблюдения в таблицу. Составьте уравнение реакции глюкозы с гидроксидом меди (II).
Выполните опыты № 2, согласно инструкции по выполнению лабораторной работы. Запишите наблюдения в таблицу.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с
учебными задачами лабораторной работы и реализованы ли образовательные результаты,
заявленные во ФГОС третьего поколения.
Образец отчёта по лабораторной работе
Лабораторная работа № 14 (Вариант 1) «Взаимодействие глюкозы и сахарозы с гидроксидом меди (II). Качественные реакции на крахмал».
Учебная цель: практически познакомиться с важнейшими химическими свойствами глюкозы, сахарозы и крахмала.
Ответы на вопросы для закрепления теоретического материала
к лабораторной работе
………………………………………………………………………………………………………
……………………………………………………………………………………………………....
………………………………………………………………………………………………………
| Название опыта | Рисунок того что делаете | Наблюдения и их объяснения | Уравнения реакций |
| Реакция серебряного зеркала глюкозы
Взаимодействие глюкозы с гидроксидом меди (II) |
|
|
|
| Качественная реакция на крахмал |
|
|
__________________ |
| Взаимодействие сахарозы с гидроксидом меди (II) |
|
|
|
Вывод: Выполнив задания лабораторной работы я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2011.
Название практического занятия № 14 (Вариант 2)«Качественные реакции на белки».
Учебная цель: отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
Учебные задачи:
Познакомиться с важнейшими химическими свойствами белков.
Практически исследовать процессы растворения белка в воде, необратимой денатурации белков.
Познакомиться с качественными реакциями на белки, научиться распознавать их.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен
иметь практический опыт: исследования свойств белка;
уметь: проводить эксперимент, соблюдая правила по технике безопасности;
знать: строение молекул, физические и химические свойства белков;
владеть: навыками экспериментальной работы в химической лаборатории.
Задачи практического занятия:
1. Повторить теоретический материал по теме практического занятия.
2. Ответить на вопросы для закрепления теоретического материала.
3. Выполнить эксперименты.
4. Оформить отчет.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
Тетрадь для практических занятий и лабораторных работ в клетку.
Ручка.
Простой карандаш.
Линейка.
Раствор белка, растворы сульфата меди (II) и щёлочи, азотная кислота, водный раствор аммиака «нашатырный спирт», шерсть; штатив с пробирками, прибор для нагревания, держатель, тигельные щипцы, спички.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Пептиды и белки представляют собой высокомолекулярные органические соединения, построенные из остатков α- аминокислот, соединенных между собой пептидными связями.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д. Как видно, функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником
α- аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают α- аминокислоты. Многие
α- аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белков α- аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми. К ним относятся валин, лейцин, треонин, метионин, триптофан и др. При некоторых заболеваниях человека перечень незаменимых аминокислот расширяется.
Пептиды и белки различают в зависимости от величины молекулярной массы. Условно считают, что пептиды содержат в молекуле до 100 (соответствует молекулярной массе до 10000), а белки - свыше 100 аминокислотных остатков (молекулярная масса от 10000 до нескольких миллионов). При этом в пептидах различают олигопептиды, содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, содержащие до 100 аминокислотных остатков.
| Первичная структура белка - специфическая аминокислотная последовательность, т.е. порядок чередования α- аминокислотных остатков в полипептидной цепи. | |
Вторичная структура белка - конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и CO. Одна из моделей вторичной структуры – спираль.
Третичная структура белка - трехмерная конфигурация закрученной спирали в пространстве, образованная за счет дисульфидных мостиков –S–S– между цистеиновыми остатками и ионных взаимодействий.
Четвертичная структура белка - структура, образующаяся за счет взаимодействия между разными полипептидными цепями. Четвертичная структура характерна лишь для некоторых белков, например гемоглобина.
Химические свойства
1) Денатурация. Утрата белком природной (нативной) конформации, сопровождающаяся обычно потерей его биологической функции, называется денатурацией. С точки зрения структуры белка – это разрушение вторичной и третичной структур белка, обусловленное воздействием кислот, щелочей, нагревания, радиации и т.д. Первичная структура белка при денатурации сохраняется. Денатурация может быть обратимой (так называемая, ренатурация) и необратимой. Пример необратимой денатурации при тепловом воздействии – свертывание яичного альбумина при варке яиц.
2) Гидролиз белков – разрушение первичной структуры белка под действием кислот, щелочей или ферментов, приводящее к образованию α - аминокислот, из которых он был составлен.
3) Качественные реакции на белки:
a) Биуретовая реакция – фиолетовое окрашивание при действии солей меди (II) в щелочном растворе. Такую реакцию дают все соединения, содержащие пептидную связь.
б) Ксантопротеиновая реакция – появление желтого окрашивания при действии концентрированной азотной кислоты на белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина).
Вопросы для закрепления теоретического материала к практическому занятию:
Что такое денатурация? Укажите условия денатурации белковых молекул.
Какие группы атомов и типы связей наиболее характерны для большинства белковых молекул?
Как можно доказать наличие белков в продуктах питания , в шерстяных и шёлковых тканях?
Какие вещества образуются при гидролизе белков в организме?
Чем отличается гидролиз белков от гидролиза полисахаридов?
Задания для практического занятия:
Задание № 1. Проведите эксперименты.
Задание № 2. Запишите, что наблюдали во время экспериментов.
Инструкция по выполнению практического занятия
Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
Выполните эксперименты. Свойства белков:
а) В пробирку налейте 2 мл раствора белка и добавьте 2 мл раствора щелочи, а затем несколько капель раствора медного купороса (сульфата меди (II)).
б) В пробирку с 2 мл раствора белка добавьте несколько капель азотной кислоты. Нагрейте содержимое пробирки. Охладите смесь и добавьте к ней по каплям 2–3 мл нашатырного спирта.
в) Подожгите несколько шерстяных нитей. Охарактеризуйте запах горящей шерсти.
г) К 3–4 мл раствора белка в воде добавьте несколько капель раствора медного купороса (сульфата меди (II)).
Методика анализа результатов, полученных в ходе практического занятия
Используя инструкцию по выполнению практического занятия, проведите эксперименты, соблюдая правила техники безопасности при работе в кабинете химии.
Следующий эксперимент следует начинать только после полного разбора предыдущего эксперимента.
Порядок выполнения отчёта по практическому занятию
В тетради для практических занятий и лабораторных работ напишите номер, название и учебную цель занятия.
Ответьте на вопросы для закрепления теоретического материала к практическому занятию.
Выполните эксперименты, согласно инструкции по выполнению практического занятия. Запишите наблюдения в таблицу.
Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с
учебными задачами практического занятия и реализованы ли образовательные результаты,
заявленные во ФГОС третьего поколения.
Образец отчёта по практическому занятию
Практическое занятие № 14 (Вариант 2) «Качественные реакции на белки».
Учебная цель: отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии
Ответы на вопросы для закрепления теоретического материала
к практическому занятию
………………………………………………………………………………………………………
……………………………………………………………………………………………………....
………………………………………………………………………………………………………
………………………………………………………………………………………………………
……………………………………………………………………………………………………....
| Название опыта | Рисунок того что делаете | Наблюдения и их объяснения |
| Растворение белков в воде
|
|
|
| Цветные реакции белков Биуретовая реакция
Ксантопротеиновая реакция |
|
|
| Обнаружение белков в молоке и в мясном бульоне |
|
|
| Денатурация раствора белка куриного яйца
спиртом
растворами солей тяжелых металлов
при нагревании
|
|
|
Вывод: Выполнив задания практического занятия я (см. учебные задачи и образовательные результаты, заявленные во ФГОС третьего поколения).
Список литературы
Габриелян О.С. Химия: учебник для студентов профессиональных учебных заведений –М.,2011.
63
Похожие файлы
object(ArrayObject)#852 (1) {
["storage":"ArrayObject":private] => array(6) {
["title"] => string(144) "Методические рекомендации по выполнению лабораторно- практических работ ПМ. 04"
["seo_title"] => string(80) "metodicheskie_rekomendatsii_po_vypolneniiu_laboratorno_prakticheskikh_rabot_pm_0"
["file_id"] => string(6) "529881"
["category_seo"] => string(7) "prochee"
["subcategory_seo"] => string(5) "testi"
["date"] => string(10) "1575307173"
}
}
object(ArrayObject)#874 (1) {
["storage":"ArrayObject":private] => array(6) {
["title"] => string(281) "Методические рекомендации по выполнению лабораторной работы «Создание таблицы базы данных с использованием конструктора и мастера таблиц в СУБД MS Access" "
["seo_title"] => string(167) "mietodichieskiie-riekomiendatsii-po-vypolnieniiu-laboratornoi-raboty-sozdaniie-tablitsy-bazy-dannykh-s-ispol-zovaniiem-konstruktora-i-mastiera-tablits-v-subd-ms-access"
["file_id"] => string(6) "160478"
["category_seo"] => string(11) "informatika"
["subcategory_seo"] => string(7) "prochee"
["date"] => string(10) "1422056378"
}
}
object(ArrayObject)#852 (1) {
["storage":"ArrayObject":private] => array(6) {
["title"] => string(180) "Методические рекомендации по выполнению самостоятельной работы для обучающихся по заочной форме"
["seo_title"] => string(80) "mietodichieskiie_riekomiendatsii_po_vypolnieniiu_samostoiatiel_noi_raboty_dlia_o"
["file_id"] => string(6) "391234"
["category_seo"] => string(7) "prochee"
["subcategory_seo"] => string(12) "planirovanie"
["date"] => string(10) "1486980800"
}
}
object(ArrayObject)#874 (1) {
["storage":"ArrayObject":private] => array(6) {
["title"] => string(186) "МЕТОДИЧЕСКИЕ УКАЗАНИЯ по выполнению лабораторных и практических работ для студентов по охране труда"
["seo_title"] => string(80) "mietodichieskiie_ukazaniia_po_vypolnieniiu_laboratornykh_i_praktichieskikh_rabot"
["file_id"] => string(6) "449472"
["category_seo"] => string(7) "prochee"
["subcategory_seo"] => string(7) "prochee"
["date"] => string(10) "1515734145"
}
}
object(ArrayObject)#852 (1) {
["storage":"ArrayObject":private] => array(6) {
["title"] => string(212) "Методические рекомендации по выполнению лабораторно-практических работ по учебной дисциплине «Материаловедение»"
["seo_title"] => string(80) "mietodichieskiie_riekomiendatsii_po_vypolnieniiu_laboratorno_praktichieskikh_rab"
["file_id"] => string(6) "411376"
["category_seo"] => string(7) "prochee"
["subcategory_seo"] => string(5) "uroki"
["date"] => string(10) "1493052999"
}
}
Подтверждение авторства
Пожалуйста, введите ваш Email.
Если вы хотите увидеть все свои работы, то вам необходимо войти или зарегистрироваться
Полезное для учителя
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт