13
ГБОУ ПК
«Школа – интернат для детей с нарушением зрения»
г. Пермь
В МИРЕ
ИНДИКАТОРов
| 
|
Реферат выполнил ученик 8 класса Гоголев Сергей
Руководитель: Л.Ю. Захарова, учитель химии
|
2016г.
ОГЛАВЛЕНИЕ
|
| ВВЕДЕНИЕ
| 3 |
| I. | ИСТОРИЯ ОТКРЫТИЯ ИНДИКАТОРОВ
| 4 - 5 |
| II. | ХИМИЧЕСКИЕ ИНДИКАТОРЫ
| 6 - 8 |
| III. | ПРИРОДНЫЕ ИНДИКАТОРЫ
| 9 - 10 |
| IV. | ПРИМЕНЕНИЕ ИНДИКАТОРОВ | 11 - 13 |
| 1 | Биохимическая роль индикаторов и применение в медицине |
|
| 2 | Применение природных индикаторов в народном хозяйстве |
|
| 3 | Применение индикаторов в быту
|
|
| V. | ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ | 14 -18 |
| 1 | Приготовление природных индикаторов из растительного сырья |
|
| 2 | Определение среды некоторых средств бытовой химии с помощью полученного индикатора |
|
| 3 | Определение среды растворов некоторых кисломолочных продуктов
|
|
|
| ЗАКЛЮЧЕНИЕ
| 19 - 20 |
|
| СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ
| 21 |
ВВЕДЕНИЕ
Индикаторы широко используют в химии, в том числе и в школе. Любой школьник, скажет, что такое фенолфталеин, лакмус или метилоранж. При знакомстве с кислотами и основаниями я узнал, что при добавлении того или иного индикатора в кислотную или щелочную среду, растворы меняют свою окраску. Поэтому индикаторы используются для определения реакции среды (кислая, щелочная или нейтральная). Ещё нам рассказали, что соки ярко окрашенных ягод, плодов и цветков обладают свойствами кислотно-основных индикаторов, т. к. тоже изменяют свою окраску при изменении кислотности среды.
Меня заинтересовал вопрос: какие растения могут использоваться в качестве индикаторов? Можно ли приготовить растворы растительных индикаторов самостоятельно? Пригодны ли самодельные индикаторы для использования в домашних условиях, например, для определения среды продуктов питания или средств бытовой химии с целью выявления их негативного влияния на кожу рук? Думаю, актуальность темы заключается в том, что свойства растительных объектов могут быть использованы для применения в разных областях науки, например, таких как химия.
Гипотеза: растворы растительных индикаторов можно приготовить самостоятельно и применять в домашних условиях для определения среды некоторых напитков и растворов моющих средств.
Цель работы: Изучить действие химических и природных индикаторов в различных средах.
Задачи:
- изучить литературные источники по теме;
- рассмотреть классификацию индикаторов;
- сделать определенные выводы по применению индикаторов в быту и природе;
- научиться выделять индикаторы из природного сырья;
- исследовать действие природных индикаторов в различных средах (определить среду растворов некоторых продуктов питания, ягодных соков и растворов моющих средств для посуды).
I. ИСТОРИЯ ОТКРЫТИЯ ИНДИКАТОРОВ
Впервые вещества, меняющие свой цвет в зависимости от среды, обнаружил в XVII веке английский химик и физик Роберт Бойль.Он провел тысячи опытов. Вот один из них. 
В лаборатории горели свечи, в ретортах что-то кипело, когда некстати зашел садовник. Он принес корзину с фиалками. Бойль очень любил цветы, но предстояло начать опыт. Он взял несколько цветков, понюхал и положил их на стол. Опыт начался, открыли колбу, из нее повалил едкий пар. Когда же опыт кончился, Бойль случайно взглянул на цветы, они дымились. Чтобы спасти цветы, он опустил их в стакан с водой. И – что за чудеса - фиалки, их темно-фиолетовые лепестки, стали красными. Случайный опыт? Случайная находка? Роберт Бойль не был бы настоящим ученым, если бы прошел мимо такого случая. Ученый велел готовить помощнику растворы, которые потом переливали в стаканы и в каждый опустили по цветку. В некоторых стаканах цветы немедленно начали краснеть. Наконец, ученый понял, что цвет фиалок зависит от того, какие вещества содержатся в растворе. Затем Бойль заинтересовался, что покажут не фиалки, а другие растения.

Он приготовил для своих опытов водный настой лакмусового лишайника. Склянка, в которой он хранил настой, понадобилась для соляной кислоты. Вылив настой, Бойль наполнил склянку кислотой и с удивлением обнаружил, что кислота покраснела. Заинтересовавшись этим, Бойль на пробу добавил несколько капель настоя лакмуса к водному раствору гидроксида натрия и обнаружил, что в щелочной среде лакмус синеет.
Эксперименты следовали один за другим, проверялись васильки и другие растения, но всё же лучшие результаты дали опыты с лакмусовым лишайником. Так, в 1663 году, был открыт первый индикатор для обнаружения кислот и оснований, названный по имени лишайника лакмусом.
В 1667 году Роберт Бойль предложил пропитывать фильтровальную бумагу отваром тропического лишайника – лакмуса, а также отварами фиалок и васильков.Высушенные и нарезанные «хитрые» бумажки Роберт Бойль назвал индикаторами, что в переводе с латинского означает «указатель», так как они указывают на среду раствора.
Именно индикаторы помогли ученому открыть новую кислоту - фосфорную, которую он получил при сжигании фосфора и растворении образовавшегося белого продукта в воде.
Лакмус стал самым древним кислотно-основным индикатором. Надо сказать, что само красящее вещество лакмус был известен ещё в Древнем Египте и Древнем Риме. Его добывали из некоторых видов лишайников, произраставших на скалах Шотландии, и использовали в качестве фиолетовой краски, но со временем, рецепт его приготовления был утерян. 
В 1640 году ботаники описали гелиотроп – душистое растение с темно-лиловыми цветками, из которого тоже было выделено красящее вещество. Этот краситель наряду с соком фиалоктоже стал широко применяться химиками в качестве индикатора, который в кислой среде был красным, а в щелочной – синим. 
Позже, в серединеXIX века химики научились искусственно синтезировать кислотно–основные индикаторы. Так в 1871 годунемецкий химик-органик Адольф фон Байер, будущий лауреат Нобелевской премии, впервые осуществил синтез фенолфталеина.
В наши дни известны несколько сот кислотно-основных индикаторов, искусственно синтезированных.

II. ХИМИЧЕСКИЕ ИНДИКАТОРЫ
Слово «индикатор»применяется в разных областях человеческой деятельности – механике, математике, биологии, экологии, экономике, в социальных, общественных науках и прочих.
Индикатор (от латинского indicator — указатель) — это прибор, устройство, информационная система, вещество или объект, отображающий изменения какого-либо параметра контролируемого процесса или состояния объекта в форме, наиболее удобной для непосредственного восприятия человеком визуально, акустически, тактильно или другим легко интерпретируемым способом. Мы будем рассматривать только химические индикаторы.
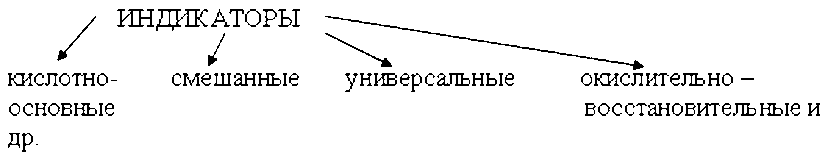
Химические индикаторы - это вещества, изменяющие окраску, люминесценцию или образующие осадок при изменении концентрации какого-либо компонента в растворе. Они бывают природного и химического происхождения. Индикаторы применяют чаще всего для установления конца какой-либо химической реакции или концентрации водородных ионов по легко заметному признаку.Химические индикаторы делят обычно на несколько групп.
В школе используются самые распространенные кислотно – основные индикаторы. Их преимуществом является дешевизна, быстрота и наглядность исследования. Это растворимые органические соединения, которые меняют свой цвет в зависимости от концентрации ионов водорода Н+ (рН среды). Происходит это потому, что в кислой и щелочной среде молекулы индикаторов имеют разное строение. Примером может служить общеизвестный индикатор фенолфталеин. В кислой среде это соединение находится в виде недиссоциированных молекул и раствор бесцветен, а в щелочной среде – в виде ионов и раствор имеет малиновый цвет. Такие индикаторы резко изменяют свой цвет в достаточно узких границах рН.
Универсальные индикаторы – это смеси нескольких индивидуальных индикаторов, подобранных так, что их раствор поочередно меняет окраску, проходя все цвета радуги при изменении кислотности раствора в широком диапазоне рН.
pH - водородный показатель. Это понятие ввёл датский химик Сёренсен для точной числовой характеристики среды раствора и предложил математическое выражение для его определения:
рН = -lg [H+].
Характер среды имеет большое значение в химических и биологических процессах. В зависимости от типа среды эти процессы могут протекать с различными скоростями и в разных направлениях. Поэтому во многих случаях важно как можно более точно определять среду раствора. При рН = 7 – среда нейтральная, при рН 7 – щелочная. Среду исследуемого раствора можно приблизительно определить по окраске индикаторов.
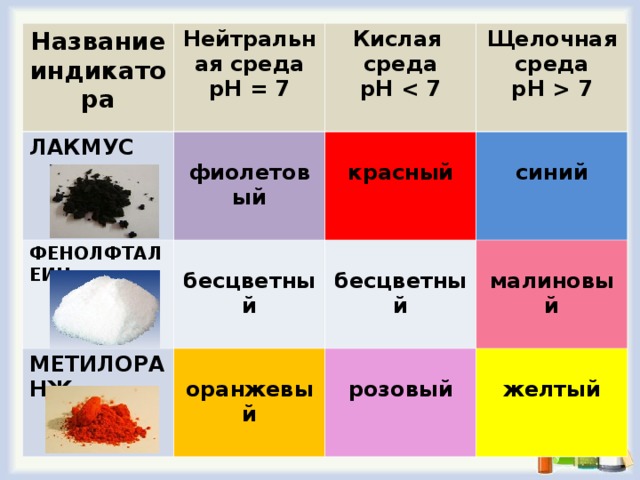
Больше всего распространены индикаторы лакмус, фенолфталеин и метилоранж.
Самым первым появился кислотно-основный индикатор лакмус. Фактически природный лакмус представляет собой сложную смесь.Это порошок черного цвета, растворим в воде, 95 % спирте, ацетоне, ледяной уксусной кислоте. Его основными компонентами являются: азолитмин (C9H10NO5) и эритролитмин (С13H22O6). 
Окраска лакмуса в различных средах изменяется следующим образом:
| Кислота | Щёлочь
| Нейтральная среда |
|
красный |
синий |
фиолетовый |
Фенолфталеин С20Н14О4 (продается в аптеке под названием "пурген") - белый мелкокристаллический порошок, растворим в 95% спирте, но практически не растворим в воде. Применяется в виде спиртового раствора, приобретает в щелочной среде малиновый цвет, а в нейтральной и кислой он бесцветен. 
| Кислота | Щёлочь | Нейтральная среда |
|
бесцветный |
малиновый |
бесцветный |
Метиловый оранжевый, C14H14N3O3SNa, - кристаллический порошок оранжевого цвета, умеренно растворим в воде, нерастворим в органических растворителях. Метилоранж действительно оранжевый в нейтральной среде. В кислотах его окраска становится розово-малиновой, а в щелочах – желтой.
| Кислота | Щёлочь
| Нейтральная среда |
|
розовый |
жёлтый |
оранжевый |
В зависимости от кислотности среды изменяет окраску и краситель бриллиантовый зеленый (его спиртовой раствор используется как дезинфицирующее средство – зеленка). В сильнокислой среде его окраска желтая, а в сильнощелочной среде раствор обесцвечивается.
Помимо кислотно-основных известны и другие типы индикаторов:адсорбционные, комплексонометрические, флуоресцентные, изотопные, окислительно-восстановительные и прочие.
В настоящее время химики часто пользуются универсальной индикаторной бумагой. В основе - смеси индикаторов, позволяющие определить значение рН растворов в большом диапазоне концентраций (1-10; 0-12). Растворами таких смесей - «универсальных индикаторов» обычно пропитывают полоски «индикаторной бумаги», с помощью которых можно быстро (с точностью до десятых долей рН) определить кислотность исследуемых водных растворов. Для более точного определения полученный при нанесении капли раствора цвет индикаторной бумаги немедленно сравнивают с эталонной цветовой шкалой.

III. ПРИРОДНЫЕ ИНДИКАТОРЫ
Кислотно-основные индикаторы бывают не только химическими. Они находятся вокруг нас, только обычно мы об этом не задумываемся. Когда нет настоящих химических индикаторов, то для определения среды растворов можно успешно применять самодельные индикаторы из природного сырья.
Исходным сырьем могут служить цветы герани, лепестки пиона или мальвы, ирис, темные тюльпаны или анютины глазки, а также ягоды малины, черники, черноплодной рябины, соки вишни, смородины, винограда, плоды крушины и черемухи.
Эти природные индикаторы содержат окрашенные вещества (пигменты), способные менять свой цвет в ответ на то или иное воздействие. И, попадая в кислую или щелочную среду, они наглядным образом сигнализируют об этом.
Такими пигментами являются, прежде всего, антоцианы. Они имеют (преимущественно) красный цвет в кислой среде и синий или зеленый - в щелочной. Пример:
|
| Цветы герани | Сок вишни | Сок вишни |
| Раствор щелочи
| голубой |
синий |
синий |
| Раствор кислоты
| розовый |
розовый |
розовый |
Именно антоцианы придают разнообразные оттенки розового, красного, голубого и лилового многим цветам, плодам и осенним листьям. Эта окраска часто зависит от рН клеточного содержимого, и потому может меняться при созревании плодов, отцветании цветков и увядании листьев.
Антоцианы - неустойчивые соединения, в клетках растений обычно содержится несколько различных антоцианов, и проявление их связано с химическим составом почвы и возрастом растения.
Обычный чай – тоже индикатор. Если в стакан с крепким чаем капнуть лимонный сок или растворить несколько кристалликов лимонной кислоты, то чай сразу станет светлее. Если же растворить в чае питьевую соду, раствор потемнеет (пить такой чай, конечно, не следует). Чай же из цветков каркаде дает намного более яркие цвета.
Индикатором являются и обычные чернила, которые под влиянием кислоты изменяют окраску с фиолетовой на зеленую, и вновь приобретают фиолетовую окраску при нейтрализации кислоты щелочью.
Сок столовой свеклы в кислой среде изменяет свой рубиновый цвет на ярко-красный, а в щелочной – на желтый. Зная свойство свекольного сока, можно сделать цвет борща ярким. Для этого к борщу следует добавить немного столового уксуса или лимонной кислоты.
Вот список растений, листья или плоды которых можно использовать для приготовления природных индикаторов.
Виноград красный Вишня, сок ягод Герань розовая, лепестки Голубика, ягоды Гортензия Дельфиниум лепестки Земляника, ягоды Капуста красная, сок Карри порошок (куркума) Конский каштан, листья Луковая шелуха Мак, лепестки Маргаритки, лепестки | |
Находясь летом в отпуске, можно засушить лепестки цветов и ягоды, из которых по мере необходимости готовить растворы, и таким образом обеспечить себя индикаторами.
Соки или отвары ярко окрашенных плодов или других частей растений, используемые в качестве природных индикаторов необходимо хранить в темной посуде. К сожалению, у природных индикаторов есть серьезный недостаток: их отвары довольно быстро портятся – скисают или плесневеют. Поэтому в химических лабораториях используют синтетические индикаторы, резко изменяющие свой цвет в достаточно узких границах рН.
IV. ПРИМЕНЕНИЕ ИНДИКАТОРОВ
Индикаторы позволяют быстро и достаточно точно контролировать состав жидких сред, следить за изменением их состава или за протеканием химической реакции.
Как уже было сказано, в растениях очень много природных пигментов, природных индикаторов, большая часть которых относится к антоцианам.
Так как антоцианы обладают хорошими индикаторными свойствами, то их можно применять как индикаторы для идентификации кислотной, щелочной или нейтральной среды, как в химии, так и в быту. От кислотности среды зачастую зависит и поведение веществ, и характер реакции.
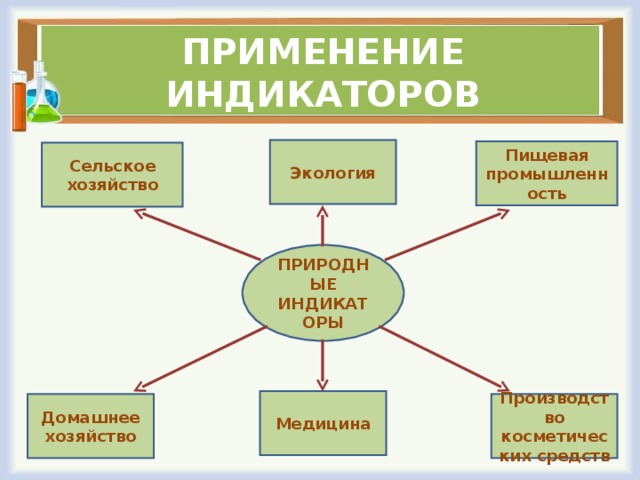
Природные индикаторы находят применение во многих областях человеческой деятельности: в медицине и экологии, в сельском и народном хозяйстве, в пищевой промышленности и в быту.
Так же антоцианы применяются в косметике, т.к. обладают стабилизирующим эффектом и являются коллагенами и в пищевой промышленности в виде добавки E163 в качестве природных красителей. Они применяются в производстве кондитерских изделий, напитков, йогуртов и других пищевых продуктов.
1. Биохимическая роль индикаторов и применение в медицине
Данные последних лет свидетельствуют, что красящие вещества растений выполняют огромную биохимическую роль, обладают многообразными лечебными эффектами и благотворно влияют на организм человека.
Антоцианы являются мощными антиоксидантами, которые сильнее в 50 раз витамина С. Многие исследования подтвердили пользу антоцианов для зрения. Наибольшая концентрация антоцианов содержится в чернике. Поэтому препараты, содержащие чернику, наиболее востребованы в медицине.
Образуя комплексы с радиоактивными элементами, которые губительно действуют на наш организм, антоцианы способствуют быстрому выведению их из организмов. Таким образом, антоцианы являются гарантами долгой и здоровой жизни клеток, а значит, продлевают и нашу жизнь. Они оказывают защитное действие на сосуды, уменьшая их ломкость, помогают снизить уровень сахара в крови.
Поступая в организм человека с фруктами и овощами, антоцианы проявляют действие, схожее с витамином Р, они поддерживают нормальное состояние кровяного давления и сосудов, предупреждая внутренние кровоизлияния. Антоцианы требуются клеткам головного мозга, улучшают память.
Антоцианы обладают уникальными свойствами – подавляют рост опухолей. Так, например недавние исследования показали, что употребление антоцианов в пищу помогает сократить риск заболевания раком пищевода и прямой кишки. Приготовленные из растений, содержащих антоцианы, водные и подкисленные настои в течение нескольких часов уничтожали бактерии дизентерии и брюшного тифа. Антоцианы помогают предотвратить развитие катаракты и в целом оказывают благоприятное воздействие на весь организм. Поэтому овощи и фрукты ярких цветов считаются полезными для организма.
2. Применение природных индикаторов в народном хозяйстве
Кроме медицины антоцианы также используются и в других областях народного хозяйства. Например, в сельском хозяйстве, для оценки химического состава почвы, степени её плодородия, при разведке полезных ископаемых. Добавив в антоциановый раствор горсть земли, можно сделать заключение о ее кислотности, т. к. на одной и той же почве в зависимости от ее кислотности один вид растений может давать высокий урожай, а другие будут угнетенными.
«Или взять хотя бы всем известный картофель. Он имеет различную окраску кожуры, глазков, проростков и мякоти. Различие окраски картофеля зависит от содержащихся в нем пигментов. Окрашенные клубни картофеля, как правило, богаче необходимыми для нашего организма веществами. Так, например, клубни с желтой мякотью имеют повышенное содержание жира, каротиноидов, рибофлавина и комплекса флавоноидов.».
«За счет способности антоцианов менять свою окраску можно наблюдать изменение цвета клубней картофеля в зависимости от применения минеральных удобрений и ядохимикатов. При внесении фосфорных удобрений картофель становиться белым, сульфат калия придаёт розовый цвет. Окраска клубней меняется под влиянием ядохимикатов, содержащих медь, железо, серу, фосфор и другие элементы. Такими свойствами обладают и другие растения содержащие природные индикаторы. Что позволяет оценить экологическую обстановку. При экологическом мониторинге загрязнений, использование растений содержащих природные индикаторы часто дает более ценную информацию, чем оценка загрязнения приборами. К тому же такой способ мониторинга состояния окружающей среды проще и экономичнее» ( Н.Н.Третьяков. Учебник по агрономии).
3. Применение индикаторов в быту
Растительные индикаторы можно использовать и в быту.
Даже хозяйки используют индикаторы, чтобы борщ был ярко-красным - в него перед окончанием варки добавляют немного пищевой кислоты – уксусной или лимонной; цвет меняется прямо на глазах.
Давненько было в моде писать приглашения на лепестках цветов; а писали их в зависимости от цветка и желаемого цвета надписи раствором кислоты или щелочи, пользуясь тонким пером или заостренной палочкой.
Ещё в прошлом веке реакцию йода с крахмалом (в результате которой все окрашивается в синий цвет) использовали, чтобы уличить недобросовестных торговцев, которые добавляли в сметану «для густоты» пшеничную муку. Если на образец такой сметаны капнуть йодной настойки, синее окрашивание сразу выявит подвох.
Раньше лакмус использовали в качестве красителя, но когда изобрели синтетические красители, использование лакмуса ограничилось. Для этой цели служат полоски фильтрованной бумаги, пропитанной раствором лакмуса.
V. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1. Приготовление природных индикаторов
из растительного сырья
Задачи:
1. Получить природные индикаторы из доступных природных объектов.2. Составить шкалу изменения цвета для каждого индикатора.
Объект исследования: природные растения, обладающие свойствами индикаторов.
Предмет исследования: растворы самодельных растительных индикаторов.
Методы исследования:
• Изучение научно-популярной литературы;
• Получение растворов индикаторов и работа с ними.
Из литературы я узнал, что приготовить вытяжку природных индикаторов можно разными способами – кипячением в воде или экстрагированием каким-либо растворителем, например – спиртом. Я приготовил индикаторы способом кипячения.
В качестве природных индикаторов были отобраны ягоды брусники, клюквы, черной смородины, свекла, морковь, куркума и черный чай.
| 
| 
| 
|
| брусника | клюква | черная смородина |
| 
| 
| 

|
| свекла | морковь | куркума, черный чай |
1. Изготовление индикаторов.
Для приготовления растительных индикаторов я взял по 50 г сырья, измельчил, залил 100 мл воды и прокипятил в течение 1-2 минут. Это приводит к разрушению мембран клеток, и антоцианы свободно выходят из клеток, окрашивая воду. Полученные отвары были охлаждены и профильтрованы. С целью предохранения от порчи, в полученный фильтрат добавил спирт в соотношении 2:1.
2. Изучение действия индикаторов в различных средах, составление таблицы изменения цвета.
Получив растворы индикаторов, я проверил, какую окраску они имеют в разных средах.
По несколько капель каждого образца добавлял в растворы соляной кислоты HCl (среда кислая) и гидроксида натрия NaOH (среда щелочная).
Вывод. Все индикаторы изменили свой цвет в кислой и в щелочной среде. Лучше себя показали индикаторы из свеклы, чёрной смородины, брусники и клюквы. Не все вещества обладают ярко выраженными индикаторными свойствами. Черный чай изменяет цвет только в кислоте, а морковь и куркума - только в щелочной. Все данные исследования внесены в таблицу:
| Исследуемый объект | Исходная окраска | Окраска в кислоте | Окраска в щелочи |
| Ягоды брусники | малиновая | розовая | зеленая |
| Ягоды клюквы | малиновая | розовая | зеленая |
| Ягоды черной смородины | малиновая | розовая | зеленая |
| Свекла | бордовая | ярко-розовая | желто-зеленая |
| Морковь | оранжевая | светло-оранжевая | желтая |
| Куркума | желтая | желтая | коричневая |
| Чай черный | коричневая
| желтая | темно-коричневый |
Вот мои лучшие индикаторы




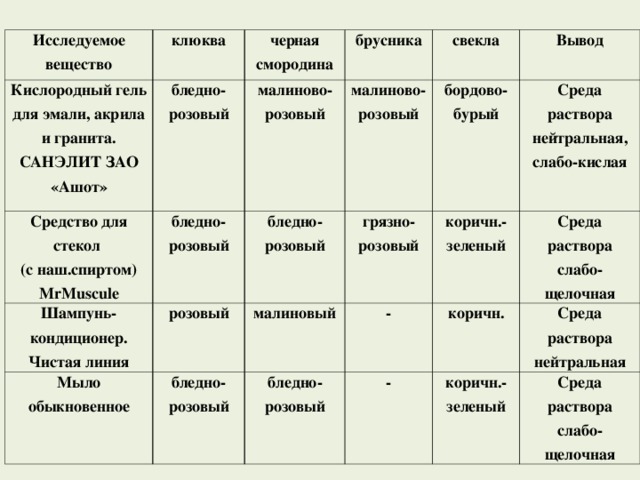
2. Определение среды некоторых средств бытовой химии с помощью полученных индикаторов
Цель: с помощью полученных индикаторов исследовать косметико-гигиенические и моющие средства.
Оборудование: образцы моющих и косметико-гигиенические средств; растительные индикаторы (из брусники, клюквы, черной смородины и свеклы); пробирки.

Ход опыта: Я растворил выбранные образцы моющих средств и средств бытовой химии в воде, и поочередно добавлял к полученным растворам растворы моих индикаторов. Результаты исследований занесены в таблицу.
| Исследуемое вещество | клюква | черная смородина | брусника | свекла | Вывод |
| Кислородный гель для эмали, акрила и гранита. САНЭЛИТ ЗАО «Ашот» | бледно-розовый | малиново-розовый | малиново-розовый | бордово-бурый | Среда раствора нейтральная, слабо-кислая |
| Средство для стекол (с наш.спиртом) МrMuscule | бледно-розовый | бледно-розовый | грязно-розовый | коричн.-зеленый | Среда раствора слабо-щелочная |
| Шампунь-кондиционер. Чистая линия | розовый | малиновый | - | коричн. | Среда раствора нейтральная |
| Мыло обыкновенное | бледно-розовый | бледно-розовый | - | коричн.-зеленый | Среда раствора слабо-щелочная |




Результаты исследований:
Средство для мытья стекол и хозяйственное мыло имеют слабо-щелочную среду раствора, поэтому эти средства не должны попадать в глаза и разрушают естественную защиту кожи.
На уроках биологии и химии я узнал, что внешняя поверхность эпидермиса покрыта микроскопически тонким слоем – кислотной мантией. В эпидермисе протекает множество биохимических процессов. В результате образуются кислоты – молочная, лимонная и другие. Плюс к этому: кожное сало и пот. Все это и составляет кислотную мантию кожи. Следовательно, нормальная кожа имеет кислую реакцию, рН кожи составляет в среднем 5,5.
При использовании моющих средств, имеющих щелочную среду, мы нарушаем нормальную кислотную среду кожи рук. Для предохранения кожи рук от негативного воздействия таких средств, нужно работать с ними только в перчатках. Ещё лучше, пользоваться другими средствами: например, руки мыть хорошим туалетным мылом или гелем, или детским мылом, в которые добавлены нейтрализующие щелочь вещества. Они меньше раздражают кожу.
Шампунь в моей семье правильный, среда его раствора близка к среде кожи головы – он совершенно безопасен.
3. Определение среды растворов некоторых
кисломолочных продуктов
Так же я проверил реакцию среды кисломолочных продуктов, имеющихся у нас дома. Но так как растворы природных индикаторов закончились, я работал с бумажным универсальным индикатором. Опустив индикаторную полоску в кефир и домашнюю простоквашу, я заметил, что бумажка порозовела. Я доказал наличие кислоты в этих продуктах.
Это молочная и другие органические кислоты, которые усиливают выделение желудочного сока, улучшают функционирование кишечника, нормализуют его микрофлору. Ученые утверждают, что кисломолочные культуры легче, по сравнению с натуральным молоком, усваиваются организмом и препятствуют размножению вредных патогенных микробов, вызывающих гнилостные процессы.
Хорошо, что в нашей семье любят такие продукты.




ЗАКЛЮЧЕНИЕ
Из литературных и интернет-источников я узнал о действиях химических и природных индикаторов в различных средах, т.е. достиг своей главной цели. Узнал, на какие группы делятся индикаторы, как ведут себя в кислотных, основных и щелочных средах. Оказывается, индикаторы можно использовать для различных целей. Например, чтобы отстирать пятно от ягод сначала нужно застирать вещь в кислой среде, а только потом обычным моющим средством. И еще можно использовать индикаторы для того, чтобы с их помощью определить среду моющих средств и выбрать наиболее приемлемое средство.
После проведения ряда опытов я убедился, что индикаторы в действительности являются веществами, изменяющими окраску при изменении концентрации ионов водорода в растворе, и подтвердил свою гипотезу.
В современном мире при огромнейшем разнообразии химических веществ необходимо знать правила правильного использования этих веществ. Не пренебрегайте инструкцией по применению.
Проведя исследовательскую работу, я пришел к следующим выводам:
- многие природные растения обладают свойствами кислотно-основных индикаторов, способных изменять свою окраску в зависимости от среды, в которую они попадают. Это, так называемые, природные индикаторы, ярко окрашенные цветы и плоды растений;
- растворы растительных индикаторов можно использовать, например, в качестве кислотно-основных индикаторов для определения среды растворов гигиенически-моющих средств и качества продуктов в домашних условиях;
- самодельные индикаторы из природного сырья можно применять на уроках химии в школах, если существует проблема обеспечения школы химическими реактивами.
К сожалению, почти у всех природных индикаторов есть серьезный недостаток: их отвары довольно быстро портятся, поэтому чаще используются более устойчивые спиртовые растворы. Положительным моментом является то, что они экологически безопасны, и их можно приготовить и использовать в домашних условиях.
Надеюсь, что моя работа привлечёт внимание учащихся и педагогов, так как полученная информация может быть использована в узко прикладном направлении, например в домашнем хозяйстве и на даче. А ещё надеюсь, что моя работа будет способствовать развитию у ребят любознательности и наблюдательности.
Наконец, некоторые рекомендации:
1. Растительные индикаторы можно использовать и в быту. Сок столовой свеклы в кислой среде изменяет свой рубиновый цвет на ярко-красный, а в щелочной – на желтый. Зная свойство свекольного сока, можно сделать цвет борща ярким. Для этого к борщу следует добавить немного столового уксуса или лимонной кислоты.
2. Для определения состава лекарств, которые употребляют для лечения, можно использовать природные индикаторы. Многие лекарственные препараты представляют собою кислоты, соли и основания. Изучив их свойства, можно обезопасить себя. Например, аспирин (ацетилсалициловую кислоту) и многие витамины нельзя принимать на голодный желудок, так как кислоты, входящие в их состав, будут повреждать слизистую желудка.
3. Результаты исследовательской работы можно использовать для определения среды различных растворов, например, молочных продуктов, бульонов, лимонада и других, а также для определения кислотности почвы, т. к. в зависимости от этого один вид растений может давать высокий урожай, а другие будут угнетенными.
4. "Народный" способ для определения кислотности почвы. Положите в стеклянную посуду 3-4 листа черной смородины или вишни и залейте их стаканом кипятка. Когда вода остынет, бросьте в нее комочек земли. Если вода покраснеет - почва определенно кислая, посинеет - слабокислая, а если станет зеленой - нейтральная.
5. Моющие средства для посуды имеют щелочную среду и при их применении необходимо использовать резиновые перчатки для защиты кожи рук от негативного воздействия, т. к. щелочная среда разрушает кислотную мантию эпидермиса.
СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ
Аликберова Л.Ю. Занимательная химия. – М.: АСТ-ПРЕСС, 2002.
Аликберова Л.Ю. Занимательная химия. Книга для учащихся, учителей и родителей. – М.: АСТ-ПРЕСС, 1999.
Байкова В.М. Химия после уроков. - Петрозаводск: Карелия, 1984.
Балаев И.И. Домашний эксперимент по химии.(Пособие для учителя) - М.: Просвещение, 1977.
Габриелян О.С. Химия.11 класс. Базовый уровень: учеб.для ОУ. - М.: Дрофа. 2008.
Кременчугская М. Химия. – М.: Филологическое общество «Слово»,1995.
Крешков А.П. Основы аналитической химии, 3 изд., кн. 2 – М., 1971.
Леенсон И.А. Занимательная химия. - М.: РОСМЭН, 2001.
9. Назарова Т.С, Грабецкий А.А. Химический эксперимент в школе. – М. 1987.
10. Научно – практический журнал «Химия для школьников», №4, 2007.
11.Нифантьев Э.Е. Внеклассная работа по химии с использованием хроматографии.- М.: Просвещение, 1982.
12. Савина Л.А. Я познаю мир. Детская энциклопедия. Химия. – М.: АСТ, 1996.
13. Степин Б.Д., Аликберова Л.Ю. Занимательные задания и эффектные опыты по химии. – М.: Дрофа, 2002.
14. Пилипенко А.Т. Справочник по элементарной химии. – Киев.Наукова думка. 1973.
15. Учебно–методическая газета для учителей химии «Первое сентября», №22, 2007.
16. Храмов В.А. Аналитическая биохимия. - Волгоград: Издательство «Учитель», 2007.
17. Штемплер Г.И. Химия на досуге. – М.: Просвещение, «Учебная литература», 1996.
18. Энциклопедический словарь юного химика. – М.: Педагогика, 1982.
Интернет-ресурсы:
1. http://www.xumuk.ru/encyklopedia/1684.html
2. http://festival.1september.ru/articles/534067/
3. http://ru.wikipedia.org/wiki.
4. http://www.alhimik.ru
5. http://www.planetseed.com/ruru
6. http://www. alchemic.ru. «Добрые советы».






































 7 МЕТИЛОРАНЖ бесцветный красный оранжевый синий малиновый розовый желтый" width="640"
7 МЕТИЛОРАНЖ бесцветный красный оранжевый синий малиновый розовый желтый" width="640"