Презентация к уроку химии в 9 классе по теме "Фосфор и его свойства" изменена учителем в соответствии с целями урока, первоисточник "Уроки химии с применением информационных технологий. Неметаллы.9 класс.: разработки уроков, задания для подготовки к ГИА и ЕГЭ, задачи и решения. Методическое пособие с электронным приложением / Т.М.Солдатова.- М:Планета. 2011.(Современная школа)
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
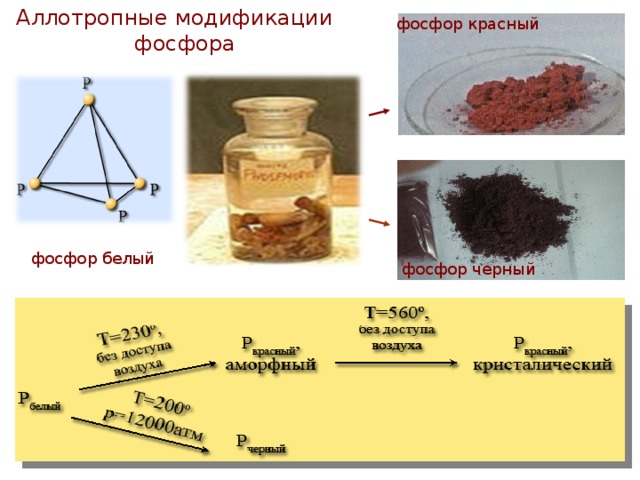
Презентация к уроку химии в 9 классе "Фосфор и его свойства"
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«презентация к уроку химии в 9 классе "Фосфор и его свойства" »
Похожие файлы
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
1930 руб.
2760 руб.
1990 руб.
2840 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства