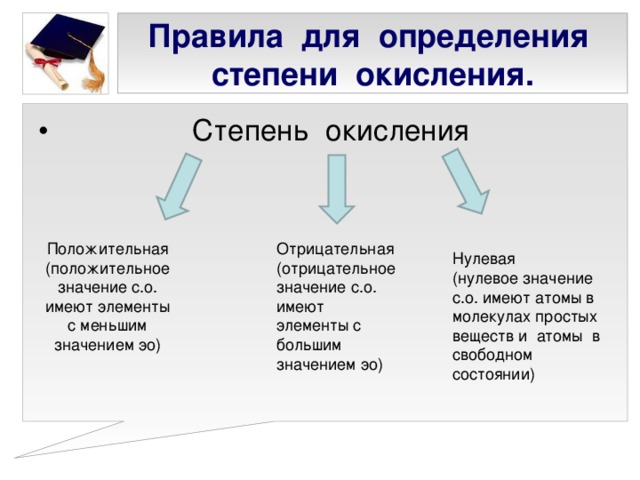
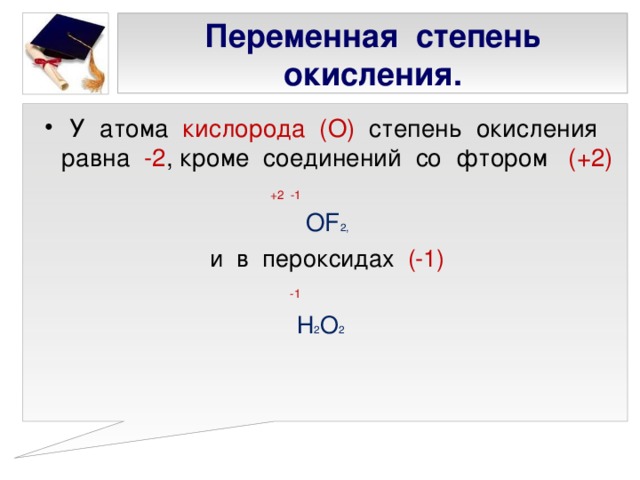
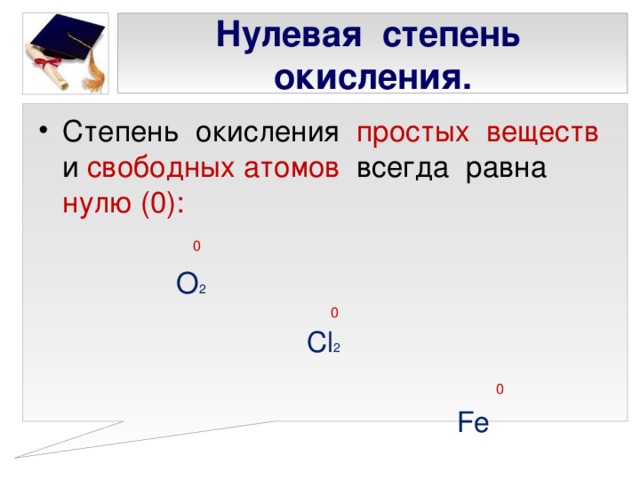
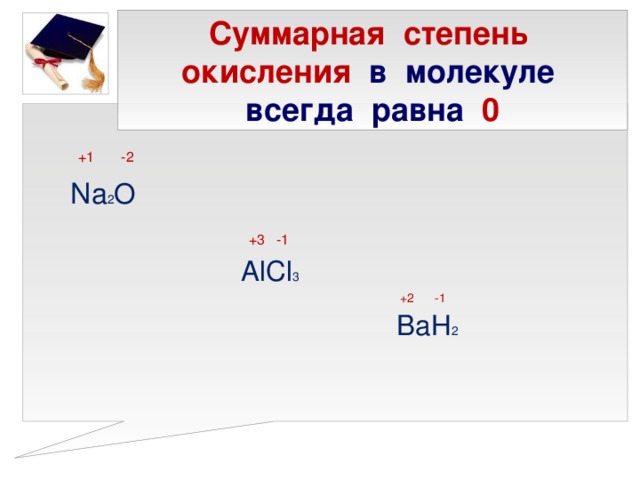
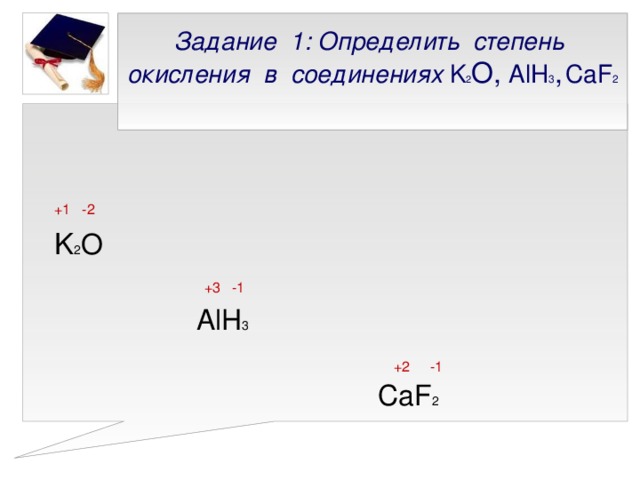
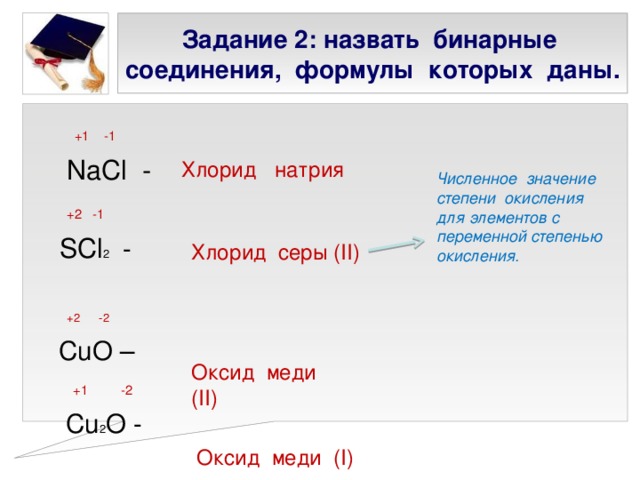
Представлена презентация к уроку химии 8 класс по учебнику ОС Габриеляна. Презентация состоит из 27 слайдов. Первый слай: название урока. Второй - проверка знаний учащихся по теме: типы химической связи. Третий слайд - определение степени окисления. Четвертый слайд - порядок выставления степени окисления. Пятый слайд - составление формул. Шестой - правила определения степени окисления. Седьмой, восьмой - постоянная степень окисления. Девятый. десятый, одиннадцаиый - переменная степень окисления. Двенадцатый - нулевая степень окисления. Тринадцатый - суммарная степень окисления. Пятнадцатый - задание на определение степени окисления. 16,17,18.19 - бинарные соединения. 20 - задание. 21-25 составление формул бинарных соединений. 26 - домашнее задание. 27 - литература.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Презентация к уроку химии 8 класс Степень окисления
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Презентация к уроку химии 8 класс Степень окисления »
Похожие файлы
Полезное для учителя
Распродажа видеоуроков!
2200 руб.
3140 руб.
1930 руб.
2760 руб.
1970 руб.
2820 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства