~План урока по химии в 8 классе
Тема урока: «Составление уравнений
окислительно – восстановительных реакций»
Цель урока: продолжить формирование понятий «степень окисления», «окислитель», «восстановитель», «окислительно – восстановительные реакции», «метод электронного баланса»; познакомить учащихся с заданиями ГИА и ЕГЭ, рассматривающих данные вопросы; познакомить учащихся с особенностями протекания окислительно-восстановительных реакций в различных средах.
Образовательные задачи:
- повторить основные понятия об окислении и восстановлении, степени окисления, окислителях и восстановителях, рассмотреть сущность окислительно-восстановительных реакций;
- выработать умения по составлению уравнений химических реакций, протекающих в различных средах методом электронного баланса.
Развивающие задачи:
- способствовать формированию и развитию познавательного интереса учащихся к предмету;
- способствовать развитию речи учащихся;
- формирование умения анализировать, сопоставлять, и обобщать знания по теме;
- способствовать овладению учащимися всеми видами памяти.
Воспитательные задачи:
- воспитание осознанной потребности в знаниях;
- совершенствовать умение выслушивать мнение каждого члена коллектива, делать самостоятельные выводы;
- развитие любознательности.
Тип урока: комбинированный (словесно – наглядно – практический).
Место данного урока в теме: второй урок в теме «Окислительно-восстановительные реакции» в разделе «Химия в задачах» при изучении элективного курса «Химия-9».
Методическое оснащение урока:
1. Материально-техническая база:
— кабинет химии, персональный компьютер, медиапроектор.
2. Дидактическое обеспечение:
— рабочая тетрадь учащихся;
— презентация в Power Point ;
— материалы для контроля знаний учащихся.
План урока:
1. Актуализация знаний;
2. Объяснение новой темы;
3. Закрепление изученного материала;
4. Запись домашнего задания.
Ход урока:
1.Актуализация знаний.
1.1 Беседа по материалам прошлого урока.
Вопросы к беседе:
1) Какие реакции называются окислительно- восстановительными?
2) Что такое окисление?
3) Какой процесс называется восстановлением?
4) Как называются вещества, отдающие электроны?
5) Как называются вещества, принимающие электроны?
6) Что такое «степень окисления»?
7) Что происходит со степенью окисления элемента в процессе
его восстановления?
8)Что происходит со степенью окисления элемента в процессе
его окисления?
9)Как классифицируются ОВР?
10) Какой элемент в ПС является самым сильным окислителем?, восстановителем?
11) Какие элементы в ПС имеют постоянные степени окисления и какие конкретно?
12) Приведите примеры соединений, содержащих в своем составе атомы серы, которые будут проявлять: а) только окислительные, б) только восстановительные; в) и окислительные, и восстановительные свойства?
Учитель: окислительно-восстановительные реакции и вся теория, которую мы с вами повторили и обобщили, имеют место в заданиях ГИА (В3) и ЕГЭ( А27, В2, С1). Давайте решим сначала задания из ГИА, а затем перейдем к заданиям ЕГЭ, и вы убедитесь, что теоретическая основа, которую мы с вами закладываем на наших уроках сейчас, помогут вам в будущем ответить на вопросы изучаемой темы при сдаче ЕГЭ.
Итак, внимание на экран: работа с заданиями слайдов 7 – 12.
Используются задания из вариантов ГИА и ЕГЭ, разработанных сотрудниками ФИПИ.
Ответьте, пожалуйста, на следующий вопрос: какой элемент по окислительным свойствам стоит на втором месте после фтора? (кислород, и далее, галогены. Причем, окислительные свойства галогенов уменьшаются от хлора к иоду).
Важно так же знать, что помимо кислорода сильными окислительными свойствами обладают соединения, в которых есть кислород. Мы с вами сегодня знакомимся с сильнейшим окислителем – перманганатом калия, формула которого… KMnO4
Объяснение нового материала.
Перманганат калия является сильным окислителем за счет иона MnO42-, в котором марганец находится в высшей степени окисления +7. Именно поэтому марганец может только восстанавливаться в результате ОВР. И восстанавливаться до конкретных продуктов. (слайд 14)
Наша с вами задача сегодня научиться предугадывать продукты ОВР, в которых принимает участие KMnO4.
Рассмотрим сначала восстановление перманганата калия в кислой среде.
(слайд 15)
KMnO4 + KI + H2SO4
Существует алгоритм по составлению таких реакций. Давайте им воспользуемся…
Сначала проставляют степени окисления элементов. Затем рассуждают, какие элементы и как будут изменять степень окисления. Воспользуемся схемой. Так как реакция протекает в кислой среде, ион MnO42- будет переходить в ион Mn2+, понижая степень окисления. Значит, нужно найти элемент, который способен повысить степень окисления. Таким ионом является ион I-. Составляем электронный баланс. И далее записываем продукты данной реакции и расставляем коэффициенты. Напоминаю вам о том, что стехиометрические коэффициенты, которые вы получили в электронном балансе, должны иметь место в реакции!
Далее рассмотрим восстановление перманганата калия в нейтральной и щелочной средах (по этапам, используя алгоритм). (слайды 16, 17)
KMnO4 + K2SO3 + H2O
KMnO4 + K2SO3 + KOH
Закрепление изученного материала.
Решаем самостоятельно предложенное уравнение реакции. (слайд 18)
NaMnO4 + KNO2 + H2SO4
Учащиеся на доске и в тетрадях пишут уравнение реакции и самостоятельно расставляют коэффициенты методом электронного баланса.
А теперь, ребята, когда теоретический материал позади, давайте включим в работу визуальную память. Для этого я вам предлагаю посмотреть реакции восстановления перманганата калия в различных средах.
Учитель демонстрирует реакции взаимодействия растворов KMnO4 и K2SO3 в нейтральной, кислой и щелочной средах.
Итоги и выводы.
Мы познакомились с особенностями протекания окислительно-восстановительных реакций в различных средах.
Вспомнили, как расставлять коэффициенты методом электронного баланса.
Научились записывать продукты окислительно-восстановительных реакций с участием перманганата калия.
Задание на дом.
Допишите уравнение реакции и расставьте коэффициенты с помощью метода электронного баланса:
KMnO4 + HBr
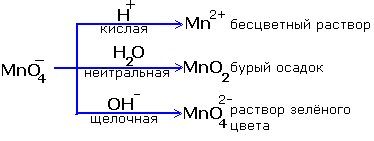
 MnO4 + KI + H2SO4
MnO4 + KI + H2SO4  MnO4 + HBr
MnO4 + HBr















