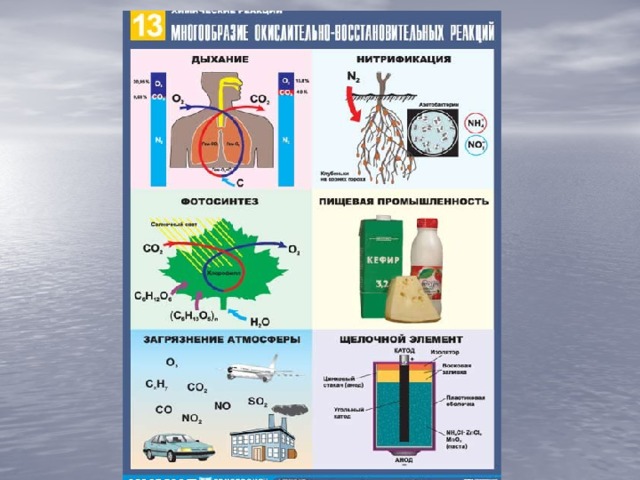
Данная презентация сопровождает объяснительно-иллюстративный урок с элементами игровых ассоциаций по теме окислительно-восстановителные реакции. знакомит с основными понятиями: окислитель, восстановитель, окисление, восстановление; важнейшими окислителями и восстановителями. содержит алгоритм составления овр. повторяет понятие степень окисления.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Презентация к уроку химии в 9 классе по теме "Окислительно-восстановительные реакции"
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Презентация к уроку химии в 9 классе по теме "Окислительно-восстановительные реакции" »
Полезное для учителя
Распродажа видеоуроков!
1690 руб.
2820 руб.
1660 руб.
2760 руб.
1660 руб.
2760 руб.
1880 руб.
3140 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства