Презентация поможет обучающимя 11 класса повторить и закрепить знания по амфотерным оксидам и гидроксидам. Данный материал можно использовать при подготовке к ЕГЭ.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Презентация по теме "Амфотерные оксиды и гидроксиды"
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Презентация по теме "Амфотерные оксиды и гидроксиды"»
Полезное для учителя
Распродажа видеоуроков!
2200 руб.
3140 руб.
1990 руб.
2840 руб.
1930 руб.
2760 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства






![Химические свойства амфотерных оксидов При взаимодействии с растворимыми основаниями амфотерные оксиды проявляют кислотные свойства. ZnO+ NaOH + Н 2 О = Na 2 [Zn ( O Н) 4 ] 2 При взаимодействии с растворами щелочей амфотерные оксиды образуют комплексную соль.](https://fsd.kopilkaurokov.ru/up/html/2023/08/03/k_64cac831712cf/img_user_file_64cac8326377f_6.jpg)



![Химические свойства амфотерных гидроксидов При взаимодействии с растворимыми основаниями амфотерные гидроксиды проявляют кислотные свойства. Zn ( O Н) 2 + 2 NaOH = раствор Na 2 [Zn ( O Н) 4 ] При взаимодействии с растворами щелочей амфотерные гидроксиды образуют комплексную соль.](https://fsd.kopilkaurokov.ru/up/html/2023/08/03/k_64cac831712cf/img_user_file_64cac8326377f_10.jpg)


![Химические свойства амфотерных гидроксидов Амфотерные гидроксиды реакции со щелочью в растворах образуют комплексную соль. Zn(OH) 2 +2NaOH= Na 2 [Zn ( O Н) 4 ] Al(OH) 3 +NaOH= Na[Al ( O Н) 4 ]](https://fsd.kopilkaurokov.ru/up/html/2023/08/03/k_64cac831712cf/img_user_file_64cac8326377f_13.jpg)




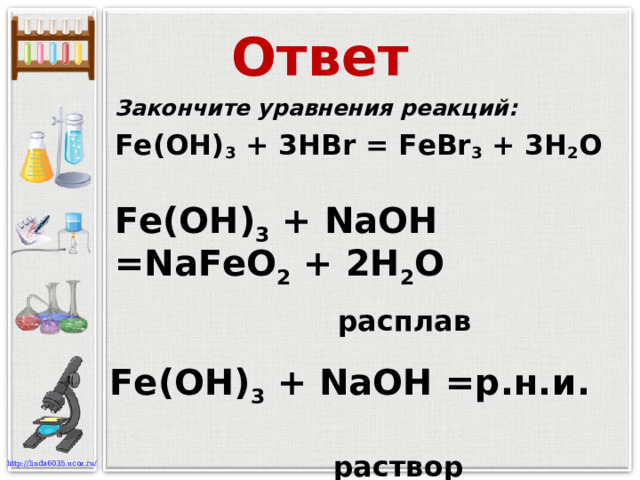
![Ответ Закончите уравнения реакций: Cr(OH) 3 + 3 HCl = CrCl 3 + 3H 2 O Cr(OH) 3 + K OH = KCrO 2 + 2H 2 O расплав раствор Cr(OH) 3 + K OH = K[Cr(OH) 4 ]](https://fsd.kopilkaurokov.ru/up/html/2023/08/03/k_64cac831712cf/img_user_file_64cac8326377f_18.jpg)