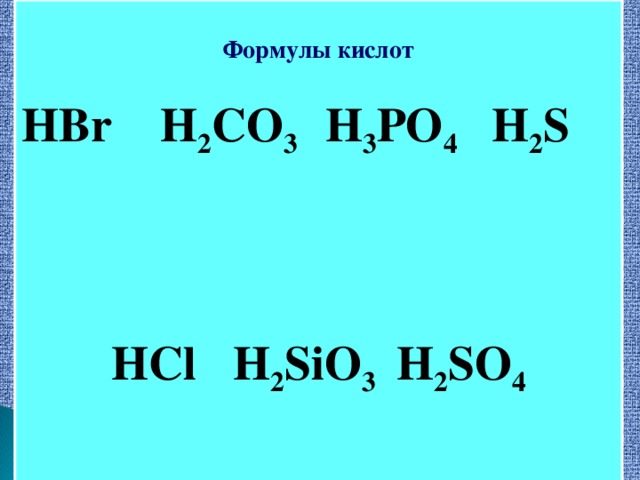
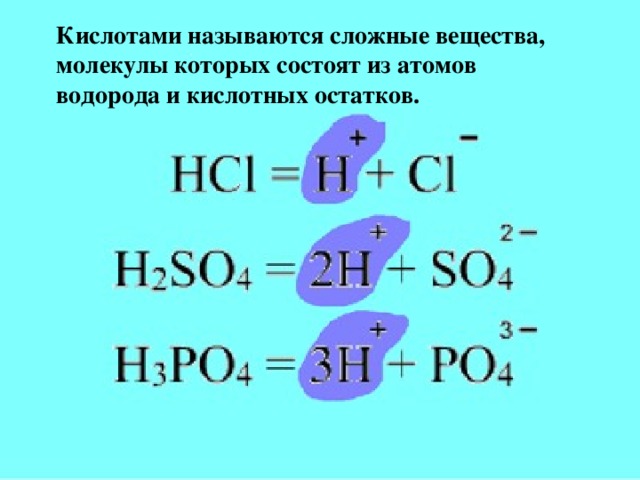
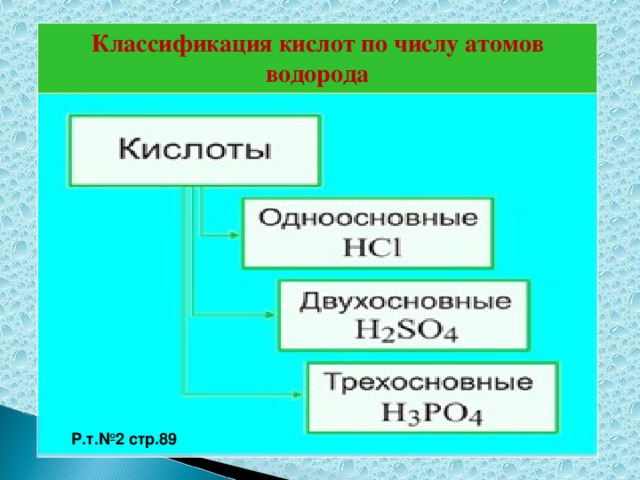
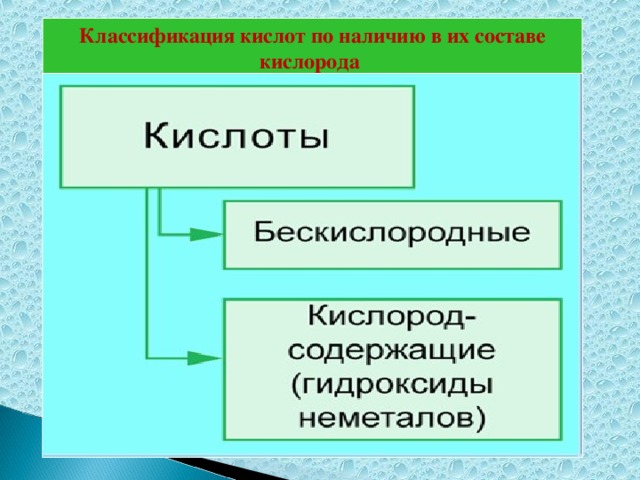
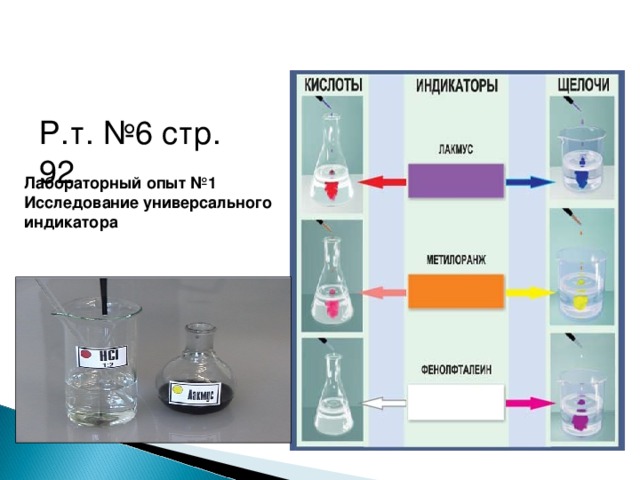
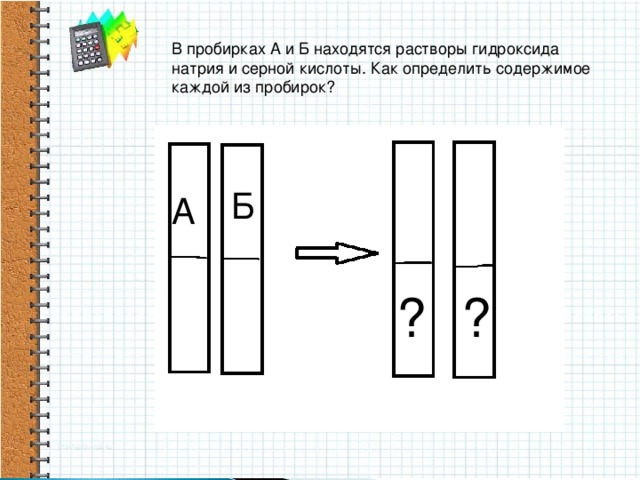
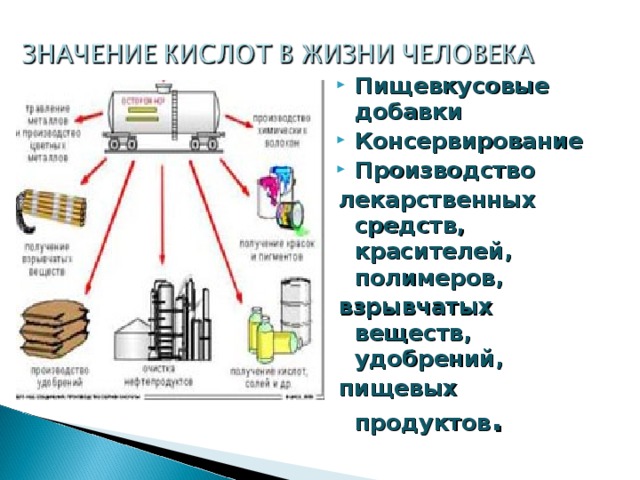
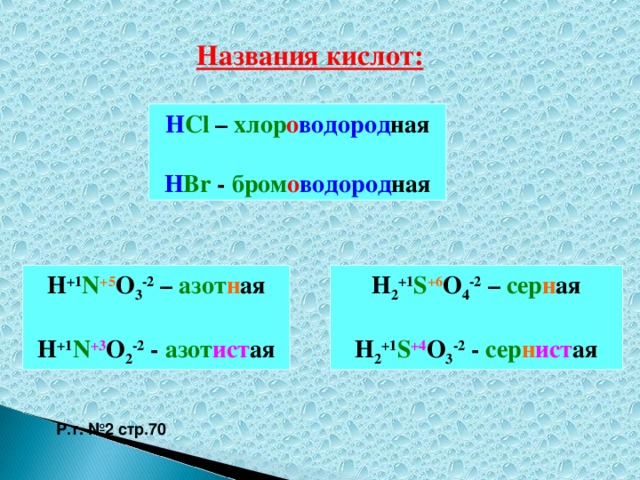
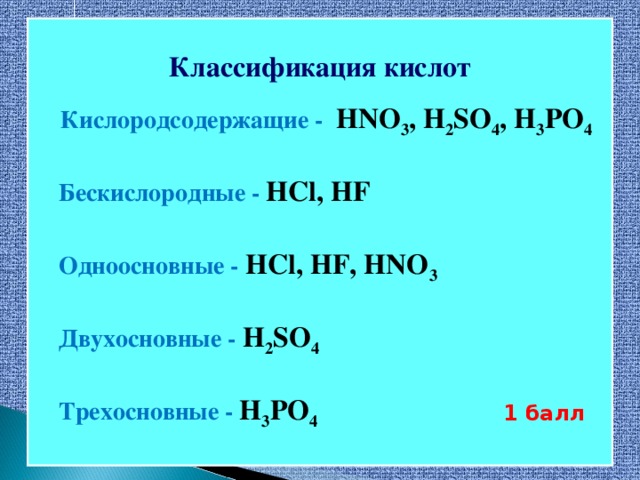
Методическая разработка урока, предложенная вашему вниманию, создана на основе системно-деятельностного подхода.
В современной дидактике и предметных методиках в последнее время признание и развитие получила идея активного воздействия на ученика путем деятельностного включения его в учебный процесс. Ребенок живет процессом созидания, процессом учения, воспитания, а не результатом. Ребенок познает мир через деятельность. Педагогами и психологами доказано: учебный процесс эффективен в отношении усвоения знаний и умственного развития учащихся только тогда, когда он вызывает и организует их собственную познавательную деятельность. Какова структура деятельности учащихся, такова структура качества.
Деятельностный подход – это процесс деятельности человека, направленный на становление его сознания и его личности в целом.
В условиях деятельностного подхода человек, личность выступает как активное творческое начало. Обучать деятельности в воспитательном смысле – это значит делать учение мотивированным, учить ребенка самостоятельно ставить перед собой цель и находить пути, в том числе средства, ее достижения, помогать ребенку сформировать у себя умения контроля и самоконтроля, оценки и самооценки. Деятельностные способности учащихся формируются лишь тогда, когда они не пассивно усваивают новые задания, а включены в самостоятельную учебно-познавательную деятельность.
Любая учебная ситуация приобретает смысл с точки зрения влияния на развитие личности ребенка в зависимости от того, как она реализована учителем: с позиции воздействия «делай как я сказал» или с позиции взаимодействия «пойми смысл и принимай решение, как действовать дальше».
Технология деятельностного подхода: целеполагание, планирование деятельности, реализация, рефлексивно-оценочная деятельность. Все действия учителя, используемые им средства и приемы, направлены на развитие творческих способностей учащихся через организацию их деятельности на уроке. Среди наиболее значимых стратегий обучения на современном этапе является исследовательское обучение, которое придает познавательной деятельности творческий характер. Учение вообще есть совместное исследование, проводимое учителем и учеником (Рубинштейн). Задача педагога – создать модель по формированию развивающей среды для учащихся. Именно педагог дает формы и условия исследовательской деятельности, благодаря которым у ученика формируется внутренняя мотивация подходить к любой возникающей перед ним проблеме с исследовательской, творческой позиции. Вся работа ученика на уроке направлена на поиск решения поставленной познавательной задачи, на развитие умений рассуждать, доказывать, думать, анализировать, объяснять и сравнивать.