Урок химии по теме "Кислоты в свете ТЭД, их классификация и свойства" проводился в 8 классе, изучающие данный предмет по авторской программе О.С.Габриеляна.
Урок начинается с повторения реакций ионного обмена, их написания. далее учитель вместе с учащимися дает определение "Кислоты", заполняют таблицу "Классификация кислот по различным признакам"; рассматриваются химические свойства кислот с точки зрения ТЭД, составляются ионные уравнения.
В конце урока проводится работа по закреплению написанию ионных уравненийи хзимических свойств кислот.
Данный урок будет полезен учителям химии для проведения урока и учащимся 8 класса для закрепления знаний.
Просмотр содержимого документа
«Кислоты в свете ТЭД, их классификация и свойства »
химия 8 класс
учитель химии и ОБЖ:
Украинец Евгения Владимировна
Тема: Кислоты в свете ТЭД,
их классификация и свойства.
09.10.16
Задание: Запиши уравнения реакций ионного обмена между растворами следующих веществ
AgNO 3 и BaCl 2 NaOH и H 2 SO 4 09.10.16
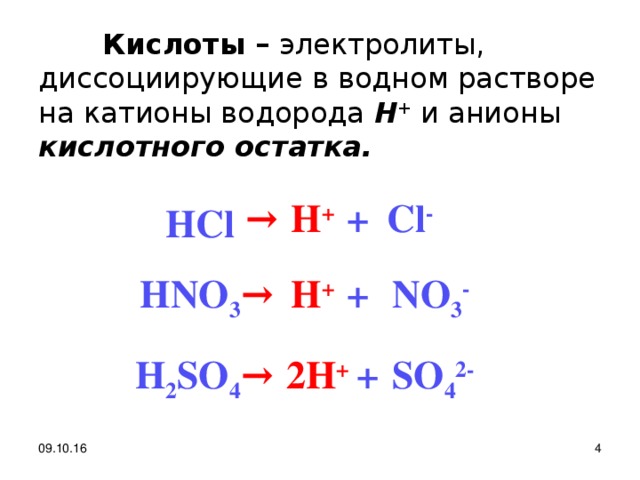
Кислоты – это сложные вещества, молекулы которых состоят из ионов водорода и кислотных остатков.
09.10.16
Кислоты – электролиты, диссоциирующие в водном растворе на катионы водорода Н + кислотного остатка.
→
Cl -
+
H +
H С l
→
+
HNO 3
NO 3 -
H +
+
2H +
→
H 2 SO 4
SO 4 2-
09.10.16
Задание. Заполните в тетради таблицу
Признаки
классификации
Группы кислот
Примеры
09.10.16
09.10.16
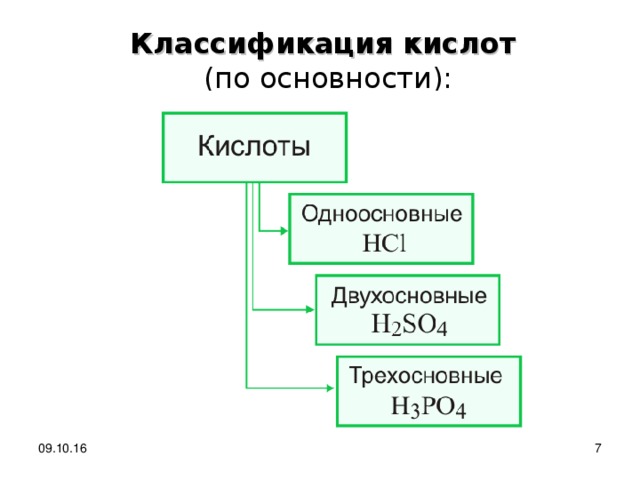
Классификация кислот (по основности):
09.10.16
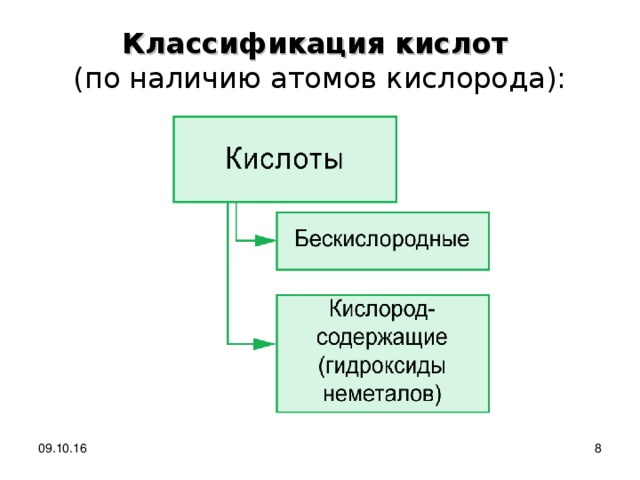
Классификация кислот (по наличию атомов кислорода):
09.10.16
Классификация кислот
Растворимые Нерастворимые Растворимые Нерастворимые Растворимые Нерастворимые Летучие Нелетучие Летучие Нелетучие Летучие Нелетучие По степени электролитической диссоциации: Сильные Слабые Сильные Слабые Сильные Слабые
09.10.16
Классификация кислот
Стабильные Нестабильные Стабильные Нестабильные Стабильные Нестабильные
H 2 CO 3 = CO 2 ↑ + H 2 O – угольная кислота H 2 SO 3 = SO 2 ↑ +H 2 O – сернистая кислота
В свободном виде не существуют, распадаются на газ и воду.
09.10.16
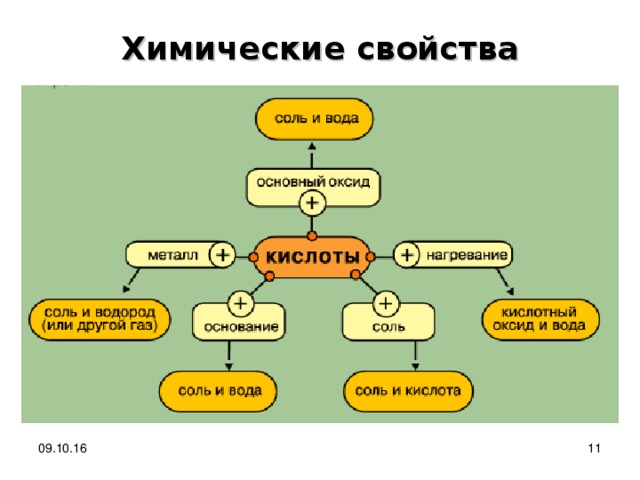
Химические свойства
09.10.16
Химические свойства (изменение окраски индикаторов)
09.10.16
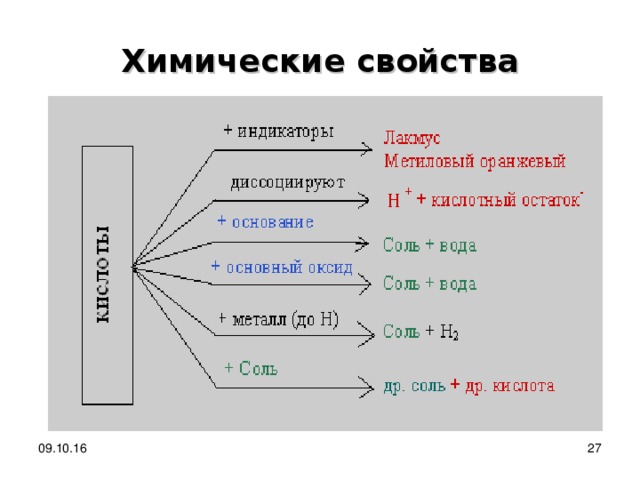
Химические свойства
Изменяют окраску индикаторов Название индикатора
Кислая среда
Лакмус
Красный
Метиловый
оранжевый
Красно-
Розовый
Фенолфталеин
Бесцветный
09.10.16
Лабораторная работа
Тема: Реакции, характерные для растворов кислот.
Ход работы:
09.10.16
Правила работы с кислотами
Проявлять осторожность. При попадании на кожу смыть большими количеством воды. Затем обработать место 5%-ным раствором соды. При растворении наливать кислоту в воду. 09.10.16
Опыт 1. Взаимодействие кислот с оксидами металлов.
09.10.16
Задание.
Напишите молекулярное уравнение реакции между оксидом меди( ΙΙ ). Запиши наблюдения (цвет веществ). Составь полное и сокращенное ионное уравнение реакции. 09.10.16
Опыт 2. Взаимодействие кислот с основаниями
09.10.16
Задание.
Напишите молекулярное уравнение реакции между соляной кислотой и гидроксидом натрия Запиши наблюдения (изменение окраски). Составь полное и сокращенное ионное уравнение реакции. Как называют реакции между кислотой и щёлочью? Запиши определение. 09.10.16
Опыт 3. Взаимодействие кислот с солями
09.10.16
Задание.
Напишите молекулярное уравнение реакции между соляной кислотой и нитратом серебра. Запиши наблюдения (цвет осадка). Составь полное и сокращенное ионное уравнение реакции. Сделай вывод о взаимодействии кислот с солями (в каких случаях они протекают). 09.10.16
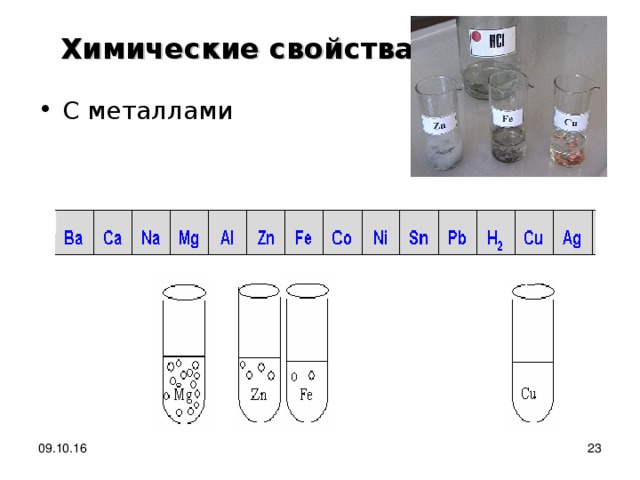
Опыт 4. Взаимодействие кислот с металлами
09.10.16
Химические свойства
09.10.16
Задание.
Напишите молекулярное уравнение реакции между соляной кислотой и цинком, соляной кислотой и железом. Запиши наблюдения. Составь полное и сокращенное ионное уравнение реакции. Сделай вывод о взаимодействии кислот с металлами (в каких случаях они протекают). 09.10.16
Химические свойства
Концентрированные кислоты разрушают ткани, обугливают бумагу, сахар 09.10.16
Обугливание сахарозы
09.10.16
Химические свойства
09.10.16
Задание. Напишите уравнения возможных реакций в молекулярном и ионном виде.
HNO 3 + NaOH = HCL + Cu(OH) 2 = MgO + H 2 SO 4 = Fe + HCL = Pb + H 2 SO 4 = HNO 3 + CaCO 3 =
09.10.16
Задание. Написать уравнения реакции в молекулярном и ионном виде, укажи тип каждой:
Na + Н 3 PO 4 ... , Mg + НBr ... , K 2 O + НNO 3 ... , Cu(OH) 2 + НNO 3 ... . 09.10.16
Задание. Закончите уравнения возможных реакций, запиши в молекулярном и ионном виде:
Na 2 O + HCl → NaOH + HCl → Cu + HCl → Zn + H 2 SO 4 → H 2 SO 4 + HCl → 09.10.16
Задание. Составь возможные уравнения реакций взаимодействия перечисленных веществ с серной кислотой в ионном виде:
Оксид кремния ( Ι V ) Гидроксид лития Нитрат бария Соляная кислота Оксид калия Силикат калия Нитрат натрия Гидроксид железа ( ΙΙ ) 09.10.16
Задача. Рассчитай объём водорода (н.у.), который выделится при растворении в соляной кислоте 120 г магния, содержащего 2,5 % примесей.
09.10.16