КИСЛОТЫ ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА
Цели и задачи:
сформировать представление о кислотах, как классе неорганических соединений изучив их состав, классификацию, номенклатуру, свойства и способы получения.
продолжить формирование понятийного аппарата по классификации, свойствам неорганических соединений и качественных реакциях на них.
Продолжить формировать ОУУН:
давать качественную и количественную характеристику изучаемого объекта;
сравнивать, анализировать;
организовывать самостоятельную учебную деятельность.
Просмотр содержимого документа
«Кислоты их классификация и свойства »
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
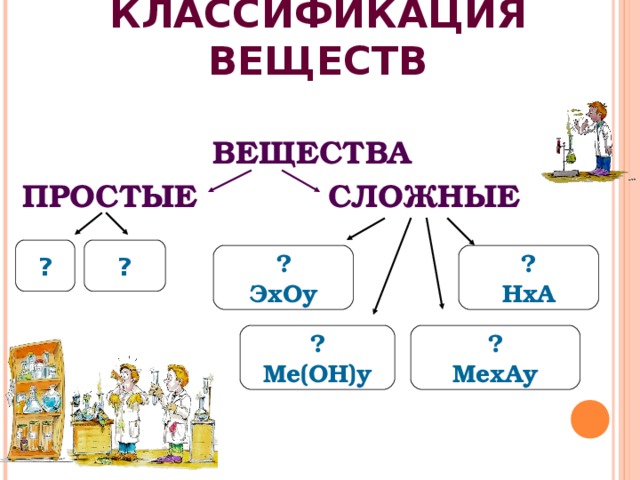
КЛАССИФИКАЦИЯ ВЕЩЕСТВ
ВЕЩЕСТВА
ПРОСТЫЕ СЛОЖНЫЕ
?
?
?
ЭхОу
?
НхА
?
Ме(ОН)у
?
МехАу
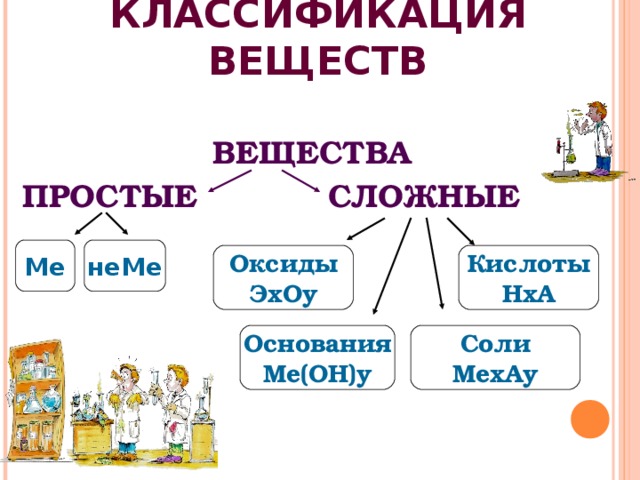
КЛАССИФИКАЦИЯ ВЕЩЕСТВ
ВЕЩЕСТВА
ПРОСТЫЕ СЛОЖНЫЕ
Ме
неМе
Оксиды
ЭхОу
Кислоты
НхА
Основания
Ме(ОН)у
Соли
МехАу
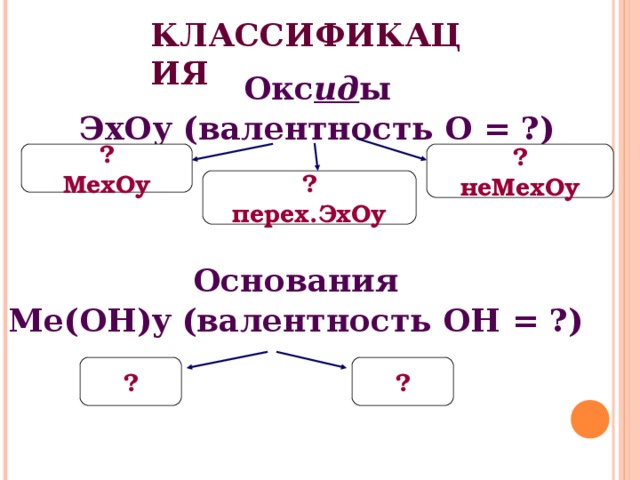
КЛАССИФИКАЦИЯ
Окс ид ы
ЭхОу (валентность О = ?)
?
неМехОу
?
МехОу
?
перех.ЭхОу
Основания
Ме(ОН) y (валентность ОН = ?)
?
?
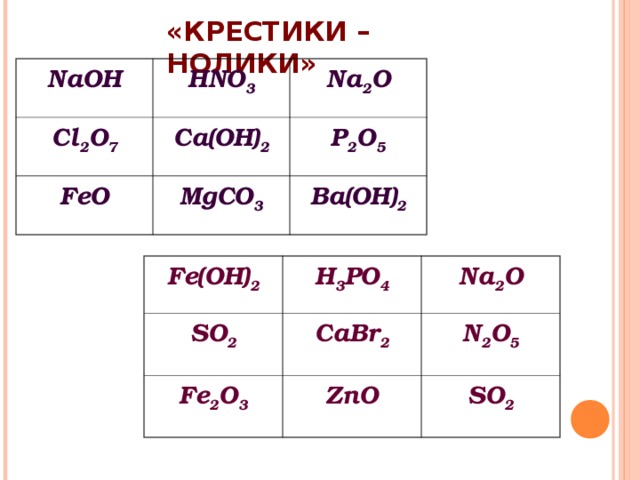
«КРЕСТИКИ – НОЛИКИ»
NaOH
HNO 3
Cl 2 O 7
Na 2 O
Ca(OH) 2
FeO
P 2 O 5
MgCO 3
Ba(OH) 2
Fe(OH) 2
SO 2
H 3 PO 4
Na 2 O
CaBr 2
Fe 2 O 3
N 2 O 5
ZnO
SO 2
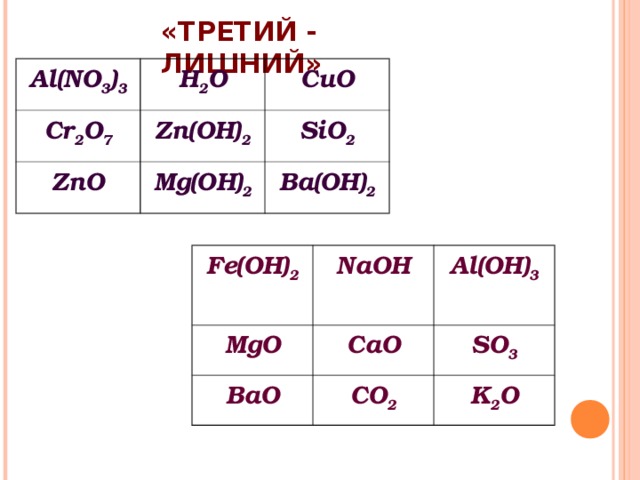
«ТРЕТИЙ - ЛИШНИЙ»
Al(NO 3 ) 3
H 2 O
Cr 2 O 7
CuO
Zn(OH) 2
ZnO
SiO 2
Mg(OH) 2
Ba(OH) 2
Fe(OH) 2
MgO
NaOH
Al(OH) 3
CaO
BaO
SO 3
CO 2
K 2 O
УСТАНОВИТЕ СООТВЕТСТВИЕ
Название индикатора
Окраска индикатора в щелочной среде
1. Метиловый оранжевый (м/о)
А. Синий
2. Фенолфталеин (ф/ф)
Б. Желтый
3. Лакмус
В. Малиновый
УСТАНОВИТЕ СООТВЕТСТВИЕ
Исходные вещества
Продукты реакции
1. Mg(OH) 2 + ф/ф
А. Ва(ОН) 2
2. К OH + HCl
Б. Окраску не изменяет
3 . NaOH + м/о
В. Ca С O 3 (соль)
4 . СО 2 + 2NaOH
Г. К Cl (соль) + Н 2 О
5. С O 2 + CaO
Д. Малиновый цв.
6 . ВаО + Н 2 О
Е. Желтый цв.
7 . К OH + ф/ф
Ж. Na 2 CO 3 (соль) + Н 2 О
ПРОВЕРОЧНАЯ РАБОТА
1. Распределите формулы веществ по колонкам
таблицы, подчеркнутым веществам дайте название .
Оксиды
кислотные
Основания
основные
растворимые
Соли и кислоты
нерастворимые
II – Вариант
Na 2 O , Al(OH) 3 , CO 2 MgCO 3 , HCl, KOH .
I – Вариант
Zn(OH) 2 , K 2 O , HNO 3 , SO 3 , NaOH , NaBr
2 . Завершите уравнения реакций,
определите типы реакций
I – Вариант
Na+ O 2 →
H 2 S + O 2 →
Na 2 O + H 2 O →
Mg(OH) 2 →
II – Вариант
CH 4 + O 2 →
K+ O 2 →
Zn(OH) 2 →
K 2 O + H 2 O →
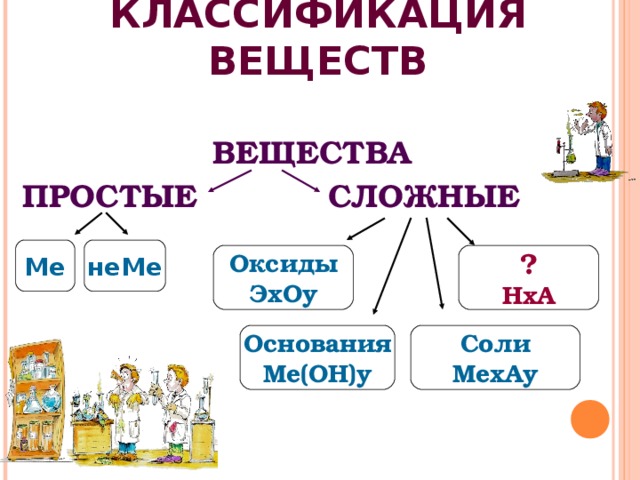
КЛАССИФИКАЦИЯ ВЕЩЕСТВ
ВЕЩЕСТВА
ПРОСТЫЕ СЛОЖНЫЕ
Ме
неМе
Оксиды
ЭхОу
?
НхА
Основания
Ме(ОН)у
Соли
МехАу
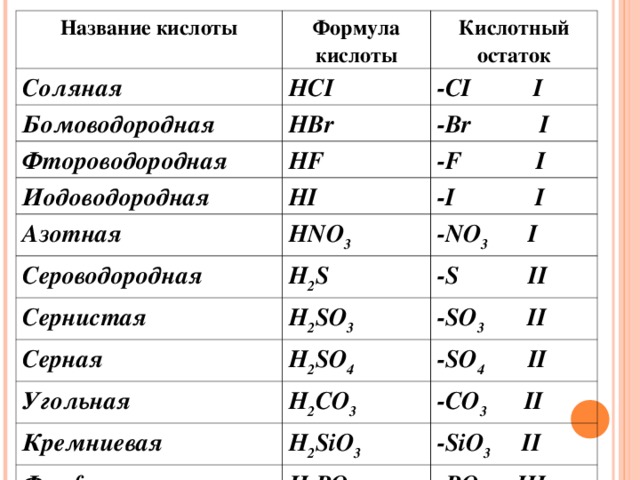
СОСТАВ КИСЛОТ
HCl, HBr, HNO 3 , H 2 SO 4 , H 2 SO 3 , H 2 S, H 2 CO 3 H 2 SiO 3 , H 3 PO 4 Общая формула HxA
А кислотный остаток, валентность равна количеству атомов водорода в кислоте
Название кислоты
Соляная
Формула кислоты
Бомоводородная
Кислотный остаток
НС I
- С I I
НВ r
Фтороводородная
-В r I
Иодоводородная
Н F
Азотная
- F I
Н I
Сероводородная
- I I
Н N О 3
Сернистая
Н 2 S
- N О 3 I
- S II
Н 2 S О 3
Серная
- S О 3 II
Угольная
Н 2 S О 4
Кремниевая
- S О 4 II
Н 2 СО 3
-СО 3 II
Фосфорная
Н 2 Si О 3
- Si О 3 II
Н 3 РО 4
-РО 4 III
КЛАССИФИКАЦИЯ КИСЛОТ
По количеству атомов водорода: одноосновные, двухосновные, трехосновные;
По содержанию кислорода : кислородсодержащие, бескислородные; По растворимости в воде: растворимые, нерастворимые ( H 2 SiO 3 ) ; По стабильности : стабильные, нестабильные. Например:
H 2 CO 3 → CO 2 + H 2 O
H 2 SO 3 → SO 2 + H 2 O
1. HCl
2. HBr
3. HNO 3
4. H 2 SO 4
5. H 2 CO 3
6. H 2 SiO 3
7. H 3 PO 4
КАЧЕСТВЕННЫЕ РЕАКЦИИ
Реакции, в результате которых доказывается наличие данного вещества или иона называются КАЧЕСТВЕННЫМИ. Качественным реагентом на КИСЛОТЫ являются индикаторы
Название индикатора
Метиловый оранжевый (м/о)
Окраска индикатора в кислой среде
Фенолфталеин (ф/ф)
Лакмус
РОЗОВЫЙ
БЕЗЦВЕТНЫЙ
КРАСНЫЙ
ПОЛУЧЕНИЕ КИСЛОТ
неМ exOy + H 2 O HxA
Например
СО 2 + H 2 O Н 2 СО 3
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
1. Кислота (НхА) + Основание (Ме(ОН)х ) →
→ Соль (МехАу) + Н 2 О
Н NO 3 + NaOH → NaNO 3 + Н 2 О
2. Кислота (НхА) + Ме (до Н 2 ) → Соль (МехАу) + Н 2
2HCl + Zn → ZnCl 2 + Н 2
3 . Кислота (НхА) + Основный оксид (МехОу ) →
→ Соль (МехАу) + Н 2 О
2HCl + CaO → CaCl 2 + Н 2 О
4 . Кислота (НхА) + Соль (МехАу ) →
→ Соль (МехАу) + Кислота (НхА)
H 2 SO 4 + Ba(NO 3 ) 2 → BaSO 4 + 2 HNO 3