?Нахождение в природе O
Кислород (лат. Oxygenium) — химический элемент главной подгруппы VI группы, второго периода периодической системы химических элементов Д. И. Менделеева c атомным номером 8. Обозначается символом O.
Кислород — химически активный неметалл. Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха.
Нахождение в природе O
?Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
?В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн).
Получение O
?В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
?В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
?Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4.
?Используют также реакцию каталитического разложения пероксида водорода Н2О2 в присутствии оксида марганца(IV).
?Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3.
?К лабораторным способам получения кислорода относится метод электролиза водных растворов щелочей, а также разложение оксида ртути(II) (при t = 100 °C).
?На подводных лодках обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком.
Физические свойства
?1 л кислорода имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при +50 °C) и спирте (2,78 мл/100 г при +25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при +961 °C).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком.
?При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при +2000 °C — 0,03 %, при +2600 °C — 1 %, +4000 °C — 59 %, +6000 °C — 99,5 %.
?Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
?Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы.
Химические свойства
?Сильный окислитель, взаимодействует со всеми элементами, кроме гелия, неона, аргона и фтора, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры.
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета.
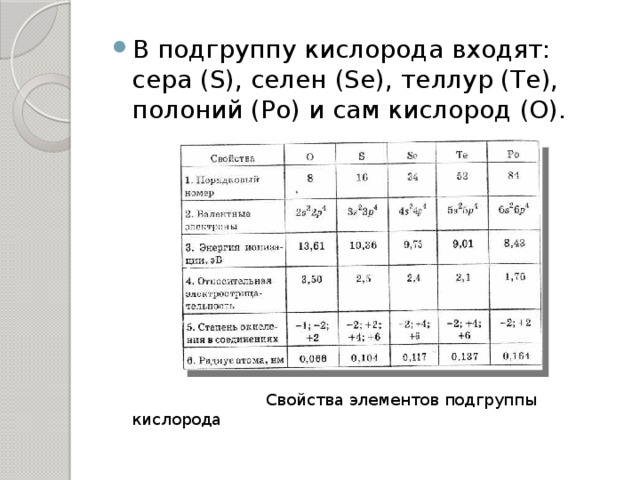
?В подгруппу кислорода входят: сера (S), селен (Se), теллур (Te), полоний (Po) и сам кислород (O).
Сера (S)
?Се?ра — химический элемент главной подгруппы VI группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Обозначается символом S (лат. sulfur).
? Чистая природная сера — твердое кристаллическое вещество желтого цвета. В природе сера встречается в самородном виде, образуя большие залежи. Коллекционным материалом являются хорошо образованные и ярко окрашенные кристаллы серы с алмазным и матовым блеском размером 1,5-15 см и более, а также щетки и друзы таких кристаллов.
Селен (Se)
?Селе?н — химический элемент главной подгруппы VI группы, 4-го периода в периодической системе, имеет атомный номер 34, обозначается символом Se (лат. Selenium),
Селен — хрупкий блестящий на изломе неметалл чёрного цвета (устойчивая аллотропная форма, неустойчивая форма — киноварно-красная).
Теллур (Te)
?Теллу?р — химический элемент главной подгруппы VI группы, 5-го периода в периодической системе, имеет атомный номер 52; обозначается символом Te (лат. Tellurium), относится к семейству металлоидов.
?Теллур — элемент, имеющий бело-серебристый оттенок и металлический блеск и хрупкую структуру. При высокой температуре, как и многие металлы, теллур становится пластичным.
Полоний (Po)
?Поло?ний — химический элемент главной подгруппы VI группы, 6-го периода в периодической системе Д. И. Менделеева, с атомным номером 84, обозначается символом Po (лат. Polonium).
?Полоний — мягкий серебристо-белый радиоактивный металл.