Сценарий урока по теме
«Неметаллы главной подгруппы IV группы»
Класс: 9 класс
Учитель химии: Чурбакова Елена Васильевна, учитель химии МАОУ СОШ №4 г.Искитима Новосибирской области.
Тип урока: комбинированный урок с демонстрационными и лабораторными опытами, направлен на объяснение нового материала.
Цель урока: создать условия для успешного изучения характеристики неметаллов IV группы Периодической системы: строение атомов, нахождение в природе, строения и свойств простых веществ.
Задачи урока:
Образовательные:
Познакомить учащихся с историческими сведениями об открытии элементов подгруппы углерода.
На основе положения элементов в периодической системе раскрыть строение атомов элементов главной подгруппы IV группы и возможные степени окисления атомов в соединениях.
Изучить строение и свойства аллотропных видоизменений углерода;
Раскрыть сущность явления адсорбции и познакомиться с эти явление на опыте.
Обобщить знания об окислительно-восстановительных свойствах неметаллов на примере углерода и кремния.
Развивающие:
Совершенствовать умения использовать информацию Периодической системы для характеристики состава, строения и сравнения химической активности атомов элементов.
Развивать навыки работы в паре при выполнении теоретического задания или эксперимента.
Совершенствовать навыки безопасной работы при выполнении эксперимента и обращении с химическими реактивами.
Продолжить формирование умений обрабатывать и анализировать экспериментальные данные, делать выводы о свойствах вещества.
Воспитательные:
Воспитывать чувство патриотизма на примере научных достижений русских учёных.
Воспитать культуру общения через работу в парах “ученик - ученик”, “учитель - ученик”.
Воспитать у учащихся наблюдательность, внимание, пытливость, инициативу и культуру эксперимента.
Оборудование для учителя:
- учебник «Химия 9 класс». Е.Е. Минченков и др.: М., Мнемозина, 2010
- модели кристаллических решеток алмаза и графита;
- мультимедийная авторская презентация «Неметаллы IV группы главной подгруппы»;
- компьютер, мультимедийный проектор, интерактивная доска;
- модели кристаллических решёток алмаза и графита.
Раздаточный материал для учащихся:
- периодическая система химических элементов Д. И. Менделеева;
- таблица растворимости.
Оборудование и реактивы для учащихся:
- активированный уголь;
- ступка с пестиком;
- пробирки, колба с пробкой, воронка;
- фильтр малый;
- микролаборатория с реактивами, посудой и оборудованием;
Ход урока:
Организационно-рефлексивный этап.
Здравствуйте, ребята! Рада всех вас видеть на очередной встрече – уроке химии! Как всегда, нашу встречу начнём с рефлексии прошлого занятия и домашней подготовки. Приступим.
Учащиеся анализируют свою деятельность на прошлом занятии по записям в тетрадях и сообщают, что нового узнали на прошлом уроке о соединениях фосфора, качественной реакции на фосфат-ион и областях применения фосфатов. А так же формулируют проблемы, возникшие при выполнении домашнего задания.
Проверка домашнего задания.
Ребята, давайте разберём упр.2 домашней работы и поможем тем одноклассникам, которые испытывает ещё трудности при составлении формул указанных веществ (слайд №1).
К слайду выходит ученик и на интерактивной доске записывает формулы веществ согласно названиям.
В это время: а) 4 ученика (по желанию) выполняют мини-тест (Приложение 1) по теме «Азотная кислота» и сдают свои работы учителю; б) пара учащихся (по желанию) экспериментально определяют качественный состав веществ в пробирках под № п/п (Приложение 2).
А теперь давайте предоставим слово нашим экспериментаторам! (слайд 2). Учащиеся рассказывают о ходе выполнения экспериментального задания и демонстрируют признаки проведённых реакций.
Этап целеполагания.
Сегодня на уроке мы продолжим изучение неметаллов (слайд 3). Наше внимание будет сосредоточено на элементах IV группы. Запишите в тетрадях дату и тему урока. Посмотрите, пожалуйста, в Периодическую таблицу Д.И.Менделеева и назовите сегодняшних «героев» нашей встречи.
Учащиеся называют элементы IV группы главной подгруппы Периодической системы.
Зная план изучения подгруппы, сформулируйте задачи нашего урока. Обсудив с учащимися предложенные задачи, учителем акцентируется внимание на основных видах деятельности учащихся на уроке (слайд 4).
Сегодня на уроке вы:
Узнаете о распространении элементов неметаллов в природе.
Вспомните особенности строения атомов элементов-неметаллов IV группы ПС и определите их возможные степени окисления в соединениях.
Познакомитесь с историческими сведениями открытия элементов подгруппы углерода;
Изучите строение и свойства аллотропных видоизменений углерода;
Познакомитесь на практике с явлением адсорбции;
Обобщить знания об окислительно-восстановительных свойствах неметаллов на примере углерода и кремния.
Этап изучение нового материала.
История открытия химических элементов.
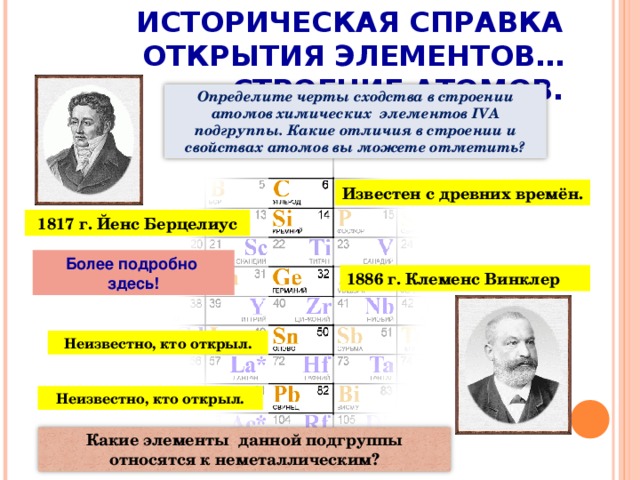
(Слайд 5) Историческая справка открытия элементов IV группы главной подгруппы не даёт нам сведений об открытии углерода. Это и понятно, ведь ещё древние люди практически познали древесный уголь около 100 тысяч лет назад! Кремний был открыт в 1817 году шведским химиком Йенсом Берцелиусом, германий был назван в честь Германии и открыт Клеменсом Винклером в 1886 году. Исторических сведений об открытии олова и свинца нет. Свинец известен с III – II тысячелетия до н.э.. В Месопотамии, Египте свинец использовали для изготовления статуй богов и царей, печатей и предметов быта. А теперь более подробно о каждом их элементов данной подгруппы (перейти по гиперссылке «Более подробно здесь!»).
Аллотропные видоизменения углерода.
Ребята, внимательно посмотрите в Периодическую систему и скажите, какие химические элементы IV группы являются неметаллическими? Учащиеся указывают на углерод и кремний. Верно! Давайте вспомним, какие общие и отличительные черты строения и проявляемых свойств характерны для атомов этих элементов, исходя из положения в ПС. Учащиеся сравнивают атомы элементов IV группы главной подгруппы по количеству валентных электронов и радиусу атомов и приходят к выводу об изменении окислительно-восстановителтьных свойств в подгруппе сверху вниз. Познакомимся со свойствами простых веществ, образованных углеродом.
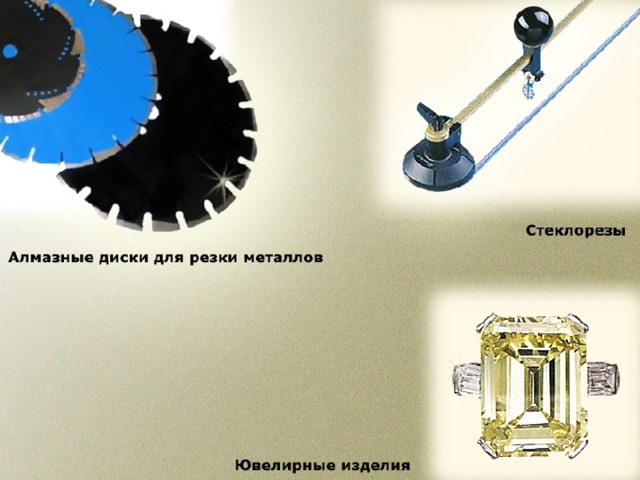
(Слайд 6) Углерод в природе встречается главным образом в виде двух простых веществ алмаза и графита. Но сегодня учёным известны и другие видоизменения углерода (перейти по гиперссылке «Более подробно здесь»). Сравните алмаз и графит по плану на слайде (Слайд 7).Учащиеся, работая в парах, сравнивают алмаз и графит и отмечают чёрный цвет, непрозрачность, металлический блеск, мягкость, электропроводность графита, применения его в качестве электродов и грифелей карандашей. У алмаза отмечают отсутствие цвета, металлического блеска и электропроводности, наличие прозрачности и твёрдости. Применяется для ювелирных украшений и изготовления стеклорезов.
Давайте подробнее познакомимся с областями применения алмаза (Слайд 8) и графита (Слайд 9). Эта информация дополнит ваши представления об областях применения этих веществ.
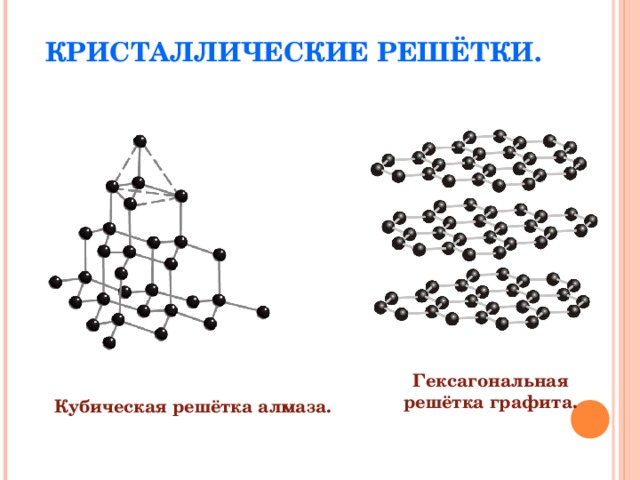
(Слайд 10) Почему же графит мягкий, а алмаз очень твёрдый? (Слайд 11) По шкале твердости природных соединений Мооса алмаз занимает почётное первое место! Учащиеся выдвигают свои гипотезы, среди которых предположение о разном строении простых веществ. Давайте ещё раз посмотрим на моделях, как устроены «изнутри» алмаз и графит (слайд 12, демонстрация моделей кристаллических решёток алмаза и графита) и сравним строение этих веществ и вид химической связи вежду атомами в веществах. Учащиеся сравнивают кристаллические решетки, отмечают слоистое расположение атомов в графите и равноудалённое расположение атомов углерода в алмазе. Отмечают ковалентный неполярный вид химических связей, одинаковый для двух веществ.
Действительно, в алмазе каждый атом углерода образует прочные ковалентные связи с четырьмя соседними атомами. Все связи равноценные, что обусловливает высокую прочность алмаза. А в графите не все связи одинаковы. Атомы образуют слои из шестиугольников и каждый атом углерода образует только три связи с соседними, а один из четырех непарных электронов остается незадействованным внутри слоя. Этим объясняется электропроводность графита. Так как между слоями действуют слабые силы межмолекулярного взаимодействия, то слои легко сдвигаются относительно друг друга. Когда вы рисуете графитовым карандашом, вы разрушаете связи между слоями, и на бумаге остаётся след графита, образованный шестиугольниками. Алмаз и графит – это аллотропные видоизменения углерода.
Физкультминутка. (Все дети встают около своих рабочих мест и повторяют движения за учителем):
Потянулись, улыбнулись, покрутили головой,
Руки за спину, прогнулись, изогнулись тетивой.
Руки в боки, повороты, что там сзади – поглядим!
А теперь мы – самолёты! Машем крыльями родным!
Сели – встали, сели – встали и попрыгали легко.
Мы нисколько не устали, дышим ровно, глубоко.
Явление адсорбции.
(Слайд 13) Мельчайшие кристаллики графита, которые трудно рассмотреть даже в микроскоп, образуют хорошо вам известный древесный уголь. Тщательно очищенный от примесей уголь называется активированным и обладает очень интересным свойством, благодаря своему пористому строению. Давайте познакомимся поближе с явлением адсорбции (слайд 14, видеоопыт «Поглощение паров брома активированным углем»). Запишите в тетрадях определение понятия адсорбции.
(Слайд 15) Убедитесь на практике в свойствах активированного угля, выполнив эксперимент. Учащиеся выполняют лабораторный опыт по инструкции на слайде и делают вывод об адсорбционных свойствах угля.
(Слайд 16) Способностью активированного угля воспользовался русский химик Н.Д. Зелинский, который в 1916 году совместно с инженером А. Кумантом разработал конструкцию первого в мире противогаза. Явление адсорбции лежит в основе действия воздухоочистителей, фильтров очистки воды, таблеток.
Химические свойства углерода и кремния.
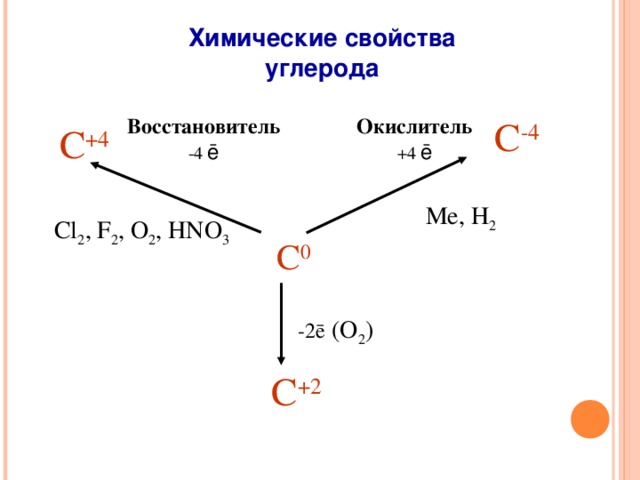
(Слайд 17) Данная схема отражает химические свойства простого вещества углерода. Окислять углерод способен только водород до метана СН4 и металлы до карбидов. Реакции окисления идут в жёстких условиях, что свидетельствует о низкой окислительной способности углерода. Кремний не окислять водород по причине низкой активности, хотя соединения с активными металлами – силициды образует. Восстановительные свойства углерод и кремний проявляют в реакциях с сильными окислителями, такими, как кислород, хлор, фтор, азотная кислота. Углерод – хороший восстановитель металлов из их оксидов, поэтому применяется в металлургии для получения металлов их руд.
(Слайд 18) Составьте уравнения химических реакций по схемам, укажите переход электронов и определите роль углерода. Учащиеся работают в тетрадях. По очереди выходят к слайду и на сенсорной доске дописывают уравнения реакций.
Этап самоконтроля.
(Слайд 19) Наше занятие подходит к концу. Мы сегодня с вами хорошо поработали, много узнали нового, повторили изученный материал. Теперь проверьте, насколько эффективно была ваша работа. Учащиеся выполняют тестовую работу (Приложение 3). После выполнения проверяют себя (слайд20).
Этап информации о домашнем задании.
(Слайд 21) Дома вы внимательно прочитаете § 29 по учебнику и устно ответите на вопрос №2. Письменно выполните упражнения №4 и №6.
Этап подведения итогов занятия.
(Слайд 22) Ребята, вы сегодня отлично потрудились! Всем спасибо за участие и работу на уроке! Учитель выставляет учащимся оценки за урок и баллы участия.
Список литературы и Интернет-ресурсов.
Химия. Учебник 9 класса/ Авторы: Е.Е.Минченков, А.А.Журин, П.А.Оржековский – Москва: Мнемозина, 2010
.Программы и тематическое планирование для общеобразовательных учреждений. Химия. 8-11 классы/ [авт.-сост. А.А.Журин и др.].-Москва: Мнемозина, 2011
Ирина Андржеевская. Физкультминутки. Упражнения для начальной школы – Москва: Вита Пресс, 2012
Сайт «Федеральный центр информационно-образовательных ресурсов», ЭОР «Углерод в природе. Строение атома углерода. Аллотропия» http://www.fcior.edu.ru/card/3841/uglerod-v-prirode-stroenie-atoma-ugleroda-allotropiya.html
Сайт «Федеральный центр информационно-образовательных ресурсов» , ЭОР «Общая характеристика подгруппы углерода» http://www.fcior.edu.ru/card/10112/obshaya-harakteristika-podgruppy-ugleroda.html
Иллюстрации с коллекции цифровых образовательных ресурсов. http://school-collection.edu.ru/ в разделе «Химия» для 9 класса.