Когда-нибудь настанет время – и это время не за горами, – когда мерилом ценности станет не золото, а энергия. И тогда изотопы водорода спасут человечество от надвигающегося энергетического голода: в управляемых термоядерных процессах каждый литр природной воды будет давать столько же энергии, сколько ее дают сейчас 300 л бензина.(Д.И.Щербаков)
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
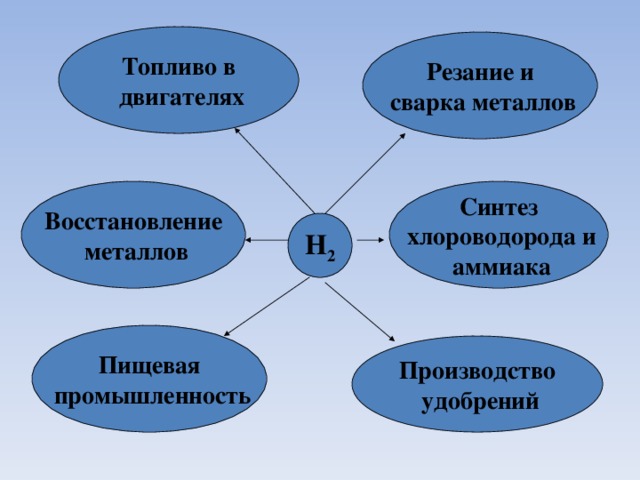
Химические свойства водорода и применение
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Химические свойства водорода и применение »
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
1930 руб.
2760 руб.
1990 руб.
2840 руб.
2200 руб.
3140 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства