?анатов Н?рталап Жа?сылы??лы
?ызылорда облысы, Арал ?аласы
№ 220 мектебі химия п?ніні? м??алімі
Сыныбы: 9
Саба?ты? та?ырыбы: «Кальций. Периодты? ж?йедегі орны. Атомыны? ??рылысы»
Саба?ты? ма?саты:
Білімділігі: Периодты? ж?йедегі орны бойынша кальций атомыны? ??рылысы, ашылу тарихы,таби?атта таралуы,алынуы,физикалы?,химиялы? ?асиеттері жайында, оны? ?осылыстары, к?нделікті ?мірде ?олдану салаларымен таныстыра отырып, ал?ан білімдерін жадында са?тау, ойлау ?абілетін дамыту, білімге ??штарлы?ын, д?ниетанымды? к?з?арасын арттыру.
Т?рбиелілігі: О?ушыларды ?йымшылды??а, т?зімділікке, ??ыптылы??а, жауапкершілікке т?рбиелеу.
Дамытушылы?ы: О?ушыларды? ?з бетімен, ?жыммен ж?мыс істеу біліктіліктерін дамыту, есте са?тау, ой – ?рісін ке?ейту, ?мірдегі к?рген деректерді пайдалана білуіне ж?не шы?армашылы?пен ж?мыс істеуге да?дыландыру.
К?тілетін н?тиже: О?ушылар кальций туралы жалпы ма?л?маттар алып, кальциймен т?жірибе ж?мыстарын жасау?а, реакция те?деулерін те?естіруді білетін болады.
Саба?ты? типі: Жа?а саба?ты ме?герту
Саба?ты? т?рі: Аралас саба?
Саба?ты? ?дісі: С?ра? – жауап, зертханалы? т?жірибе, топты? ж?мыс, тірек – сызбалармен ж?мыс, дифференциалау ?дісі.
Техникалы? ??ралдар: Презентация, интерактивті та?та, электронды? о?улы?.
К?рнекілігі: Д. И. Менделеев кестесі, бейнетаспа,
П?наралы? байланысы: Биология, география, медицина
Реактивтер: Са, Mg, HCI, C20H14O4, СаС2,
Химиялы? ыдыстар: спиртшам, колба, пенцет, пипетка, стакан т.б.
Просмотр содержимого презентации
«кальций 9»

Қанатов Нұрталап Жақсылықұлы
Қызылорда облысы,
Арал қаласы
№ 71 мектебі химия пәнінің мұғалімі



Маған айтсаң –
мен ұмытамын,
Маған көрсетсең –
мен есте сақтаймын,
Маған жасатсаң –
мен түсінемін.
Конфуций
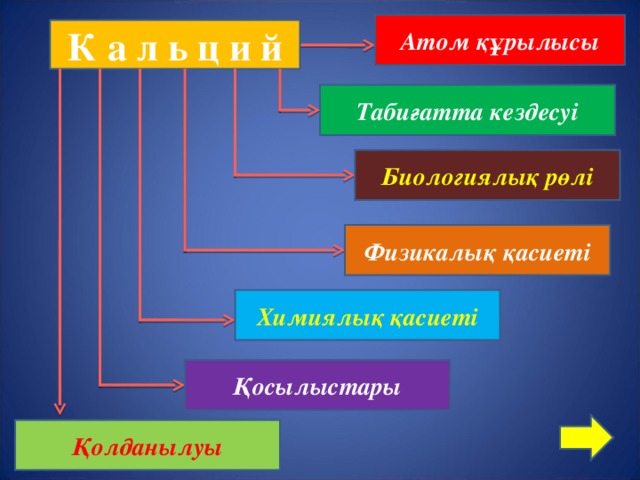
Атом құрылысы
К а л ь ц и й
Табиғатта кездесуі
Биологиялық рөлі
Физикалық қасиеті
Химиялық қасиеті
Қосылыстары
Қолданылуы
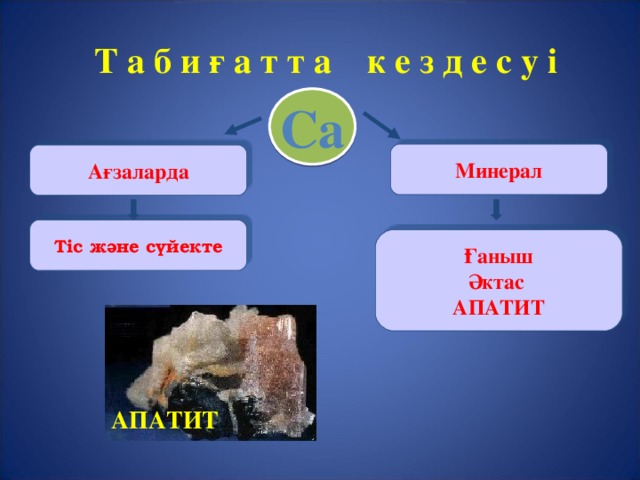
Т а б и ғ а т т а к е з д е с у і
Са
Минерал
А ғзаларда
Тіс және сүйекте
Ғаныш
Әктас
АПАТИТ
АПАТИТ
Тақырып: Атомдардың электрондық
бұлттарының құрылысы
.
31 Октябрь, 2016
I. Электрондық бұлттардың құрылысы
.
- Бір квантты ұяшықта спиндері әр түрлі екі электрон бола алады.
- Орбиталь квантты ұяшықтардан тұрады.
3d 0
0
Р
31
3p 3
3p 3
+15
3s 2
3s 2
5
8
2
2p 6
2p 6
2s 2
2s 2
1 s 2
1 s 2
- Қысқаша электрондық формула.
7
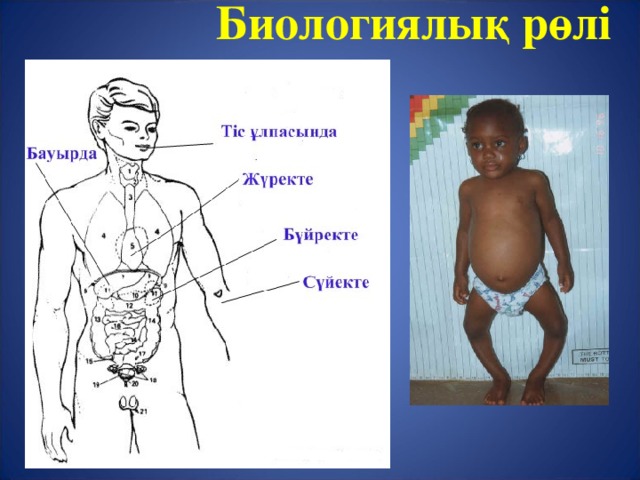
Биологиялық рөлі


Физикалық қасиеті:
Кальций күміс түстес, ақ түсті, қатты, жеңіл, тығыздығы – 1,54г/см 3 , 850 0 С – та балқитын, 1482 0 С – қайнайтын металл. Ауада тез тотығып кететін болғандықтан керосинде сақтайды.

Алынуы:
1808 ж. а ғылшын химигі Хэмфри Дэви сөндірілген ылғал ізбізді сынап оксидімен қосып, қоспа дайындап, платина пластикасынан электр тоғын жіберу арқылы кальцийді алды.
1855 ж. неміс химигі Роберт Вильгельм Бунзен кальций хлоридінің балқымасынан электролиз әдісімен алды.
CaCI 2 → Ca + CI 2
4CaO + 2AI → CaAI 2 O 4 + 3Ca

ХИМИЯЛЫҚ ҚАСИЕТІ
Метал оксидтерімен :
Са + Nb 2 O 5 =
Бейметалдармен :
Са + S =
Ca + P =
5 Са +Nb 2 O 5 = 5Ca +2 O -2 +2Nb 0
Са 0 + S 0 = Са + 2 S -2
3Ca 0 + 2P 0 = Ca +2 3 P -3 2

Кальцийдің қосылыстары
Бор Ca СО 3
Мәрмәр
Ғаныш CaSO 4 • 2 H 2 O
Карбид

Кальций дің қолданылуы
Са








































