В этой презентации рассматриваются химические свойства альдегидов и кетонов
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
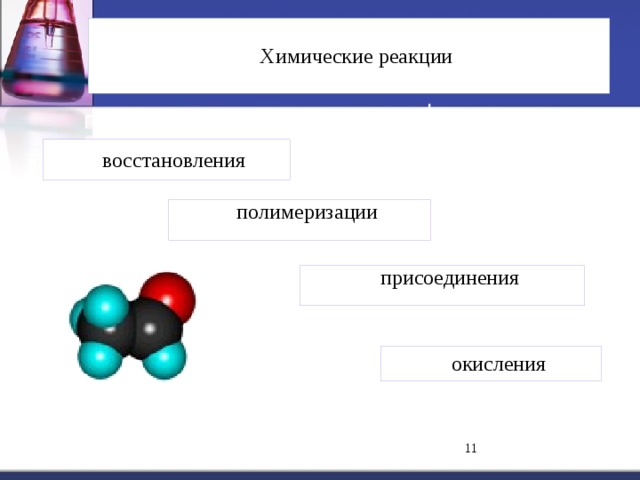
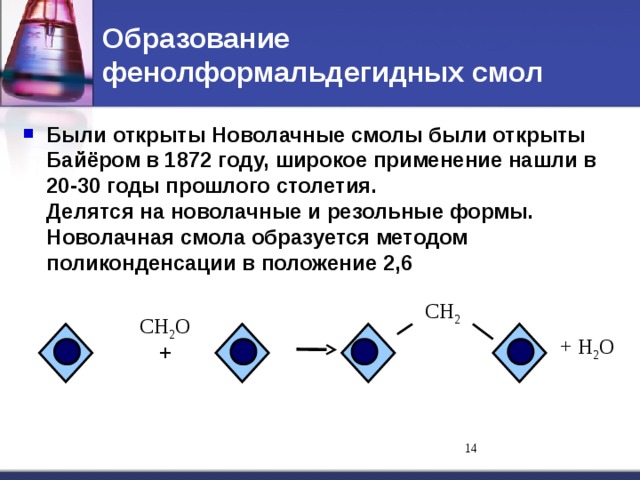
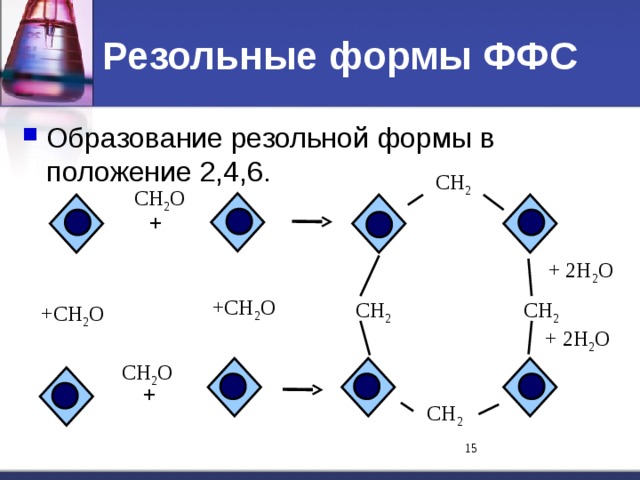
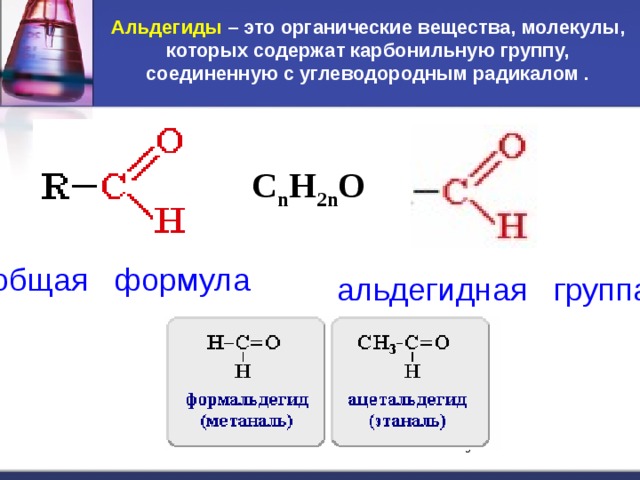
Альдегиды и кетоны
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Альдегиды и кетоны»
Полезное для учителя
Распродажа видеоуроков!
1970 руб.
2820 руб.
2200 руб.
3140 руб.
2200 руб.
3140 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства


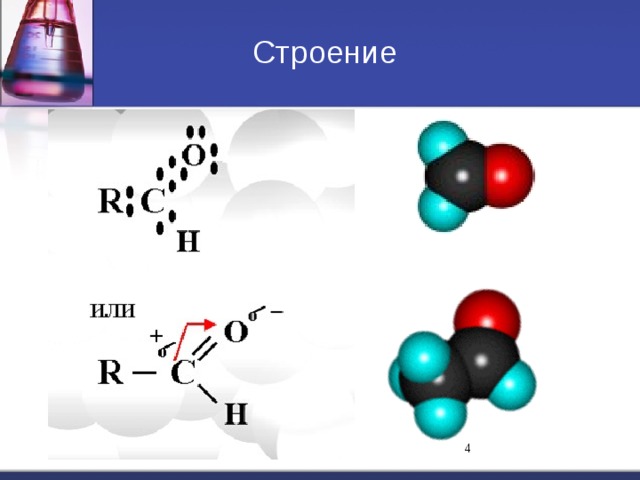
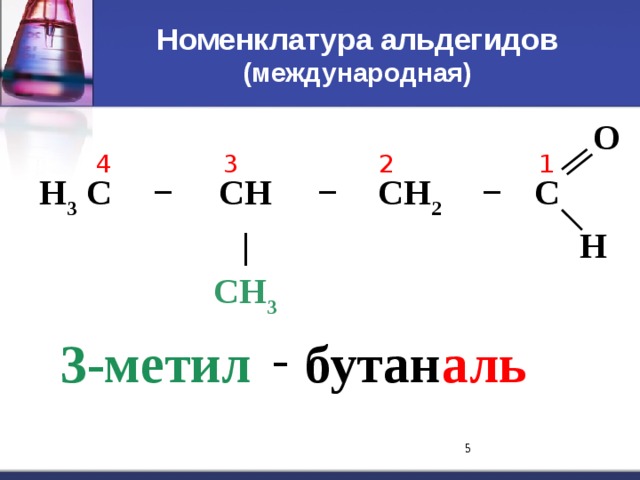
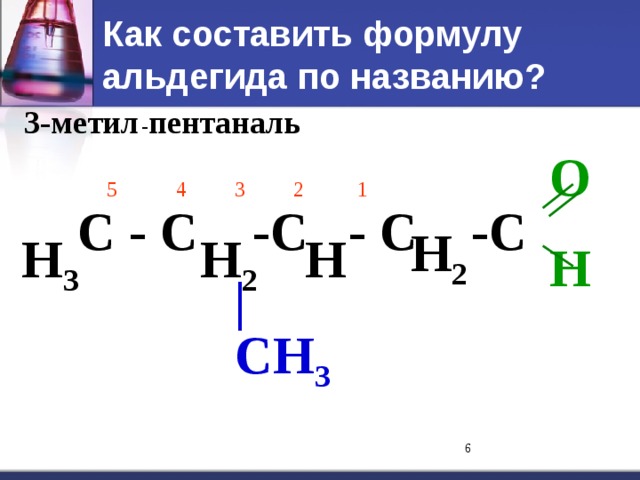

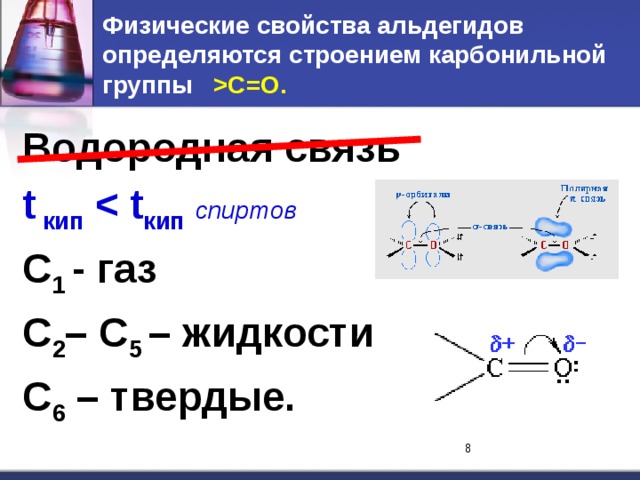 C=O. Водородная связь t кип кип спиртов С 1 - газ С 2 – С 5 – жидкости С 6 – твердые." width="640"
C=O. Водородная связь t кип кип спиртов С 1 - газ С 2 – С 5 – жидкости С 6 – твердые." width="640"

![Способы получения Окисление спиртов с помощью дихромата калия в кислой среде. 1. СН 3 -СН 2 -ОН + [О] → СН 3 -СН=О + Н 2 О Окисление оксидом меди при нагревании. 2. СН 3 -ОН + СuO → СН=О + Н 2 О + Сu Дегидрирование первичных спиртов.(Pt) 3. СН 3 -СН 2 -ОН → СН 3 -СН=О + Н 2 Из дигалогензамещённых щёлочью. 4. СН3-СНСl2+2NaОН→ 2NaСl+СН3-СН=О + Н 2 О](https://fsd.kopilkaurokov.ru/up/html/2018/03/19/k_5aafad3360b8f/img_user_file_5aafad379c68d_9.jpg)