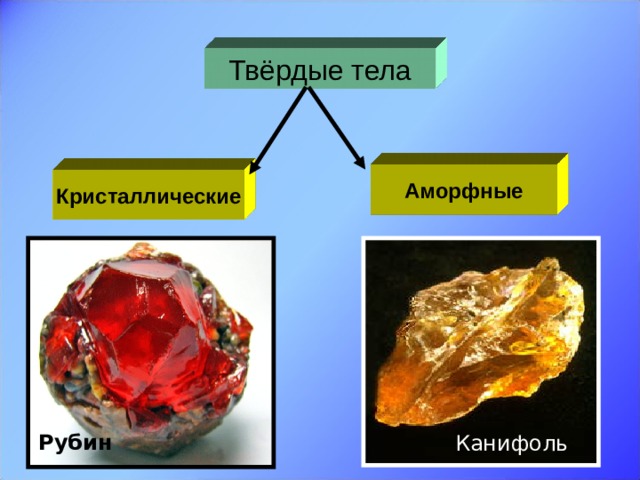
| 4. Усвоение новых знаний. 1). Определение характерных признаков кристаллов. На бригаду вам выданы наборы веществ. Нужно определить, какие вещества являются кристаллическими, а какие аморфными? Как вы будете это делать? Слайд 5. Обратите внимание на экран, задание: Рассмотрите через лупу данные вам образцы и определите, какие из них являются кристаллами, а какие аморфными телами, и отметьте это в таблице (Приложение 1). Обсудите вопросы: Какой наиболее характерный внешний признак присущ для кристаллических тел и отсутствует у аморфных? Как это связано с внутренним строением кристаллов и аморфных тел? Время работы над заданием – 2 мин. Проверим, правильно ли вы отделили кристаллические тела от аморфных. Под нечётными номерами – кристаллы, под чётными – аморфные тела. У кого правильно? С одной ошибкой? ... Слайд 6. Давайте ещё посмотрим кристаллы и обратим внимание на их красивую правильную форму, четкие грани.
2). Выявление особенностей внутреннего строения кристаллов.
В чём причина этого? Как связана внешняя красота с их внутренним строением? (спрашиваю). Об этом - видеофрагмент. Слайд 7. Какое дадим определение кристалла? Посмотрите, форма кристалликов разных веществ различна. С чем это связано? Симметрия кристаллов проявляется в том, что элементарные ячейки кристаллической решётки повторяются. И таким образом происходит рост кристалла. Слайд 8. А теперь рассмотрим два хорошо известных вам вещества: графит (сердечко карандаша) и алмаз (самый прочный материал в природе). Алмаз необычно тверд, прозрачен, он диэлектрик, обработанные алмазы — драгоценность, известны в быту как бриллианты. Графит мягок, легко расслаивается, непрозрачен, электропроводен и не похож на драгоценный камень. А между тем и алмаз, и графит — это чистый углерод. С чем же связано различие их свойств? Сравните кристаллические решётки графита и алмаза. В чём причина мягкости, лёгкого расслаивания графита? Расстояние между слоями больше расстояния между атомами в слое. А значит, силы взаимодействия между слоями ослаблены. Что происходит, когда мы пишем карандашом? Слои графита ложатся на бумагу. А у алмаза? Упаковка атомов плотная. Отсюда и большая твёрдость.
3). Определение видов кристаллов и их отличительных признаков.
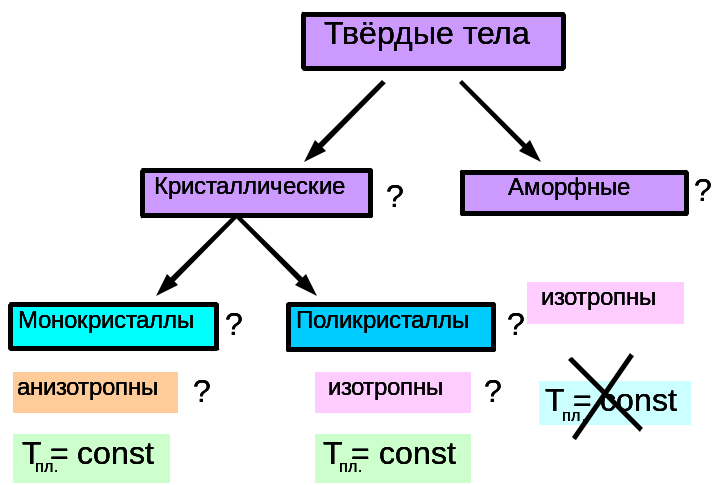
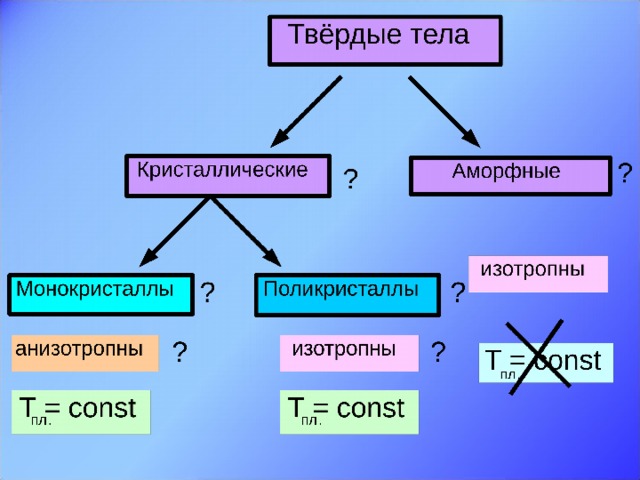
Слайд 9. В мире кристаллов существуют монокристаллы – это одиночные кристаллы. Их физические свойства: 1) правильная форма, 2) постоянная температура плавления, 3) анизотропия. Слайд 10. Анизотропия – это зависимость физических свойств от выбранного в кристалле направления. Все монокристаллы анизотропны. Что это означает?
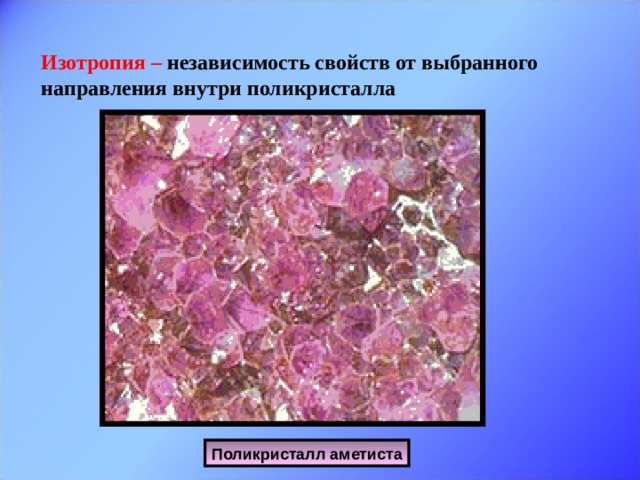
Анизотропия - основной отличительный признак монокристаллов. Анизотропия в монокристаллах проявляется в том, что монокристаллы по-разному проводят теплоту и электрический ток в различных направлениях, от направления зависят и оптические свойства монокристаллов. Так, проходя через монокристалл исландского шпата, луч света раздваивается, т.е. наблюдается двойное лучепреломление. Анизотропия у слюды проявляется в том, что механическая прочность её в разных направлениях внутри кристалла различна. Кусок слюды легко расслаивается на пластинки только в одном направлении, а в направлении перпендикулярном пластинкам, её разломить труднее. Причину анизотропии монокристаллов узнаем из видеофрагмента. Кто как понял причину анизотропии? Слайд 11, 12. Наряду с монокристаллами существуют поликристаллы, твёрдые тела, состоящие из многочисленных сросшихся монокристалликов. Их физические свойства: постоянная температура плавления, изотропия (независимость свойств от направления внутри поликристалла). Т.е. какое бы направление мы не взяли, все физические свойства в поликристалле одинаковы! Как же это объяснить? Ведь монокристаллики, из которых состоит поликристалл, анизотропны?
4). Выявление отличий аморфных тел от кристаллических.
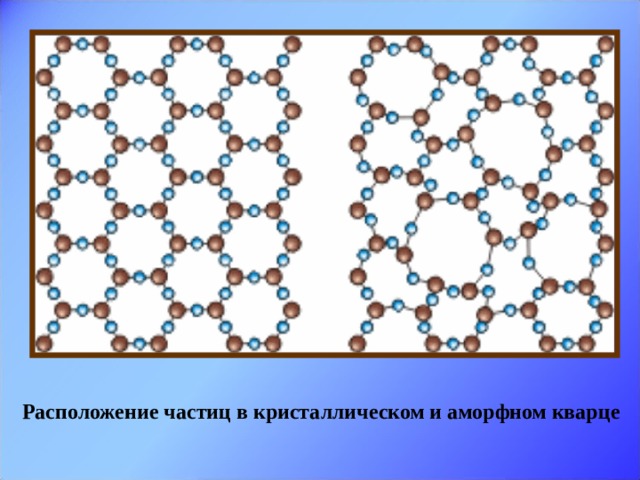
Слайд 13. Вторая группа – аморфные тела. Одно и тоже вещество может находиться как в кристаллическом, так и в аморфном состоянии. Сравним расположение частиц в кристаллическом и аморфном кварце. И дадим определение аморфным телам. Это твёрдые тела, у которых нет строгого порядка в расположении атомов. Слайд 14. Физические свойства аморфных тел: нет постоянной температуры плавления, по мере повышения температуры размягчаются; изотропны, т.е. их физические свойства одинаковы по всем направлениям; при низких температурах ведут себя подобно твёрдым телам, а при высоких - подобно жидкостям. При кратковременных воздействиях (ударах) аморфные тела проявляют свойства твёрдых тел и при сильном ударе раскалываются на куски. При продолжительном воздействии - текут. Чем объясняется изотропность физических свойств аморфных тел? Примеры аморфных тел: смола, воск, вар, сахарный леденец, янтарь – окаменелый древесный сок.
5). Рассмотрение областей применения кристаллов.
Слайд 15. Жидкие кристаллы, открытые в конце 19 века, обладают двойственностью свойств: они имеют упорядоченную структуру, как кристаллы, и способны к текучести, как жидкости. Это в основном органические вещества, молекулы которых имеют длинную нитевидную форму или форму плоских пластин. Сфера применения жидких кристаллов постоянно расширяется.
Слайд 16. Великолепие кристаллов издавна вдохновляет людей на создание красивейших ювелирных украшений и декоративных изделий. И хотя большая часть земной коры находится в кристаллическом состоянии, великая лаборатория-природа - уже не может удовлетворить наш спрос. Слайд 17. С давних пор человек мечтал синтезировать камни, столь же драгоценные, как и встречающиеся в природе. До 20 в. такие попытки были безуспешны. Первыми получили искусственные рубины и сапфиры в 1902 г, затем изумруды, и в 1955 искусственные алмазы. Искусственные кристаллы получили название фианиты. Как вы думаете, они нужны только для украшений? Слайд 18. Особенно ценны кристаллы, выращиваемые в космосе. Перед вами кристаллы различных белков, выращенные на станции «Мир» и во время полётов шаттлов НАСА. Слайд 19. Области применения кристаллов очень разнообразны. Из них даже делают картины. Перед вами подборка картин на космическую тематику. Какое великолепие! Слайд 20. А как вы думаете, что это такое? (нанокристаллы) Слайд 21. С помощью нанотехнологий создают и такие пейзажи. Слайд 22. А вот кристаллики льда, собранные в снежинки. Посмотрите, ни одна снежинка не является точной копией другой! До сих пор не удалось найти из них двух одинаковых. |