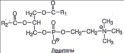
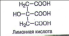
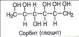
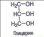
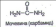Данный конспект урока является интегрированным по физике и химии.Даёт возможность раскрыть суть очень интересной темы по твёрдым телам.С точки зрения химии расписано строение тел, показаны различные виды кристаллических решоток.Приведены на картинках примеры твёрдых тел виде камней.Урок интересный, ученикам данный урок очень нравиться.
- Меню
- Главная
- Дошкольное образование
- Начальные классы
- Астрономия
- Биология
- География
- Информатика
- Математика
- Алгебра
- Геометрия
- Химия
- Физика
- Русский язык
- Английский язык
- Немецкий язык
- Французский язык
- История
- Естествознание
- Всемирная история
- Всеобщая история
- История России
- Право
- Окружающий мир
- Обществознание
- Экология
- Искусство
- Литература
- Музыка
- Технология (мальчики)
- Технология (девочки)
- Труд (технология)
- Физкультура
- ИЗО
- МХК
- ОБЗР (ОБЖ)
- Внеурочная работа
- ОРК
- Директору
- Завучу
- Классному руководителю
- Экономика
- Финансовая грамотность
- Психологу
- ОРКиСЭ
- Школьному библиотекарю
- Логопедия
- Коррекционная школа
- Всем учителям
- Прочее
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
"Кристаллические и аморфные тела" конспект урока по физике 10 класс
Просмотр содержимого документа
«"Кристаллические и аморфные тела" конспект урока по физике 10 класс»
Интегрированный 2-х часовой урок (физика, химии) по теме: «Кристаллические и аморфные тела», 10 класс.
Цель урока: Раскрыть основные свойства кристаллических и аморфных тел, опираясь на метапредметные связи курсов физики – химии и продолжив формировать представление об окружающем нас мире, природе, как о едином целом.
Задачи урока:
С помощью метапредметного подхода в обучении способствовать усвоению связей между физическими и химическими понятиями: определить, в каких они находятся взаимоотношениях, какие позиции спорят, сталкиваются и тем самым задают живое разворачивание науки.
Показать различие в строении и свойствах кристаллических и аморфных тел.
Повторить зависимость свойств веществ от типов кристаллических решеток, химической связи и строении атомов.
Дать понятие о жидких кристаллах (ЖК).
Рассмотреть аморфное и кристаллическое строение полимеров на примере полиэтилена.
Формировать у учащихся способность к самовыражению.
Развивать умения анализировать полученную информацию, сопоставлять и находить общие закономерности в многообразии физических и химических процессов.
Усилить практическую направленность обучения.
Формировать ИКТ – компетенций учащихся.
Совершенствовать умение и навыки работать в парах.
Преодолеть предметную инертность мышления и расширить кругозор учащихся.
Оборудование урока: компьютер, мультимедийный проектор, экран, документ - камера, модели кристаллических решеток разных типов; реактивы и приборы для проведения демонстрационных опытов, выращенные кристаллы, на столах у учащихся: лупа, кристаллические и аморфные вещества - металлы и сплавы, коллекция минералов, известняк, поваренная соль, полиэтилен, графит, сахар – рафинад, пластилин, гипс, парафин, стекло, жевательная резинка, леденцы, антрацит, каучук, песок; презентации: «Свойства кристаллических и аморфных тел»; «Жидкие кристаллы»; «Способы выращивания кристаллов»; «Применение кристаллических и аморфных тел»; видеоролики, демонстрирующие опыты, выполненные учителями и учащимися при подготовке к данному уроку, магнитофон.
Подготовка у уроку происходит в течение двух месяцев: это время необходимо для того, чтобы сформировать инициативную группу из учащихся 10 класса, которые собирают и обрабатывают информацию о способах выращивания кристаллов, выполняют практическую работу по выращиванию кристаллов солей, оформляют результаты своей работы, а также готовят презентации и сообщения по темам, обозначенным им учителями физики и химии. В результате такой подготовки создается коллекция кристаллов солей медного купороса, железного купороса, алюмокалиевых квасцов, поваренной соли; а также хромата и дихромата калия, иодида свинца, красной и желтой кровяных солей, нитрата калия (их выращивает учитель химии ; перечисленные выше вещества токсичны, поэтому учащиеся только фотографируют уже готовые кристаллы).
Учителя химии и физики выращивают кристаллы меди за месяц до урока, с помощью учащихся этот опыт записывается на видео и демонстрируется во время урока.
Ход урока.
Звучит музыка. Учителя приветствуют учащихся.
Учитель физики: Как разнообразен мир музыки, так и разнообразен мир веществ. Нас удивляет блеск различных металлов, разнообразие природных минералов. Мы уже не можем обойтись без современных сплавов и пластмасс.
Учитель химии: А нужные лекарства спасают людям жизнь. Нас окружает огромное количество веществ. Небольшая их часть находится на ваших рабочих столах. Вещества разные, но агрегатное состояние их одинаковое. Какое? Правильно: все эти вещества твердые.
Учитель физики: Вещества, которые находятся на ваших столах, имеют разное внутреннее строение. Есть среди них вещества – кристаллы. Кристаллы окружают нас повсюду: мы ходим по кристаллам, строим из кристаллов, создаем приборы и изделия из кристаллов, широко применяем кристаллы в науке и технике, мы даже едим кристаллы, выходим на просторы космических дорог с помощью кристаллов.
Учитель химии: Но есть на ваших столах вещества, которые и по строению, и по свойствам отличаются от кристаллов. Вспомните, что часто людей, у которых нет своей определенной позиции, которым, как говорят, «все - равно» называют аморфными. Часть веществ, находящихся на ваших столах, также называют аморфными.
Учитель физики: Чтобы выяснить отличие кристаллических и аморфных веществ, их свойства, мы заглянем внутрь этих веществ. Ведь как говорил русский философ Н.А.Бердяев: « Познать сущее нельзя извне, можно только изнутри». Запишите, пожалуйста, тему урока: « Кристаллические и аморфные тела». Говорить о них мы будет с точки зрения двух наук: физики и химии. Ведь именно новейшая физика сумела решить такие вопросы химии, как природа химической связи, особенности химического строения молекул органических и неорганических соединений и т.д.
Я обращаю ваше внимание на вопросы, которые находятся у вас на рабочих столах. Сегодня вы получите ответ на большинство этих вопросов. Будьте внимательны, ведите записи в рабочих тетрадях и отмечайте вопросы, на которые вы услышите ответ. Ответы на оставшиеся вопросы вы должны будете сформулировать самостоятельно дома в том случае, если у нас не останется времени для их освещения.
Список вопросов
1 . Что такое кристаллическая решетка?
2. Какие существуют виды кристаллических решеток?
3. Какие твердые вещества называют кристаллическими, а какие – аморфными?
4. В чем сходство и различие между твердыми кристаллическими и твердыми аморфными телами?
5. Какое из состояний твердого тела более устойчиво: кристаллическое или аморфное?
6. Почему температура кристаллического вещества при плавлении (кристаллизации) не изменяется, а теплота к нему подводится (выделяется)?
7. Почему у твердого аморфного тела нет определенной температуры плавления? Опишите, какие изменения происходят в расположении и движении молекул при плавлении твердого аморфного тела.
8. Нарисуй примерный график плавления аморфного тела. Для получения такого графика можно пронаблюдать за плавлением парафина.
9. Почему твердые аморфные тела изотропны, а монокристаллы обладают анизотропией физических свойств?
10. Чем отличаются монокристаллы и поликристаллы одного вещества?
11. Почему каждый монокристалл имеет вполне определенную геометрическую форму?
12. Предложите способ перевода кристалла в жидкое или газообразное состояние.
13. Почему жидкий кристалл можно считать одновременно и жидкостью, и кристаллом?
12. Какие свойства жидких кристаллов используются в индикаторах и в ЖК – дисплеях?
14. В чем физическое отличие крупинки сахара от куска рафинада?
15. Почему варенье и мед при долгом хранении «засахариваются»?
16.Металлы и сплавы имеют кристаллическую структуру, однако на практике анизотропия механических, тепловых, световых, электрических свойств у них проявляется довольно редко. Почему?
Учитель химии: Химия и физика изучают практически одни и те же объекты, но только каждая из них в этих объектах свою сторону, свой предмет изучения. Вспомните, пожалуйста, такое понятие как «кристаллическая решетка».
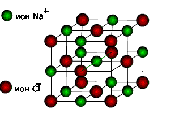
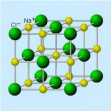
Ученик: Кристаллические вещества характеризуются правильным расположением частиц, из которых они построены: атомов, молекул или ионов. Эти частицы расположены в строго определенных точках пространства - называемых узлами. Если соединить узлы прямыми линиями, то образуется пространственный каркас – кристаллическая решетка.
Интересно, что слово «krystallos» (греч.) первоначально обозначало обычный лед, а в дальнейшем – горный хрусталь. В древности горный хрусталь (кристаллы кварца) действительно считались окаменевшим льдом. По названию частиц, которые могут стоять в узлах решеток (ионы, атомы, молекулы), различают виды кристаллических решеток: ионная, молекулярная, атомная, а еще металлическая (ответ ученика сопровождается презентацией, а также пояснениями учителя химии, который приводит конкретные примеры веществ с различными видами кристаллических решеток и рассказом учителя физики о том, какими физическими свойствами обладают вещества с различными видами кристаллических решеток).
Схема 1. Кристаллические решетки.
| КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ | |||||||||||
|
|
|
|
|
| |||||||
| металлические | ионнные | атомные | молекулярные | ||||||||
|
|
|
|
|
| |||||||
| В узлах или ионы, или атомы металлов, а в промежутках – электроны (металлы) | В узлах чередуются катионы и анионы; это соединение с ионной связью (оксиды, соли) | В узлах – атомы, ковалентно связанные друг с другом (простые вещества - неметаллы) | В узлах – молекулы; такие решётки образуют соединения неполярного (О2, Cl2) и полярного (H2O, HCl) типов | ||||||||
|
|
|
|
|
| |||||||
| Высокие температуры плавления и твердость, металлический блеск, электропроводность | Высокие твердость и тугоплавкость, малая летучесть | Высокие температура плавления, прочность и твердость, нерастворимость в жидкостях | Малая твёрдость, низкие температура плавления, нерастворимость в воде, не проводят ток, летучи | ||||||||
Учитель физики: Для того, чтобы дать определение понятиям «кристаллические и аморфные тела», изучить их свойства, отличие кристаллов от аморфных тел, веществ, мы покажем вам вот такой опыт.
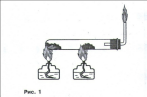
Демонстрационный опыт №1. Теплопроводность некоторых кристаллов по различным направлениям неодинакова. Покрывают кристаллик гипса и стеклянную пластинку тонким слоем парафина и прикасаются к ним накаленной иглой с деревянной ручкой (в пламени спиртовки нагревается докрасна конец иглы) с обратной стороны пластинок (а). Опыт показывают оба учителя с помощью документ – камеры. Опыт может показать заранее подготовленный ученик. На экране учащиеся увидят, что вокруг иглы парафин расплавляется, причем на гипсовой пластинке образуется «проталина» парафина в виде эллипса (б), в то время как на стеклянной пластине получается круг (в). 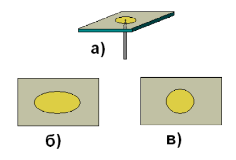
Рис. 1. Изображение, полученное на гипсовой (б) и стеклянной (в) пластинках.
Учащимся предлагается сделать предположение относительно принадлежности гипса и стекла к кристаллическим или аморфным веществам, а затем учитель физики дает понятие « анизотропии» кристаллических тел (определение выводится на экран) и предлагает учащимся сделать вывод по наблюдениям, которые они видели во время опыта. Учитель химии напоминает учащимся формулу гипса, химический состав стекла и парафина: гипс CaSO4·2H2O представляет собой кристаллогидрат, используется в строительстве, в медицине для наложения неподвижных гипсовых повязок, для получения слепков. Для этого применяют полуводный (жженый) гипс 2CaSO4·H2O – алебастр, который при взаимодействии с водой образует двуводный гипс:
2CaSO4·H2O + 3H2O = 2(СaSO4·2H2O)
Эта реакция идет с выделением теплоты. Обычно оконное стекло имеет состав, который можно выразить формулой Na2O·CaO·6SiO2. Хотя точное время возникновения стеклоделия историкам неизвестно, они почти единодушны относительно того факта, что Левант (Ближний Восток) – «родина» стекла как материала. Это сплав кварцевого песка, соды и известняка. Парафин получают из мазута, продукта фракционной перегонки нефти, нефтяного остатка. Термин «парафин» происходит от лат. parrum affinis - малоактивный.
Ученик: Кристаллический гипс обладает свойством анизотропии, поэтому парафин на пластинке гипса появился по различным направлениям неодинаково.
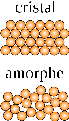
Учитель физики: Здесь проявляется различие между кристаллическими и аморфными телами. На экран выводятся определения: « Кристаллы – это твердые тела, атомы или молекулы которых занимают определенные, упорядоченные положения в пространстве» и « Аморфные тела – это твердые тела, в которых сохраняется только ближний порядок в расположении атомов».
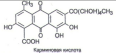
Учитель химии: Есть вещества, которые могут находиться как в кристаллическом состоянии, так и в аморфном, например, оксид кремния (IY): кремнезем, диоксид кремния в виде кварца, из которого состоит обычный песок, относится к кристаллическим веществам, а кремнезем в форме листочков, ленточек и волокон (силикагель) – аморфен. Сахарный песок (сахароза), например, C12H22O11 имеет кристаллическую структуру. Тот же сахарный песок после расплавления застывает в прозрачный стекловидный леденец, являющийся уже аморфным веществом. С течением времени леденец «засахаривается» - покрывается корочкой кристаллического сахара.
Учитель физики: Какое же из состояний твердого тела более устойчиво: кристаллическое или аморфное?
Ученик: Аморфное состояние для твердого тела не является устойчивым. Во многих случаях аморфное тело постепенно переходит в кристаллическое.
Учитель физики: Аморфные тела изотропны, при низких температурах они ведут себя подобно кристаллическим телам, а при высоких - подобны жидкостям. В настоящее время аморфные тела в виде различных пластмасс широко применяют в технике и быту. А сейчас посмотрите внимательно на набор веществ на ваших столах и разделите их на две группы: кристаллические и аморфные.
Учащиеся делят все выданные им вещества на две группы и дают мотивированные ответы, опираясь на знания, которые они получили в ходе урока.
Учитель физики: На ваших столах находится коллекция минералов. Твердые тела, однородные по химическому составу и обладающие одинаковыми физическими свойствами в различных своих частях, называются минералами. Предлагаю вам с помощью лупы познакомиться с основными особенностями строения твердых тел, и сделать вывод о свойствах кристаллических и аморфных тел. Рассмотрите в лупу изломы разных металлов и сплавов: чугуна, меди и т.п. Найдите в них грани мелких кристаллов, составляющих данный кусок металла.
Учитель физики демонстрирует кристаллы, увиденные учащимися в лупу, на экране с помощью документ – камеры и предлагает учащимся сделать вывод о том, по каким же признакам можно установить кристаллическую структуру твердого тела.
Ученик: Если образец со свежей поверхностью излома и крупнозернистой структурой рассмотреть через лупу, то можно сделать вывод о его кристаллическом строении по характерному для кристаллов признаку – наличию плоских поверхностей у кристаллических зерен. Поворачивая образец, можно наблюдать блеск таких граней.
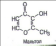
Учитель химии: Некоторые минералы состоят из атомов одного химического элемента (алмаз, золото, сера), но абсолютное большинство минералов – химические соединения нескольких элементов. Обратите внимание на вещество, которое называется плавиковым шпатом или флюоритом. Минерал этот имеет формулу CaF2 и шпатом его называют потому, что он относится к минералам, способным при ударе раскалываться в определенных направлениях. Плавиковым его называют от слова «плавить» за способность придавать легкоплавкость рудным смесям при выплавке металлов (для получения легкоплавких шлаков).
Учитель физики: Крупные прозрачные и бесцветные кристаллы флюорита (природные и искусственные) находят широкое применение в оптике. Эти кристаллы способны пропускать ультрафиолетовые и инфракрасные лучи лучше, чем стекло и вода.
Кристаллические тела делятся на монокристаллы и поликристаллы. Для монокристаллов характерна анизотропия. В зависимости от направления монокристаллы обладают разной упругостью и разными свойствами. Ярко выраженной анизотропией механических и тепловых свойств обладает асбест. В его монокристаллах имеется всего одно направление повышенной прочности. Поэтому асбест легко расчленяется на нити.
Учитель химии: Химическая формула асбеста CaO·3MgO·4SiO2. Благодаря своей огнестойкости, малой теплопроводности и волокнистой структуре, асбест является прекрасным теплоизоляционным материалом. Из асбестовых нитей изготавливают несгораемые веревочные пожарные лестницы, несгораемые ткани, из которых шьют спецодежду для работы в горячих цехах. 




Рис. 2. Применение асбеста.
Учитель физики: Поликристаллические тела состоят из кристаллитов. Они, как уже было сказано, обладают анизотропией. Свойства отдельных кристаллитов усредняются по всем направлениям и оказываются одинаковыми. Поэтому поликристаллические тела обычно изотропны. К числу поликристаллических тел относятся металлы и сплавы.
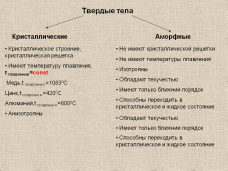
Схема 2. Сравнение строения и свойств кристаллических и аморфных тел.
Далее учащиеся рассказывают о монокристаллах, о способах их выращивания, показывают кристаллы поваренной соли медного купороса, железного купороса и алюмокалиевых квасцов, которые были выращены учениками под руководством учителей химии и физики. Свои комментарии учащиеся подкрепляют презентацией: на экран выводятся все этапы роста кристаллов, фотографии, видео, которые были сделаны самими учащимися вместе с учителями. Кроме того, учитель химии демонстрирует выращенные кристаллы хромата и дихромата калия, иодида свинца, красной и желтой кровяных солей, нитрата калия (эти кристаллы учителем выращивались без участия учащихся из-за токсичности вышеупомянутых солей). Также учителя демонстрируют выращенные ими кристаллы меди и рассказывают о том, как они эти кристаллы вырастили, подкрепляя свой рассказ фотографиями и видео, которые были сделаны при помощи учащихся.
Сообщения учащихся.
1 учащийся: Почему же у кристаллов такая правильная и красивая форма? Люди задавались этим вопросом с давних пор.
Кристаллы способны к «самоогранке» и постепенно восстанавливают свою природную самую устойчивую форму.
Рассказывают, что способность кристаллов сохранять правильную форму в любых ситуациях была обнаружена случайно. Французский ученый, аббат Рене Жюст Гаюи (1743-1826), однажды, будучи в гостях у своего знакомого, большого любителя камней и минералов, уронил на пол самый лучший кристалл из коллекции. Экспонат раскололся, но каждый из осколков повторял форму прежнего кристалла, только был поменьше. Наблюдательность аббата Гаюи помогла ему из обидного случаю сделать замечательный вывод. Если разбивать кристалл на все меньшие и меньшие части, можно постепенно дойти и до «элементарной» ячейки, состоящей из отдельных атомов или ионов вещества, и эта ячейка будут состоять из отдельных атомов или молекул…
На самом деле разбить кристалл «на атомы», конечно, обычными способами невозможно (разве что растворить его). Тем не менее, ученые установили, что кристаллическая решетка, как гигантский многоэтажный сборный дом, состоит из совершенно одинаковых «клеточек». А от того, каковы эти клеточки, в каком порядке и насколько прочно они скреплены друг с другом, зависит все многообразие кристаллических форм, существующих в природе.
Монокристаллы – одиночные кристаллы. (кварц, слюда…) Идеальная форма кристалла имеет вид многогранника. Такой кристалл ограничен плоскими гранями, прямыми ребрами и обладает симметрией. В кристаллах можно найти различные элементы симметрии, плоскость симметрии, ось симметрии, центр симметрии. На первый взгляд кажется, что число видов симметрии может быть бесконечно большим. В 1867г. русский инженер А.В.Гадолин впервые доказал, что кристаллы могут обладать лишь 32 видами симметрии. Убедимся в симметрии кристаллика снега-снежинки. Симметрия кристаллов и другие их свойства, о которых мы будем говорить далее, привели к важной догадке о закономерностях в расположении частиц, составляющих кристалл. Напоминаю, что частицы в кристалле располагаются так, что они образуют определенную правильную форму, решетку. Перед вами модель пространственной решетки поваренной соли. Понятие о пространственной решетке позволило объяснить свойства кристаллов. Рассмотрим их:
Для кристаллов характерна внешняя правильная геометрическая форма.
Постоянная температура плавления
Анизотропия – различие в физических свойствах от выбранного в кристалле направления. Но монокристаллы в природе встречаются редко. Такой кристалл можно вырастить в искусственных условиях.
Кристаллы действительно так хороши собой, что ими можно любоваться часами. А как разнообразны их формы! Вот кубик из прозрачной каменной соли, галита – природного хлорида натрия, а рядом – кристалл берилла, похожий на шестигранный карандаш, только большой, толщиной в руку.
Вот «карандашики» цвета морской волны – тоже бериллы, только они прозрачные и называются аквамаринами. Трехгранные призмы заманчивого дымчато-голубого цвета – природные топазы, а золотистые кубики – кристаллы пирита. Пластиночки прозрачной слюды – мусковита и остроконечные глыбы кварца, «каменные розы» из минерала гематита и сросшиеся «щетки» столбчатых аметистов... Да мало ли еще красот может быть в коллекции минералов!
Учителя обращают внимание учащихся на коллекцию минералов, находящуюся у них на рабочих столах.
2-й учащийся: Как вырастить крупные одиночные кристаллы ?
Как же удается природе вырастить такой каменный «сад»?
В недрах Земли находится расплавленная смесь множества химических веществ – магма. В некоторых местах – трещинах и изгибах земной коры – магма постепенно остывает, и начинается кристаллизация минералов, каждый из которых имеет определенный состав. Если образование кристаллов идет в тесноте, они мешают друг другу и в результате срастаются в бесформенные каменные глыбы, где различить отдельные минералы можно только под микроскопом. А если рост кристаллов идет в больших пустотах, в пещерах или трещинах, то получаются прекрасные правильные многогранники.
Чтобы из расплавленной магмы выросли кристаллы минералов, требуется очень много времени – сотни и тысячи лет. Гораздо быстрее растут кристаллы из растворов, например из соленой воды озер и морей. Когда стоит жаркое лето, вода испаряется, концентрация соли становится все выше. Наконец раствор становится насыщенным. Теперь стоит ему чуть чуть охладиться, как из него выпадут целые груды кристаллических солей. Именно так или почти так выглядит выделение поваренной соли из воды известнейших соляных озер России Эльтон и Баскунчак и глауберовой соли (мирабилита) из воды залива Кара-Богаз-Гол (в переводе с туркменского «Черная пасть») на Каспийском море. Озера и моря – настоящие природные лаборатории, где постоянно образуются новые порции кристаллических солей.
Если не дожидаться у моря погоды и смены времен года, можно за две три недели вырастить красивые кристаллы солей.
Для того, чтоб кристалл вырос крупным и геометрически ровным, т. е. имел природную форму, необходимо довольно много времени. Обычно кристалл вырастает на 0,1-0,8мм в сутки, что во многом зависит от соли. Т. е. за месяц - полтора можно вырастить довольно крупный кристалл. Кстати, термин «соль» происходит от латинского слова sal – соль. Одна из дорог, ведущих из Рима к местам соледобычи, так и называлась по-латыни via salaria (соляная дорога).
Выращивание крупного одиночного кристалла - очень длительный и сложный процесс, требующий терпения и осторожности. Для начала нам потребуется затравка - маленький кристаллик, который и будет центром кристаллизации. Обычно кристаллик, используемый как затравка, представляет собой уменьшенную копию выращиваемого кристалла.
Для того, чтобы получить затравку, мы использовал очень простой метод: приготовили максимально концентрированный раствор соли, перелили его в стакан с вертикальными стенками и накрыли листком бумаги. Через несколько дней на дне стакана появились первые кристаллики. Обычно они все имеют разную форму. Именно из них и отбираются те, которые имеют более правильную форму.
Раствор, в который мы погрузили затравку, приготовили заранее и оставили на пару дней для выпадения первых кристалликов (чтобы быть уверенным, что затравка не растворится). Раствор профильтровали от выпавших кристалликов, перелили в чистый стакан и погрузили туда затравку. Стакан накрыли бумагой и оставили на полке. Уже через неделю мы заметили, что наш кристалл заметно подрос. Чем дольше он оставался в растворе, тем крупнее он становился. Раствор со временем испаряется и если верхняя часть кристалла окажется на воздухе, то это может испортить весь кристалл. Для того, чтобы этого не произошло мы добавляли раствор по мере необходимости.
У нас возникла ещё одна проблема: в ходе роста основного кристалла на дне появлялись
и росли другие, случайно выпавшие кристаллы. Мы удаляли их раз в 1-2 недели (с помощью документ – камеры демонстрируются кристаллы, выращенные учащимися).
3-й учащийся: . Выращивание сростков кристаллов (друз).
Это - один из самых быстрых способов выращивания кристаллов. Если выращивание одиночных кристаллов занимает много времени и рассчитано на постепенный, правильный рост кристаллов, то выращивание друзы гораздо легче, потому что оно ориентируется на быстрое, хаотическое выпадение кристаллов.
Для начала мы приготовили перенасыщенный раствор соли в горячей воде. После охлаждения раствора в него внесли затравку - подвешенный на ниточке кристаллик. Уже через 5-10 часов можно увидеть большое количества кристалликов на нитке, на затравке, на дне стакана.
Раствор мы оставили в покое в течении 3-5 дней, затем вынули нитку с кристаллом, раствор нагрели, добавили воды и снова сделали максимально концентрированным. После охлаждения в него вновь внесли нитку с уже подросшим кристаллом и оставили на 3-5 дней.
Эту процедуру мы повторяли до тех пор, пока кристалл не достиг необходимого размера. Кстати, довольно неплохие результаты получаются, если смешать оба метода: сначала вырастить друзу, а потом погрузить её в раствор для медленной кристаллизации(с помощью документ – камеры демонстрируются кристаллы, выращенные учащимися).
4-й учащийся:
Какой же метод предпочесть? Конечно, если вы хотите использовать выращенный кристалл как предмет интерьера (т. е. для украшения комнаты), то лучше выращивать друзы. Но если вы выращиваете кристалл, и хотите чтобы он имел научную ценность, то лучше выращивайте его медленнее.
Выращивание кристаллов - процесс - занимательный, но требующий бережного и осторожного отношения к своей работе. Теоретически размер кристалла, который можно вырастить, например, в домашних условиях таким способом, неограничен. Известны случаи, когда энтузиасты получали кристаллы такой величины, что поднять их могли только с помощью товарищей. Но, к сожалению, есть некоторые особенности их хранения (конечно, каждая соль и вещество имеют свои особенности). Например, если кристаллик квасцов оставить открытым в сухом воздухе, он, постепенно теряя содержащуюся в нём воду, превратится в невзрачный серый порошок. Чтобы предохранить его от разрушения, можно покрыть бесцветным лаком. Медный купорос и поваренная соль - более стойки и вы смело можете с ними работать.
Этапы приготовления раствора соли и условия выращивания кристалла в домашних условиях указаны в интернете.
Далее учителя химии и физики показывают видео и фотографии, сделанные с помощью учащихся за несколько дней (недель) до интегрированного урока. На видео и фото демонстрируются следующие опыты (а также их результаты):
«Необыкновенный сад». Небольшое количество жидкого стекла (силикатный клей) разбавляют водой и выливают полученный раствор в чистый, прозрачный сосуд. «Питательная среда» готова. В сосуд бросают небольшие кусочки растворимых в воде солей металлов – меди, кальция, хрома, никеля, кобальта (нерастворимые соли и соли щелочных металлов для этой цели не подходят). Можно взять медный и железный купорос, железные квасцы, хлористый кальций. Сосуд закрывают, чтобы в него не попала пыль. Не пройдет и суток, как из кристалликов вырастут сказочные «растения», окрашенные в яркие цвета. Растворимые соли перейдут в силикаты, большая часть которых нерастворима.
«Ледяной узор» на стекле. Результат этого опыта можно показать через документ – камеру. В химическом стакане при нагревании готовят насыщенный раствор сульфата магния. Добавляют к горячему раствору несколько капель столярного клея (заранее приготовленного) и перемешивают стеклянной палочкой содержимое стакана. Полученный раствор наносят на стекло ровным слоем при помощи кисточки. Через некоторое время на стекле образуются кристаллы, образующие «ледяные узоры». Появление на стекле этих узоров объясняется выпадением кристаллов соли из пересыщенного раствора при понижении температуры.
Тот же опыт можно выполнить и таким образом. В конической колбочке готовят при нагревании насыщенный раствор сульфата магния. Затем его медленно охлаждают и прибавляют несколько капель столярного клея. На следующий день на дне колбочки появляются красивые (до 1 см в поперечнике) длиною до 10 см призмы сульфата магния. Необходимо поставить охлаждаться несколько колбочек, и наиболее удачно образовавшиеся кристаллы можно продемонстрировать. Клей повышает вязкость жидкости, что замедляет образование зародышей кристаллов.
Буквы из кристаллов. Изготавливают из проволоки каркасы, имеющие форму букв (или каких-либо других фигур). Аккуратно обматывают проволочные каркасы шерстяными нитями. В одной из металлических банок (на 1 – 2 л) готовят при нагревании и помешивании стеклянной палочкой насыщенный раствор алюмокалиевых квасцов (из расчета на 1 л воды берут 100 г соли). Добавляют в полученный раствор небольшое количество медного купороса так, чтобы жидкость приняла светло – голубую окраску. Фильтруют горячий раствор в другую банку. После этого в еще не остывший пересыщенный раствор опускают изготовленные ранее проволочные каркасы (на подвесках). Они не должны касаться дна и стенок банки, а также друг друга. Через сутки надо извлечь каркасы, поросшие кристалликами, из раствора и высушить их. Полученные буквы можно использовать при выпуске праздничной стенной газеты, при изготовлении плакатов и т.д. Их покрывают бесцветным лаком или клеем для склеивания пластмасс. Если использовать насыщенный раствор хромокалиевых квасцов, то кристаллы по цвету будут напоминать драгоценный камень – гранат.
Рост кристаллов сульфата натрия. Берут чистую колбу с перенасыщенным раствором сульфата натрия и опускают в нее кристалл этой соли величиной с горошину. В перенасыщенном растворе внесенный кристаллик становится центром, своего рода «запальной свечой» процесса кристаллизации, который быстро охватывает весь находящийся в колбе раствор. Образование друзы кристаллов идет при непосредственном участии воды. Состав кристаллов сульфата натрия характеризуется формулой Na2SO4·10H2O.
Если по окончании этого процесса перевернуть колбу, то окажется, что маленький кристаллик «выпил» всю жидкость и превратился в потный шар, который занял почти всю колбу.
Рост кристаллов уксуснокислого натрия. В пробирку насыпают 6 г уксуснокислого натрия CH3COONa, прибавляют 3 мл воды и нагревают до растворения соли. Затем пробирку закрывают ватой и ставят в стакан с холодной водой. Когда раствор охладиться, в пробирку бросают кристаллик уксуснокислого натрия, который становится центром кристаллизации. Кристаллы начинают расти и быстро заполняют всю пробирку. При этом выделяется тепло.
«Зимний пейзаж» в стакане. Приготавливают в стакане на 300 мл насыщенный раствор азотнокислого свинца Pb(NO3)2 и опускают в него кристалл хлорида аммония NH4Cl. Постепенно в стакане начинают расти кристаллы, напоминающие собой растения, покрытые инеем:
Pb(NO3)2 + 2NH4Cl=2NH4NO3+PbCl2
«Летний пейзаж» в стакане. В стакане на 300 мл приготавливают насыщенный раствор медного купороса CuSO4·5H2O. На дно стакана помещают вытертые, средней величины, кристаллы углекислого натрия Na2CO3. Через некоторое время можно заметить образование зеленых отростков, напоминающих водоросли. Т.к. рост кристаллов идет очень медленно, опыты №6 и №7 необходимо подготовить заранее и показать уже готовые образования в стакане.
«Золотой дождь» в воде. Получают осадок иодида свинца (II) PbI2 из раствора нитрата свинца (II) Pb(NO3)2 и раствора иодида калия KI. После отстаивания осадка сливают с него жидкость. В колбу наливают около 1 л горячей воды, подкисленной уксусной кислотой. В горячий раствор переносится часть осадка PbI2 и продолжают нагревание. Колбу с горячим раствором переносят на демонстрационный стол, освещают лампой на фоне черного экрана. Для быстрого охлаждения раствора колбу можно периодически погружать в кристаллизатор с холодной водой. По мере охлаждения в колбе появляются желтые кристаллы иодида свинца (II), которые при своем оседании отражают свет, образуя «золотой дождь».
Аналогичный опыт можно показать с насыщенными растворами нитрата калия (400 г соли на 500 мл воды), дихромата калия (150 г на 200 мл воды), борной кислотой, так как они легко растворяются в горячей воде и при охлаждении дают красивые кристаллические осадки.
5-й учащийся: КРИСТАЛЛЫ – ДЕНДРИТЫ.
В твёрдом состоянии большинство веществ имеет кристаллическое строение. В этом легко убедиться, расколов кусок вещества и рассмотрев полученный излом. Обычно на изломе (например, у сахара, серы, металлов) хорошо заметны расположенные под разными углами мелкие грани кристаллов, поблёскивающие вследствие различного отражения ими света.
При медленном испарении воды из раствора медного купороса или алюмокалиевых квасцов получаются красивые кристаллы в виде правильных многогранников различной формы.
Кристаллы могут расти не только из растворов или расплавов, но и из пара. Каждый может наблюдать этот процесс в морозную погоду, подышав на поверхность холодного стекла. Первые кристаллики льда на стекле — это всегда шестилучевые звёздочки или шестигранные стебельки, которые, разрастаясь и взаимодействуя друг с другом, образуют скелетные или ветвистые кристаллы, называемые дендритами.
Так что же такое кристаллы-дендриты?
Дендрит (греч.) — природное изображение на камне, похожее на деревце (толковый словарь Даля).
Дендрит [dendrite] — выросший из расплава кристаллит с древовидным строением. Дендритный рост кристаллов реализуется в большинстве случаев на литье слитков и опилок. Впервые дендритные кристаллы в стальных слитках были выявлены и подробно описаны в 1870-1880 гг. Д. К. Черновым.
Дендрит — это древовидные кристаллические образования, обнаруживаемые в монокристаллах и слитках металлов, полуметаллов,
Причина образования дендритов - очень быстрый рост в условиях переохлаждения, т. е. отрицательный температурный градиент перед фронтом кристаллизации.
6-й учащийся: К дендритам относятся и снежные кристаллы. Слово «кристалл» в переводе с греческого языка означает «лёд». Понятие «дендрит» впервые появилось для обозначения формы именно ледяного кристалла. Одной из первых работ по кристаллизации и симметрии был труд И.Кеплера «О шестиугольных снежинках», опубликованный в 1611г. Лёд изучали М.Фарадей, лорд Кельвин и многие другие выдающиеся естествоиспытатели.
Снежный кристалл – наименьшая структурная единица снежинки, например дендрит или пластинка. Снежинкой же может называться как отдельный кристалл, например, в форме звёздочки или пластинки, так и более крупное образование из нескольких кристаллов, например, пространственный дендрит. Жизнь снежинки начинается с того, что в облаке водяного пара при понижении температуры образуются кристаллические зародыши льда. Центром кристаллизации могут быть пылинки, любые твердые частицы или даже ионы. Температура и влажность вокруг зародыша одинаковы, поэтому на поверхности зародыша начинают расти одинаковые ледяные иголочки – боковые отростки, на них в свою очередь вырастают, как на дереве, боковые отростки – веточки. Подобные кристаллы и называют дендритами, т.е. похожими на дерево.
Учитель физики: Плавление и отвердевание.
Рассмотрим плавление и отвердевание кристаллических и аморфных тел. Смесь кристалл — расплав неоднородна: существует резкая разница между кристаллом и расплавом. Если кристаллы не слишком мелки, то всегда можно видеть, где образовался кристалл и где еще остался расплав. Это совсем не похоже на застывание аморфных тел. Когда застывает смола, то она густеет постепенно и одинаково во всех своих частях. Аморфное тело, застывая, остается однородным.
Важное различие между свойствами кристаллических и аморфных веществ относится к температуре застывания. Если вынести на мороз сосуд с водой и опустить в него термометр, то можно увидеть, что вода быстро остынет до 0°C. Затем начнется образование льда. Чтобы не дать образоваться корке изо льда, надо помешивать воду. Все время, пока образуется лед, температура смеси воды и льда будет держаться равной 0°C. Затем, когда вся вода замерзнет, получившийся лед начнет охлаждаться ниже нуля. Внеся этот сосуд обратно в теплую комнату, можно заметить, что температура льда повышается до 0°C, затем держится равной 0°C, пока весь лед не растает, и только после этого температура воды в сосуде поднимается выше этой температуры.
Подобные явления наблюдаются при затвердевании и плавлении всех чистых кристаллических веществ. Если, например, наблюдать, как меняется с течением времени t температура расплавленного нафталина, и построить график, показывающий эту зависимость, то получим линию с горизонтальной частью (рис 3). Эта горизонтальная часть соответствует смеси кристаллов нафталина и расплава. При затвердевании же некристаллических тел, например смолы, температура понижается непрерывно, нигде не задерживаясь. Отсюда можно вывести заключение, что при затвердевании аморфных веществ не происходит перехода вещества в новое состояние. Затвердевание смолы или стекла — только постепенное загустевание их. Стекло можно рассматривать как очень густую жидкость.
Итак, кристаллические вещества имеют определенные температуры плавления и отвердевания (точки плавления). Аморфные тела размягчаются при повышении температуры постепенно.
7 учащийся: В 1951 г. Международная комиссия по снегу и льду приняла довольно простую и получившую широкое распространение классификацию твёрдых осадков. Согласно этой системе существуют семь основных видов кристаллов: пластинки, звёздчатые кристаллы, столбцы (или колонны), иглы, пространственные дендриты, столбцы с наконечниками и неправильной формы. Более подробная классификация осадков была предложена японским физиком Укичиро - Накая: он выделял 41 вид снежных осадков. Предложенная им система была ещё более детализирована и расширена до 80 отдельных морфологических форм метеорологами С. Магоно и К. Б. Ли в 1966 г. Звёздчатые дендриты имеют шесть симметричных основных веток и множество расположенных в произвольном порядке ответвлений. Обычно такие кристаллы достигают 5 мм и более в диаметре, но, как правило, они бывают плоские и тонкие — всего 0,1 мм.
Демонстрационный опыт №2 (его показывают учителя химии и физики с помощью фотографий и видео, проецируемых на экран). Сам опыт демонстрирует учащийся (видео снимается за месяц до интегрированного урока).
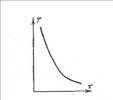
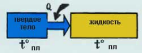

Рис.3.График температуры застывающего нафталина.
Получение дендритных кристаллов меди.
Насыпают медный купорос в чистый стакан очень тонким слоем, чтобы он покрыл дно, утрамбовывают его. Сверху насыпают хлорид натрия - в 3-5 раз больше. Поверх слоев укладывают круг из фильтровальной бумаги так, чтобы он вплотную прилегал к стенкам стакана. На фильтр помещают железные предметы. Удерживая фильтр стеклянной палочкой, наливают медленно и тоненькой струйкой концентрированный раствор хлорида натрия так, чтобы он не перевернул фильтр и не перемешал слои. Закрывают стакан фильтровальной бумагой и оставляют стоять при комнатной температуре.
Практически сразу слои солей окрасятся в зелёный цвет, что связано с образованием в слоях хлорида меди(II) СuС12. Затем начнут образовываться в слое хлорида натрия розовые нити-дендриты меди, которые иногда приобретают удивительный вид папоротниковых и еловых веточек.
Когда понадобится вынуть кристаллы, то:
сначала удаляют магнитом оставшееся железо;
аккуратно сливают раствор;
переносят пинцетом и пластмассовой ложкой слой хлорида натрия и кристаллы меди в заранее приготовленный чистый стакан.
Затем несколько раз заливают
кристаллы тёплой водой, чтобы растворить хлорид натрия. Когда соли не останется, а промывочный раствор будет прозрачен, кристаллы промывают 30%-ным раствором серной кислоты. Хранят кристаллы в таком же растворе серной кислоты в стеклянной банке с притёртой пробкой, с очень малым содержанием воздуха. На воздухе кристаллы неустойчивы, теряют яркий розовый блеск и разрушаются.
| Таблица 1. Возможные химические реакции при выращивании кристаллов меди в системе CuSO4∙5H2O/NaCl/Fe | |||
| № | Молекулярная химическая реакция | Тип реакции | Наблюдаемые изменения |
| 1 | 2CuSO4 + 2H2O ⇄(CuOH)2SO4↓+ H2SO4 | реакция обмена (гидролиз) |
|
| 2 | CuSO4 + 2NaCl ⇄ Na2SO4 + CuCl2 | реакция обмена | позеленение слоёв солей |
| 3 | CuCl2 + H2O ⇄ Cu(OH)Cl↓ + HCl | реакция обмена (гидролиз) |
|
| 4 | CuCl2 + Fe = FeCl2 + Cu↓ | реакция замещения | рост кристаллов меди |
| 5 | 4Fe + 2O2 + 6H2O = 4Fe(OH)3 | реакция соединения | ржавление железа |
| 6 | FeCl2 + H2O ⇄Fe(OH)Cl↓ + HCl | реакция обмена (гидролиз) |
|
| 7 | 4Fe(OH)Cl + 2H2O+ O2 = 4Fe(OH)2Cl↓ | реакция соединения | бурение раствора |
| 8 | Fe + H2SO4 = FeSO4 + H2↑ | реакция замещения | выделение пузырьков газа |
| 9 | Fe + 2HCl = FeCl2 + H2↑ | реакция замещения | выделение пузырьков газа |
| 10 | Cu + CuCl2 = Cu2Cl2↓ | реакция соединения |
|
| 11 | 2FeSO4 + 2H2O ⇄(FeOH)2SO4↓+ H2SO4 | реакция обмена (гидролиз) |
|
| 12 | 4FeSO4 + 2H2SO4 + O2 = 2Fe2(SO4)3+ 2H2O |
| бурение раствора |
| 13 | Fe2(SO4)3 + 2H2O ⇄2Fe(OH)SO4↓+ H2SO4 | реакция обмена (гидролиз) |
|
| 14 | 4FeCl2 + 4HCl + O2 = 4FeCl3 + 2H2O |
| бурение раствора |
Демонстрационный опыт №3 (этот опыт могут проделать и учащиеся на своих рабочих столах)
Получение дендритных кристаллов хлорида аммония
Если приготовить раствор хлорида аммония NH4Сl небольшой концентрации (40-50%-ный) и кистью нанести его на чистую стеклянную пластину, то при высыхании получится «морозный узор». Такие узоры могут образовать и другие вещества, если использовать их разбавленные растворы.
8 учащийся: Весь дендрит со всеми своими ветвями представляет собой монокристалл. Кристаллы-дендриты ещё недостаточно изучены, хотя имеют большое значение. В металлургии дендриты встречаются как трёхмерные или объёмные дефекты - макродефекты, которые представляют собой изолированные в кристалле участки. В медицине форма дендритов некоторых кристаллов используется для диагностических целей. И наконец, мы не можем себе представить жизнь без этих тихо падающих с неба или скрипящих под ногами, рисующих непостижимые узоры на стеклах или заваливающих пути-дороги снежинок – звездчатых и пространственных дендритов.
Учитель физики: А сейчас давайте познакомимся с поликристаллами.
9 учащийся: Поликристаллы - это твёрдые тела, состоящие из большого числа кристаллов, беспорядочно ориентированных друг относительно друга (сталь, чугун)
Поликристаллы тоже имеют правильную форму и ровные грани, температура плавления у них имеет постоянное значение для каждого вещества. Но в отличии от монокристаллов, поликристаллы изотропны, т.е. физические свойства одинаковые по всем направлениям. Это объясняется тем, что кристаллы внутри располагаются беспорядочно, и каждый в отдельности обладает анизотропией, а в целом кристалл изотропен.
Учитель химии: На ваших столах находятся полиэтилен и каучук, а также жевательная резинка. Основа жевательной резинки, которую мы относим к аморфным телам, - полимерные вещества – каучуки. Современные жевательные резинки представляют собой совокупность многих веществ. Это каучуки и разнообразные пищевые добавки, которые представлены в таблице.
Таблица 2. Некоторые пищевые добавки, которые могут входить в состав жевательных резинок.
| Маркировка | Пищевая добавка | Назначение добавки |
| E 100i |
| Желто-оранжевый краситель |
| Е 120 |
| Красный краситель |
| Е 132 |
| Синий краситель |
| Е 171 |
| Белый краситель |
| Е 296 |
| Регулятор кислотности |
| Е 320 |
| Антиоксидант |
| Е 321 |
| Антиоксидант |
| Е 322 |
| Эмульгаторы |
| Е 330 |
| Регулятор кислотности, антиоксидант |
| Е 414 | Гуммиарабик | Загуститель |
| Е 420 |
| Подсластитель, эмульгатор, увлажнитель |
| Е 421 |
| Подсластитель, эмульгатор |
| Е 422 |
| Стабилизатор |
| Е 500ii |
| Регулятор кислотности |
| Е 636 |
| Усилитель вкуса и аромата |
| Е 903 | Воск карнаубский | Глазурующий агент |
| Е 927b |
| Регулятор кислотности |
| Е 950 |
| Подсластитель |
| Е 951 |
| Подсластитель |
| Е 967 |
| Подсластитель |
Демонстрационный опыт №3: Для опыта учитель химии за 30-60 мин. до начала урока проводит необходимую подготовку для демонстрации свойств резиновой основы жвачки.
Учитель разделяет жевательную резинку, оставшуюся после жевания на 4 части и помещает каждую часть в отдельную пробирку. Приливает в пробирки соответственно 96%-ный этиловый спирт, концентрированные серную, азотную и соляную кислоты так, чтобы кусочек жвачки был полностью покрыт. Оставляет пробирки на 30-60 мин. Учащиеся делают вывод о сравнительной устойчивости полимера в различных средах, учитывая, что бутадиеновый и изопреновый каучуки отличаются плохой устойчивостью к алифатическим растворителям. Они также нестойки к действию концентрированных кислот.
Далее учитель химии показывает опыт, демонстрирующий деполимеризацию полиэтилена. Опыт занимает некоторое время, во время которого 3 ученика делают сообщения об аморфном и кристаллическом строении полимеров.
1 учащийся: Полимеры могут иметь аморфное (от греч. amorphe — бесформенный) или кристаллическое строение. Аморфное строение имеют полимеры, макромолекулы которых расположены неупорядоченно, хаотично. Аморфные полимеры — мягкие, эластичные материалы. Кристаллическое строение имеют полимеры только стереорегулярной структуры. Их макромолекулы более склонны к плотной упаковке и максимальному сближению друг с другом. Эти полимеры способны кристаллизоваться. Таким образом, стереорегулярность полимера определяет его физические и другие свойства. Например, стереорегулярный полипропилен обладает прочными механическими свойствами и высокой теплостойкостью. В то же время полипропилен с неупорядоченным строением представляет собой мягкий материал, напоминающий каучук.
2 учащийся: Однако в отличие от обычных кристаллических твердых тел кристаллические полимеры состоят не из одних кристаллов. Да и понятие «кристалл» для полимера отличается от обычного, к которому мы привыкли при изучении неорганических веществ. Кристаллические полимеры содержат области (зоны), в которых отдельные участки макромолекул имеют плотную упаковку, напоминающую подобие пластин ромбовидной формы. Такие кристаллические участки часто называют кристаллитами. Эти участки соседствуют с основной аморфной массой полимера, в которой полимерные цепи ориентированы относительно друг друга без определенного порядка. Таким образом, аморфная и кристаллическая части полимера состоят из одинаковых макромолекул, но в аморфной части они расположены беспорядочно, а в кристаллической — плотно упакованы.
3 учащийся: Физические свойства полимеров.
Для высокомолекулярных соединений, в отличие от низкомолекулярных, известны только два агрегатных состояния – твердое и жидкое.
Если все кристаллические низкомолекулярные вещества имеют строго определенную температуру плавления, то кристаллические полимеры переходят из твердого состояния в жидкое в некотором интервале температур.
Посмотрим, как ведет себя при нагревании полиэтилен, кристалличность которого довольно высока, от 50 до 90°C. Вначале полимер размягчается, а потом медленно переходит в жидкообразное (вязкотекучее) состояние. Точку плавления зафиксировать не удается – можно лишь установить интервал температур перехода из твердого состояния в жидкое. Этот интервал довольно широк – около 150°C.
Полиэтилен [—СН2— СН2–]n получают полимеризацией этилена:
n СН2= СН2→[— СН2— СН2—]n
Рис.4. Реакция получения полиэтилена.
Изделия из полиэтилена низкого давления лучше .эксплуатировать при температуре не выше 100°С, а из полиэтилена высокого давления — не выше 60 °С. Полиэтилен — нетоксичный материал, поэтому из него делают водопроводные трубы и изделия домашнего обихода (бутылки, фляги, стаканы, пробки и т. д.). Высокие диэлектрические показатели полиэтилена позволяют использовать его в качестве электроизоляционного материала в электропромышленности и радиотехнике (для изоляции высокочастотных кабелей в радиолокационных, радиотехнических, телевизионных и телемеханических устройствах). Из полиэтилена изготавливают емкости для хранения и перевозки химических веществ, трубы различного диаметра для перекачки агрессивных жидкостей, кроме азотной кислоты. На основе полиэтилена получают пенопласты, сочетающие необычайную легкость с другими уникальными свойствами, особенно электроизоляционными. Полиэтилен используют также для изготовления наполненных (композиционных, или армированных) материалов, которые могут содержать свыше 20% наполнителя (мела, талька, каолина и др.) по объему. Такие материалы используют в производстве труб, в строительстве, в автомобильной промышленности. Полиэтилен широко применяют в производстве строительных материалов и в медицине.
Демонстрационный опыт №4: Деполимеризация полиэтилена с получением непредельного мономера - этилена.
Известно, что при нагревании в пробирке полиэтилен плавится, кипит, а в его парах присутствуют в основном молекулы полимера (частичный крекинг идет за счет стеклянных стенок пробирки, выполняющей каталитическую роль, но этого явно недостаточно, чтобы наглядно показать процесс деполимеризации).
Для осуществления процесса разложения полиэтилена необходимо использовать катализатор, который разрывал бы углерод-углеродные связи. К таковым относятся оксид хрома(III) и оксид алюминия. Наилучший катализатор — оксид хрома(III) Сг203, который получают разложением дихромата аммония непосредственно перед опытом (всем известный опыт «Вулкан»). На дно пробирки помещают кусочки полиэтилена (лучше с низкой степенью полимеризации).
Закрепляют пробирку в лапке штатива почти горизонтально, с легким наклоном дна вниз, чтобы расплавленный полиэтилен не вылился. Вносят шпателем в пробирку свежеприготовленный оксид хрома(III), который располагают на дне и в середине пробирки. В средней части пробирки катализатор должен лежать рыхло (для улучшения проходимости газа). Закрывают пробирку пробкой с газоотводной трубкой, направленной вверх. Сначала нагревают центральную часть пробирки (катализатор должен нагреться до температуры 500 °С), а затем полиэтилен до закипания.
Пары полиэтилена, проходя над нагретым катализатором, разлагаются. Выходящий из газоотводной трубки газ представляет собой смесь непредельных соединений, основу которой составляет этилен.
При поджигании газ горит светящимся, слегка коптящим пламенем (рис.5).
Затем необходимо потушить пламя, перевернуть газоотводную трубку вниз и поочередно опускать ее в пробирки с растворами перманганата калия и бромной воды (рис.6). В обоих случаях наблюдают обесцвечивание растворов.
Этот опыт очень важен, так как имеет экологическое значение. Ведь до сих пор не решена проблема утилизации и переработки полимерных отходов, которые загрязняют окружающую среду, так как их не разрушают никакие микроорганизмы. Полиэтилен — один из таких полимеров.
Учитель физики: Нельзя окружающий мир разложить по полочкам, но наличие знаний об устройстве окружающих нас тел жизненно необходимо. Человечество нуждается в веществах с самыми разными свойствами – прозрачных и непрозрачных, жестких и эластичных, тугоплавких, сверхпроводящих и многих других. Для создания нового необходимо изучить особенности имеющегося материала (вещества). Но только пытливость и активный поиск движет науку вперед.
Учитель химии: Физика и химия – одни из стремительно развивающихся областей знан ия, результаты ускоренного развития в макро- и микромасштабах проявляются в повседневной жизни. В связи с этим особую значимость приобрели исследования в области создания жидких кристаллов.
Учитель физики: Название «жидкие кристаллы» сродни выражениям «холодное пламя», «горячий снег». Нет ли здесь ошибки или преувеличения? Кристаллы ведь всегда твердые, а жидкости — текучие... Однако среди сюрпризов природы ученые разглядели именно жидкие кристаллы.
Жидкокристаллическая форма вещества увлекла химиков и физиков, прошла свой путь и развитие от экзотического научного факта до разностороннего применения в химии, физике, биологии, медицине и технике. Обо всем этом расскажут вам, ребята, ваши одноклассники.
Жидкие кристаллы: и экзотика в науке, и веление времени.
1 учащийся: История исследования жидких кристаллов.
В 1888 году австрийский ученый Фридрих Рейнитцер, исследуя с помощью поляризационного микроскопа сложный эфир холестерина и бензойной кислоты – холестерилбензоат – обнаружил, что данное соединение плавится странным образом. При 145,5°C оно переходит в мутный жидкий расплав, а затем при 178,5°C становится прозрачным. В промежутке между этими температурами оно изменяло цвет, обладало двойным лучепреломлением и вращало плоскость поляризации света.
В 1888 году к изучению этого вещества приступил немецкий физик Отто Леман. Он пришел к выводу, что в промежутке между твердым и жидким состоянием холестерилбензоат обладает совокупностью свойств, которая невозможна для вещества ни в твердом, ни в жидком состоянии. Действительно, мутный расплав текуч, как жидкости, и одновременно анизонтропен (когда целый набор свойств зависит от направления измерения), как кристаллы. Другими словами, в интервале температур 145,5 до 178,5°C холестерилбензоат существует в новом, неизвестном ранее, агрегатном состоянии, которое Леман назвал жидкокристаллическим (ЖК). Получило распространение и другое название для такого состояния, предложенное французским физиком Жоржем Фриделем – мезоморфное (от греч. мезос - промежуточный), т.е. промежуточное между анизонтропным (твердым) и изотропным (жидким) состояниями. Соответственно вещества, обладающие таким агрегатным состоянием, назвали жидкими кристаллами, или мезогенами.
2 учащийся: Вещество существует в конденсированном (жидком, твердом) состоянии до тех пор, пока энергия, удерживающая частицы вещества друг около друга, не превышает их кинетическую энергию.
Вещества с молекулярной кристаллической решеткой (в том числе и жидкокристаллические) удерживаются от перехода из твердого состояния в жидкое межмолекулярными силами (силы Ван-дер-Ваальса) примерно в 100 раз меньшими, чем короткодействующая химическая связь. Молекулы такой силы, удерживающие рядом в кристаллической решетке, будут также анизотропны. При нагревании кристаллов такого вещества колебательная энергия молекул сначала должна достигнуть величины, достаточной для разрыва только наиболее слабых сил, удерживающих молекулы в узлах кристаллической решетки. После этого вещество начинает течь, как вязкая жидкость, однако в нем сохраняется определенный порядок, например, во взаимной ориентации молекул. При этом вещество приобретает свойства жидкости лишь частично, поскольку в нем сохраняются некоторые свойства кристалла. Дальнейшее нагревание приводит к полной потере упорядоченности вещества, и оно плавится окончательно, становясь обычной жидкостью.
Известно, что вещества в жидкокристаллическом агрегатном состоянии построены из молекул, в «конструкции» которых имеются характерные особенности, а именно: они анизометричны — сильно вытянуты или дискообразны. Большинство известных дискообразных ЖК-веществ — гексазамещенные призводные бензола. Самым древним дискотиком можно считать графит — всем известное простое вещество.
3учащийся: Термотропные (способные сами находиться в ЖК-состоянии) ЖК-вещества по структуре образуемой ими мезофазы разделяют на нематические (НЖК). смектические (СЖК), холестерические (ХЖК).
Холестерическая ЖК-фаза образуется производными холестерина (холестерин – наиболее известный из стероидов). Молекулы подобных веществ ориентируются так же, как и в НЖК-фазе, но в каждом слое молекулы повернуты на определенный угол.
Молекула представляет собой жесткий остов с гибким «хвостом». Эти «хвосты» и вызывают поворот одного слоя относительно другого. Слабый поворот слоев приводит к окраске таких жидких кристаллов. Изменение температуры и давления также меняет порядок и, следовательно, окраску жидких кристаллов, поэтому их используют как монитор изменения температуры. Например, они обнаруживают тепловые пятна в микроэлектронных цепях, которые сигнализируют об изъянах в них.
Жидкокристаллическая термография используется в технике для визуализации ИК-, СВЧ-излучений, в качестве неразрушающих методов контроля в микроэлектронике, в медицине для диагностики ряда сосудистых и острых воспалительных заболеваний.
Особое место среди жидкокристаллических веществ занимают полимеры. На основе полимеров можно получать жидкокристаллические стекла, пленки, волокна и покрытия с заданными свойствами.
4 учащийся: Использование жидких кристаллов.
Практическое применение жидких кристаллов в оптоэлектронике стало возможным только в конце 1960-х — начале 1970-х гг. К этому времени химики уже синтезировали сотни ЖК-веществ, среди которых в конце концов нашлись вещества с температурами плавления около 20 °С. Из этих веществ были приготовлены низкоплавкие смеси, имевшие достаточно высокие температуры просветления.
Широкое применение жидкокристаллических материалов предъявляет и множество технических требований к ним. Налагаются жесткие ограничения на значения коэффициентов вязкости и упругости (от которых зависит время срабатывания устройств), на диэлектрические и оптические свойства (применимость в различных электрооптических эффектах). Однако самое важное и трудновыполнимое требование — наличие у ЖК-материалов определенного типа мезофазы в рабочем диапазоне температур от -40 до +100 °С.
Ни одно из более чем 40 тысяч известных индивидуальных веществ не может полностью соответствовать всему набору необходимых свойств, приходится составлять многокомпонентные смеси из 4 — 10 ЖК- веществ с добавками немезогенных компонентов — веществ, используемых для понижения вязкости, антиоксидантов (соединений, препятствующих окислению ЖК- материалов кислородом воздуха), дихроичных красителей и др.
Основная область применения жидких кристаллов — отображение и преобразование информации, передаваемой от часов, микрокалькулятора, ЭВМ и даже телевизора.
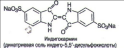
ЖК широко используют как сенсоры давления и температуры, в дисплеях электронных приборов, таких, как цифровые часы, калькуляторы, компьютеры.
Для психологической разгрузки учащихся, а также с целью оживить урок, учителя предлагают учащимся отгадать вещество, находящееся в черном ящике.
Учитель физики: Это вещество не имеет определенной температуры плавления. Если его держать в руках, оно сначала размягчается, затем становится жидким. Вещество имеет сладкий вкус, коричневый цвет.
Она растает на руках.
И след оставит на губах.
И сладкий вкус её загадка
Зовут её все... (шоколадка)
Учитель химии: Шоколад – одно из самых распространенных кондитерских изделий. Он содержит жиры, белки, углеводы, дубильные вещества, алкалоиды кофеин и теобромин. Готовят его на основе какао-продуктов.
Учитель физики: Шоколад чувствителен к колебаниям температуры, поэтому рекомендуется хранить его при температуре около 180С. При нагревании происходит жировое поседение шоколада: он покрывается серым налетом. Это содержащиеся в шоколаде жиры проступают на его поверхности. При температуре ниже 180С происходит сахарное поседение шоколада, вызванное конденсацией паров воды и частичным растворением сахарозы, содержащейся в шоколаде. После испарения влаги кристаллики сахарозы образуют белый налет на поверхности шоколада.
Демонстрационный опыт № 5 (для него шоколадные кубики готовит учитель физики, а химическую реакцию показывает учитель химии)
Моделирование сахарного поседения шоколада.
Опрыскивают несколько кубиков шоколада водой, заворачивают в фольгу и помещают на 1-2 недели в холодильник (не в морозильное отделение). В результате на поверхности шоколада появится налет. Это выступили кристаллики сахарозы. Смывают налет 3-5 мл дистиллированной воды, добавляют к смыву 1 мл раствора щелочи и 1-2 капли раствора сульфата меди (II) CuSO4. Появляется характерное ярко-синее окрашивание. Такую реакцию дает сахароза, представляющая собой многоатомный спирт.
В конце двух уроков учителя предлагают учащимся посмотреть на перечень вопросов, предложенных им в начале первого урока и найти вопросы, на которые в ходе двух уроков ученики ответа не получили. Учителя, если позволит время, разбирают эти вопросы с учащимися. В том случае, если время на это не остается, учащимся предлагается ответить на эти вопросы самостоятельно. Данные ответы обсуждаются на последующих уроках физики и химии. Кроме того, учащимся предлагается домашнее задание: составить таблицу «Свойства твердых тел», руководствуясь изречением Козьмы Пруткова «Отыщи всему начало, и ты многое поймешь».
| Кристаллические тела | Аморфные тела | ||
| Монокристалл | Поликристалл | | |
Всем учащимся, активно принимавшим участие в уроке, выставляются оценки.
Рефлексия:
• Как настроение? Немного устали?
• Что было интересного?
• Что произвело большее впечатление?
. Как вы думаете, почему поэт Осип Мандельштам написал: «Поэзия, завидуй кристаллографии, кусай ногти в гневе и бессилии!»? На экране повторно появляется определение понятию «кристаллография» (учащиеся видели его во время презентации).
Кристаллография – наука о кристаллах, их структуре, возникновении и свойствах. Она тесно связана с минералогией, физикой твердых тел и химией. Исторически кристаллография возникла в рамках минералогии, как наука, описывающая идеальные кристаллы.
Демонстрируется слайд «Удивительный мир кристаллов». Далее приводится приложение к уроку.
Приложение.
. Как вы думаете, почему поэт Осип Мандельштам написал: «Поэзия, завидуй кристаллографии, кусай ногти в гневе и бессилии!»?
Кристаллография – наука о кристаллах, их структуре, возникновении и свойствах. Она тесно связана с минералогией, физикой твердых тел и химией. Исторически кристаллография возникла в рамках минералогии, как наука, описывающая идеальные кристаллы.





Домашнее задание: составить таблицу «Свойства твердых тел», руководствуясь изречением Козьмы Пруткова «Отыщи всему начало, и ты многое поймешь».
| Кристаллические тела | Аморфные тела | |
| Монокристалл | Поликристалл | |
Инструктивная карточка №1 для учащихся.


 Какой вид химической связи и тип кристаллической решетки характерны для вещества твердого, летучего, легкоплавкого? Приведите пример такого вещества.
Какой вид химической связи и тип кристаллической решетки характерны для вещества твердого, летучего, легкоплавкого? Приведите пример такого вещества.
Какой вид химической связи и тип кристаллической решетки характерны для вещества с повышенной твердостью, имеющего высокую температуру плавления, нерастворимого в жидкостях, прочного.
К акой вид химической связи и тип кристаллической решетки характерны для вещества твердого, тугоплавкого, растворимого в воде? Приведите пример такого вещества.
Какой вид химической связи и тип кристаллической решетки характерны для вещества твердого, пластичного, имеющего металлический блеск, высокую электро- и теплопроводность, ковкость? Приведите пример такого вещества. 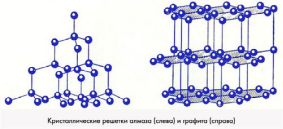
Инструктивная карточка №2 для учащихся.

Инструктивная карточка №3 для учащихся.



Инструктивная карточка №4 для учащихся.
17
Похожие файлы
object(ArrayObject)#853 (1) {
["storage":"ArrayObject":private] => array(6) {
["title"] => string(90) "Конспект урока "Кристаллические и аморфные тела" "
["seo_title"] => string(52) "konspiekt-uroka-kristallichieskiie-i-amorfnyie-tiela"
["file_id"] => string(6) "137140"
["category_seo"] => string(6) "fizika"
["subcategory_seo"] => string(5) "uroki"
["date"] => string(10) "1417275114"
}
}
object(ArrayObject)#875 (1) {
["storage":"ArrayObject":private] => array(6) {
["title"] => string(128) "конспект урока по физике в 10 классе "Кристаллические и аморфные тела" "
["seo_title"] => string(76) "konspiekt-uroka-po-fizikie-v-10-klassie-kristallichieskiie-i-amorfnyie-tiela"
["file_id"] => string(6) "228044"
["category_seo"] => string(6) "fizika"
["subcategory_seo"] => string(5) "uroki"
["date"] => string(10) "1441050205"
}
}
object(ArrayObject)#853 (1) {
["storage":"ArrayObject":private] => array(6) {
["title"] => string(117) "урок физики в 10 классе на тему "Аморфные и кристаллические тела" "
["seo_title"] => string(70) "urok-fiziki-v-10-klassie-na-tiemu-amorfnyie-i-kristallichieskiie-tiela"
["file_id"] => string(6) "219388"
["category_seo"] => string(6) "fizika"
["subcategory_seo"] => string(5) "uroki"
["date"] => string(10) "1434132668"
}
}
Подтверждение авторства
Пожалуйста, введите ваш Email.
Если вы хотите увидеть все свои работы, то вам необходимо войти или зарегистрироваться
Полезное для учителя
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт