Урок №40.
Водород - химический элемент и простое вещество. Изотопы водорода. Получение водорода.
Цель:Сформировать знания о водороде как химическом элементе и простом веществе, распространенности водорода в космосе и на Земле. Изучить способы получения и сбора кислорода, технику безопасности при работе с водородом.
I. Организационный момент. Создание коллаборативной среды. (Упражнение «Покажи». Необходимо изобразить, используя всех участников команды: оркестр, электричку, сороконожку, зоопарк, телевизор, телефон, болельщиков, команда которых проигрывает, зрителей, смотрящих крутой боевик, людей в очереди за колбасой, пациентов из палаты перед операцией, крутых зайцев, диких поросят, одиноких волков, сумасшедших куриц, Пизанскую башню, Китайскую стену, Кремль, мост над Темзой, букву «А», «К», «Ш», «Р», «Ю», картину «Медведи в сосновом бору», «Бурлаки на Волге», «Иван Грозный убивает своего сына» и т.п. ) (3 мин. + 5 мин. с.р.)
II. Разделение на группы по списку в журнале. ( первые 4 человека 1 группа, следующая четверка группа 2 и т.д.) (2 мин.)
III. Формулирование темы урока. (2 мин.)
Учитель: Название этого элемента переводится с латыни как «рождающий воду», русское название является точным переводом латинского названия. Атомы этого элемента образуют простое вещество, которое является одним из самых легких газов. О каком элементе и простом веществе идет речь? Запишем тему урока: Водород - химический элемент и простое вещество. Изотопы водорода. Получение водорода.
IV. Целеполагание. (2 мин)
Учитель: Что мы должны обязательно изучить на уроке химии, который называется «Водород - химический элемент и простое вещество. Изотопы водорода. Получение водорода»?
V. Работа в группах с материалом информационного листа (ИЛ), учебника, листом ориентирующих вопросов (ЛОВ).
1).Заполните таблицу «Верные и неверные утверждения» до и после изучения материала информационного листа (ИЛ), учебника (параграф 30).
| Утверждения | До чтения (слушания) | После изучения материала |
| 1.Знак химического элемента водород - Н. 2.Аr(Н) =2. 3.Номер периода, в котором находится водород II. 4.Номер группы в которой находится водород I. 5.Заряд ядра в атоме водорода +2. 6.Число протонов в атоме водорода 1. 7.Количество энергетических уровней в атоме водорода 1. 8. Формула простого вещества образующегося из атомов водорода Н2. 9.Простое вещество водород- это газ без цвета и запаха. 10.Газ водород тяжелее воздуха и хорошо растворяется в воде. 11. Водород самый распространенный элемент космоса. 12. Водород является главной составной частью звезд и Солнца. 13. Массовая доля водорода в земной коре 1% 14. В будущем водород может быть использован как топливо для автомобилей. |
|
|
2). Используя материал учебника (параграф 30), ИЛ, ЛОВ, наблюдение Дем.№4 (4.1) ( мультимедиа) «Получение водорода » заполните концептуальную таблицу по разделу «Получение водорода»
| Линии сравнения | Взаимодействие активных металлов с водой | Взаимодействие активных металлов с кислотами | Другие способы получения |
| 1.Уравнения реакций | 1) 2) | 1) 2) | 1) 2) |
| 2.Общий продукт для всех реакций |
|
|
|
| 3.Продукты реакции помимо водорода |
|
|
|
| 4.Лабораторный или промышленный |
|
|
|
| 5.Активность металлов вступающих в реакцию (с примерами металлов) |
|
|
|
| 6.Сумма всех коэффициентов в уравнении |
|
|
|
3). Используя материал учебника (параграф 30), ИЛ, ЛОВ ответьте на вопросы: почему водород можно собирать методом вытеснения воды, почему при сборе водорода пробирки следует держать вверх дном?
4.). Используя материал учебника ИЛ, ЛОВ, заполните концептуальную таблицу по разделу «Изотопы водорода»
| Линии сравнения | Протий | Дейтерий | Тритий |
| 1.Символ |
|
|
|
| 2.Аr |
|
|
|
| 3.Число протонов |
|
|
|
| 4.Число нейтронов |
|
|
|
| 5. Распространенность в природе |
|
|
|
Работают все члены группы, задают друг другу вопросы, ведется исследовательская беседа. Таблицы защищают всей группой. Какой ученик, по какому разделу будет вести защиту, определяет учитель. После защиты каждой группы участниками другой группы и учителем задаются вопросы. Защищаются все группы.
(25 минут: 15 мин. на заполнение таблиц, 10 мин. на защиту всех групп.)
VI. Самооценивание работы группы ( один ученик из группы). Формативное оценивание учителем (словесное). ( 3-5 минут)
VII. Суммативное оценивание. Выставление оценок наиболее активным, продуктивно работающим членам группы.
VIII. Рефлексия. ( при помощи смайликов) (2-3 мин.)
IΧ. Д.з. Самостоятельно составить в тетради краткий конспект по материалу параграфа 30, ИЛ выучить материал конспекта. Задание 9 стр. 79 письменно.
ИЛ (информационный лист)
В 1766 году известный английский ученый Генри Кавендиш получил “искусственный воздух” действием цинка, железа или олова на разведенную соляную или серную кислоту. Это было совершенно новое вещество, которое хорошо горело и получило название “горючего воздуха”. Но лишь в 1787 году Лавуазье доказал, что этот “воздух” входит в состав воды и дал ему название “ гидрогениум”, т. е. “рождающий воду”, “водород”. Водород – самый распространенный элемент в космосе. Главной составной частью Солнца и других звезд является водород. Водород преимущественно составляет межзвездное вещество. Водород входит в состав основного вещества Земли – воды. Если посмотреть на схему распространения химических элементов, то можно увидеть, что доля водорода в земной коре составляет около 1% ее массы. Множество органических веществ встречающихся на Земле, представляют собой соединения водорода с углеродом – нефть, природный газ метан СН4, углеводы, белки, жиры, нуклеиновые кислоты, витамины и другие органические вещества. В теле человека около 10% водорода. Вероятно, когда-то водород входил и в атмосферу Земли. Но из-за своей легкости он способен покидать атмосферу, поэтому доля водорода в воздухе ничтожно мала. Водород- химический элемент. Водород – элемент первого периода, первой группы главной подгруппы. Атомный номер водорода – 1,заряд ядра +1, химический знак – Н, относительная атомная масса (атомный вес) 1,008 (округленно 1). В ядре атома водорода один протон, масса которого равна 1 а. е. м. Почему же масса химического элемента водорода равна 1,008 а. е. м? Масса не равна единице, так как кроме обычного водорода, называемого протий, существуют изотопы водорода с большей массой: дейтерий и тритий. Cхема строения атома 1s1. Валентность водорода в соединениях равна единице. Водород – простое вещество. Молекула водорода Н2, молекулярная масса 2,016 (округленно 2 а.е.м). Молярная масса 2 г/моль. Водород – это газ без цвета и запаха. Водород легче воздуха, плохо растворим в воде. В будущем возможно использование водорода в качестве дешевого топлива для автомобилей. Получение водорода: в лаборатории : 1). Для получения водорода используют реакции веществ, относящиеся к классу кислот (например: HCl – соляная кислота или Н2SO4 – серная кислота) с активными металлами(магний, железо, цинк). Действие разбавленных кислот на металлы: Zn + 2HCl = ZnCl2 + H2↑ ; Н2SO4 + Мg = H2↑ + МgSO4; в ходе данных реакций образуется водород и вещества из класса солей: ZnCl2 ( хлорид цинка) и МgSO4(сульфат магния)
2).Взаимодествие самых активных металлов (Li, Nа, К, Са) с водой: 2Na + 2H2O =2NaOH + H2↑; Сa + 2H2O =Сa(OH)2 + H2↑; в ходе данных реакций образуется водород и вещества из класса оснований: NaOH(гидроксид натрия), Сa(OH)2(гидроксид кальция)
в промышленности: 1).Разложение воды при помощи постоянного электрического тока: 2H2O→ 2H2↑ + О2↑
2).Взаимодействие метана с водой при высокой температуре: CH4 + H2O = CO + 3H2
Существует два способа собирания водорода: 1).Собирание водорода методом вытеснения воды, 2).Собирание водорода методом вытеснения воздуха.
1. 2.
2. 
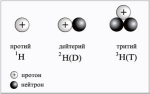
В обоих случаях пробирка перевернута вверх дном. ТБ: Полученный тем или иным способом водород может быть загрязнен воздухом, с которым может образовывать взрывчатую смесь (смесь водорода и кислорода в объемном отношении 2:1 называется, “гремучим газом”), это опасно! Наполняем пробирку водородом, используя один из методов собирания, и подносим ее открытым концом к пламени – если услышим хлопок со свистом, то водород загрязнен, если же хлопок глухой-то водород чистый. Изотопы водорода. Атом водорода – самый простой из всех атомов. Его ядро состоит из единственного протона. Этот (самый распространенный) изотоп водорода называют также протием, чтобы отличить от дейтерия – другого изотопа водорода, в ядре которого 1 протон и 1 нейтрон. Дейтерий находится в природе в очень небольшом количестве. Тем не менее, его научились выделять для нужд ядерной энергетики. Дейтерий – один из немногих изотопов в химии, имеющий свой собственный символ D. Наиболее известным химическим соединением, в которое входит дейтерий, является "тяжелая вода" D2O. В ядерных реакциях образуется еще один изотоп водорода – тритий, в ядре которого 1 протон и 2 нейтрона. Тритий (химический символ T) радиоактивен и в природе не встречается. 11Н — протий, 21H или 21D— дейтерий и 31H, 31T— тритий. Тритий - атомная масса 3, дейтерий - атомная масса 2, и протий атомная масса-1.
Д.з. Самостоятельно составить в тетради краткий конспект по материалу параграфа 30, ИЛ выучить материал конспекта. Задание 9 стр. 79 письменно.
ЛОВ (лист ориентирующих вопросов)
1).Заполните таблицу «Верные и неверные утверждения» до и после изучения материала информационного листа (ИЛ), учебника (параграф 30).
| Утверждения | До чтения (слушания) | После изучения материала |
| 1.Знак химического элемента водород - Н. 2.Аr(Н) =2. 3.Номер периода, в котором находится водород II. 4.Номер группы в которой находится водород I. 5.Заряд ядра в атоме водорода +2. 6.Число протонов в атоме водорода 1. 7.Количество энергетических уровней в атоме водорода 1. 8. Формула простого вещества образующегося из атомов водорода Н2. 9.Простое вещество водород- это газ без цвета и запаха. 10.Газ водород тяжелее воздуха и хорошо растворяется в воде. 11. Водород самый распространенный элемент космоса. 12. Водород является главной составной частью звезд и Солнца. 13. Массовая доля водорода в земной коре 1% 14. В будущем водород может быть использован как топливо для автомобилей. |
|
|
2). Используя материал учебника (параграф 30), ИЛ, ЛОВ, наблюдение Дем.№4 (4.1) ( мультимедиа) «Получение водорода » заполните концептуальную таблицу по разделу «Получение водорода»
| Линии сравнения | Взаимодействие активных металлов с водой | Взаимодействие активных металлов с кислотами | Другие способы получения |
| 1.Уравнения реакций | 1) 2) | 1) 2) | 1) 2) |
| 2.Общий продукт для всех реакций |
|
|
|
| 3.Продукты реакции помимо водорода |
|
|
|
| 4.Лабораторный или промышленный |
|
|
|
| 5.Активность металлов вступающих в реакцию (с примерами металлов) |
|
|
|
| 6.Сумма всех коэффициентов в уравнении |
|
|
|
3). Используя материал учебника (параграф 30), ИЛ, ЛОВ ответьте на вопросы: почему водород можно собирать методом вытеснения воды, почему при сборе водорода пробирки следует держать вверх дном?
4.). Используя материал учебника ИЛ, ЛОВ, заполните концептуальную таблицу по разделу «Изотопы водорода»
| Линии сравнения | Протий | Дейтерий | Тритий |
| 1.Символ |
|
|
|
| 2.Аr |
|
|
|
| 3.Число протонов |
|
|
|
| 4.Число нейтронов |
|
|
|
| 5. Распространенность в природе |
|
|
|
Самостоятельная работа по пройденной теме:
1.Задание на оценку «3».
Вставить пропущенные слова:
а). Объем занимаемый 1 молем газа называют …………..……… объемом газа.
б). При нормальных условиях 1 моль любого газа занимает объем ……… литра.
в). Величина, показывающая во сколько раз 1 моль одного газа легче или тяжелее 1 моль другого газа называется ……………………………………………………………………………………………………..
Задания на оценку «4». Вы получите оценку «4», если кроме заданий на оценку «3», выполните задания на оценку «4». 4). Объем занимаемый при нормальных условиях 1 молем азота:
а). 44,8 л б). 22,4 л в). 24,8 л г). 42,4 л
5). Относительная плотность углекислого газа по водороду равна:
а). 21 б).22 в). 23 г).24
Задания на оценку «5». Вы получите оценку «5», если кроме заданий на оценку «3», и заданий на оценку «4» выполните задания на оценку «5».
6).Молярная масса газа с относительной плотностью по водороду равной 8:
а).12 г/моль, б). 16 г/моль в). 18 г/моль г).24 г/моль
 2.
2. 

















