Тема урока Относительная атомная и молекулярная массы
Цель: Углубить знания учащихся о химической формуле;
Дать понятие об относительной атомной и относительной молекулярной массах.
Задачи к уроку:
Образовательная: изучить необходимость использования относительных масс в
химии; сформировать умения и навыки вычислять относитель- ную молекулярную массу вещества по формуле;
Развивающая : умение работать с ПСХЭ;
логические операции(анализ , синтез, обобщение) ,креативное
мышление, лабильное мышление ,умение находить причинно-
следственные связи;
Воспитательные: формировать осознанный подход к изучаемой дисциплине,
прививать навыки творческого и самообразовательного подхо-
да к процессу обучения;
толерантное отношение к участникам группы.
Тип урока: Изучение нового материала с элементами межпредметных связей.
Формы работы: Работа в группах , самостоятельная работа , физкульт-
минутка.
Методы и приемы: Рассказ , беседа , морской бой , аналогичная линия, проблемная си-
туация ,ролевая игра, фестиваль идей ,ИКТ ,рефлексия.
Оборудование: Мультимедийная презентация к уроку, раздаточный материал(дидакти-
ческие задания ,оценочный лист ,личный результат), таблица ПСХЭ.
Ожидаемый результат: -нахождение в ПСХЭ относительных атомных масс элементов,
-научиться рассчитывать относительные молекулярные массы,
-работать в малых группах , создавая результат коллективной
деятельности, оценивать свою деятельность,
-получать дополнительную информацию.
Ход урока
1 Организационный этап.
Учащиеся заходят в класс и рассаживаются по группам : геологи , математики , химики , лирики , спортсмены. В группах выбирается куратор , который координирует работу. Каждая группа выполняет определенные задания на различных этапах урока. Учащиеся имеют возможность получить две оценки : за работу в группе и индивидуальную. Оценки заносятся в « Оценочный лист урока».( приложение1).
2 Мотивация учебной деятельности.
Учитель: Вы , на уроке химии сейчас
Будто обычно все ,
Но веет тайной…….
Открою первую для вас - это тема нашего урока…..( слайд № 1 )
Вторая – изучать химические вопросы нам поможет математика , литература , геология , и спорт….Предлагаю настроиться позитивно на работу ( слайд №2)
3 Актуализация опорных знаний.
Учащимся предлагается закончить предложения ( слайд №3)
Простое вещество - это……..
Сложное вещество - это……..
Игра-прием « Морской бой» . Группа группе по цепочке называют координаты -оппоненты определяют простое или сложное вещество зашифровано.
| № | А | Б | В
| Г | Д | Е |
| 1 | К2О | SO3 | N2 | NaF | FeCl2 | CO2 |
| 2 | NaCl | Fe | Na2O | H3PO4 | Si | NO2 |
| 3 | H2 | LiF | C | Ca(OH)2 | HNO3 | CH4 |
| 4 | K2S | P2O5 | CaCO3 | Fe2O3 | Cu(OH)2 | Na2CO3 |
| 5 | B2O3 | HNO3 | MgS | N2 | Zn | H2S |
| 6 | MgO | O2 | K2CO3 | K2SO4 | KOH | Cu |
| 7 | H2SO3 | HBr | Cl2O3 | CaO | Ca3(PO4)2 | H2SO4 |
| 8 | Na2S | CuCl2 | F2 | Mg | Al2O3 | P4 |
| 9 | Al | NaOH | N2O5 | CaBr2 | H2SiO3 | Fe(NO3)2 |
| 10 | MgF2 | HCl | Al(OH)3 | H2CO3 | S | Cl2 |
Химическая формула - это……
Химическая формула показывает-……..
Игра –прием « Аналогичная линия». Каждая группа работает с карточкой , заполняя недостающие характеристики.
| Характеристика | Н2О | Н2SO4 |
| Название вещества
| Гидроген оксид ( вода) | Сульфатная кислота ( серная) |
| Одна молекула вещества
| Одна молекула воды |
|
| Качественный состав ( указать какие элементы входят в состав) | Молекула воды состоит из двух химических элементов: гидрогена и оксигена
|
|
| Количественный состав ( сколько атомов каждого элемента входят в состав) | В состав молекулы воды входят два атома гидрогена и один атом оксигена |
|
| Относительная молекулярная масса
Mr
|
18 |
? |
Учитель: Ответ на данный вопрос мы сможем дать в конце урока , когда успешно усвоим тему урока.
* Учитель оценивает работу групп на данном этапе урока.
4 Изучение нового материала.
Учитель: Все вещества состоят из структурных частиц: атомов , молекул, ионов. Они материальны и имеют определенную массу. Интересно какую? ….
Масса атома: взвесить атом на весах невозможно , т.к. они чрезвычайно малы…..
Например масса атома Урана – самого тяжелого атома на Земле
приблизительно равна: 0,000 000 000 000 000 000 000 4 г или 4*10-22г
Удобно ли вам работать будет с такими величинами? - Оперировать такими малыми числами неудобно .Что же делать? Поэтому вместо « абсолютных» масс атомов используют относительные.
( слайд 4 )
Введено понятие атомной единицы массы –а.е.м.
1а.е.м.=1/12ma(С)=1/12*1,994*10-23=1,662*10-24г
1 а.е.м= 1,662*10-24г или 1,662*10-27кг
Ar – относительная атомная масса ( не имеет единицы измерения)
Ar( Е)= ma/1а.е.м.
Аr(H)= 1,673*10-24г/1,662*10-24г = 1,00661853…..
Ar(O) = 26,667*10-24г/ 1,662*10-24г = 16,045
Относительная атомная масса показывает во сколько масса атома элемента больше 1/12 массы атома карбона (relatives-относительный).
Учитель : значение относительных атомных масс химических элементов записаны в периодической системе химических элементов, но в химических расчетах их принято округлять до целых чисел.
Помощь математиков : Напомним правило округления:
- если после целого числа стоит цифра от 5 до 9 , то мы добавляем
одну единицу к целому;
- если после целого числа стоит цифра от 0 до 4 , то оставляем
целое число без изменения.
Разминка - учащимся предлагается задание: найти в периодической системе и округлить относительные атомные массы элементов-O ; C; Al ; Ca ; Li.
Учитель: Запомните Ar( Cl) = 35,5 !
- найдите в периодической системе пары элементов , соотношение масс атомов элементов которых:
а) 1:2 б) 1:3
возможные ответы:
Ar(C) : Ar(Mg) Ar(Be): Ar(Al)
12:24 9:27
Ar(O): Ar(S) Ar(He): Ar(C)
16:32 4: 12
Ar(Ne): Ar(Ca) Ar( O) : Ar (Ti)
20:40 16 : 48
Ar(Ca): Ar(Br)
40:80
* Учитель оценивает работу групп на данном этапе.
Помощь спортсменов : физкультминутка! ( слайд 5)
Масса молекулы .( слайд №6)
Учитель: Мы знаем , что атомы соединяясь , образуют молекулы веществ. Массы молекул ,как и атомов, очень малы…. Поэтому целесообразно использовать относительные молекулярные массы.
Относительная молекулярная масса показывает во сколько раз масса молекулы больше 1/12 массы атома карбона.
Mr- физическая величина , которая равна отношению массы молекулы к 1/12 массы атома карбона: Mr=m (молекулы)/1/12 maC.
Mr-равна сумме относительных атомных масс химических элементов , входящих в состав молекулы с учетом количества атомов в данной формуле.
Пример: Mr(O2)= Ar(O)*2=16*2=32
Mr(Cl2)=Ar(Cl)*2 = 35.5*2=71
Mr (H2O)= Ar(H)*2+Ar(O)=14*2+16=18
Mr (Ca(OH)2)= Ar(Ca)+Ar(O)*2+Ar(H)*2= 40+16*2+1*2=74 или 40+(16+1)*2=74
Помощь математиков: Повторим порядок действий выражения:
выполняем действия в скобках;
выполняем умножения;
выполняем сложение.
5 Формирование умений и навыков.
А) Задание : Учащиеся рассчитывают относительные молекулярные массы . комментируя свои действия.
Mr(CO)=? Mr(B2O3)=? Mr(Ca (NO3)2)=?
Mr(NaCl)=? Mr(SiO2)=? Mr(Cr2(SO4)3)=?
Б) Задание « Фестиваль идей»
Лирики : От граней хрусталя
Блеснет холодный свет
И луч его , скользя к границе мира,
Со взглядом перекрестится твоим,
Как золотая тонкая рапира.
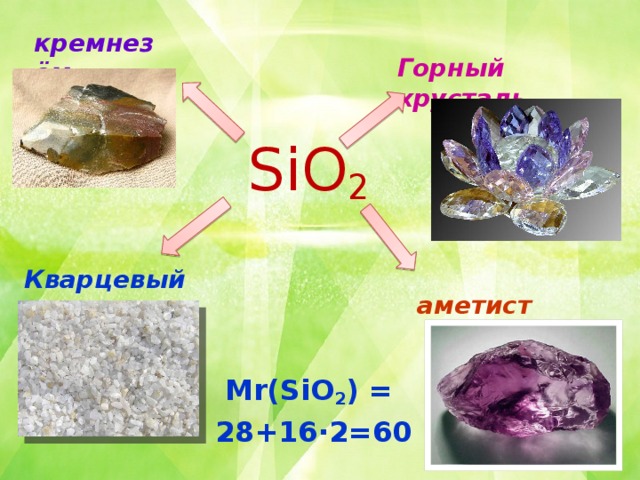
Геологи : угадывают минерал , демонстрируя слайд (слайд 7)
Химики: предлагают учащимся рассчитать Mr (SiO2) и проверяют результат.
Лирики: Холодный маг с прекрасными очами
Рубины плавил на костре желаний,
Вливал в хрусталь искрящееся пламя,
Разбавленное странными стихами.
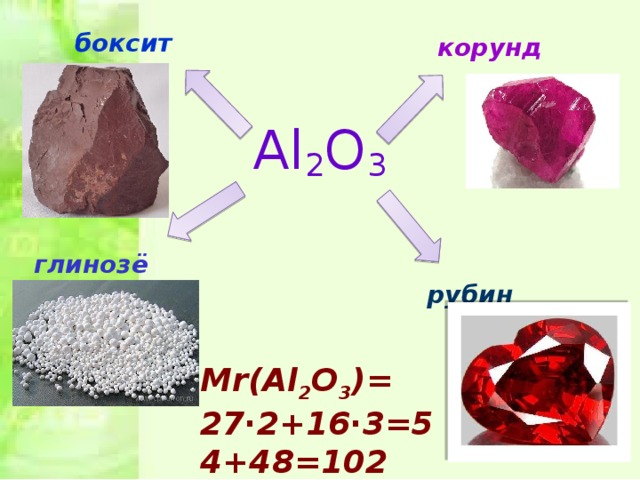
Геологи : угадывают минерал , демонстрируют слайд ( слайд 8)
Химики: предлагают учащимся рассчитать Mr ( Al2O3) и проверяют результат.
Лирики: На Земле живут три брата
Из семейства Карбонатов.
Старший брат –красавец мрамор
Славен именем Карары.
Превосходный зодчий он,
Строил Рим и Парферон.
Всем известен известняк,
, Потому и назван так.
Знаменит своим трудом,
Возводя за домом дом.
И способен и умел
Младший . белый братец ….( мел)
Геологи: угадывают и демонстрируют слайд ( слайд 9)
Химики: предлагают рассчитать Mr(CaCO3) и проверяют результат.
Лирики: Очарованный , околдованный ,
Я тобой благородным навечно.
И хрустальным . и зеркальным
Я пленен , как и все человечество.
Геологи: угадывают и демонстрируют слайд ( слайд 10)
Химики : предлагают рассчитать Mr ( Na2O*CaO*6SiO2)
ПРОБЛЕМА – как правильно рассчитать данную массу?
Учитель В сложных химических формулах при расчетах масс математическая точка умножить означает сложение.
*Учитель оценивает работу групп на данном этапе.
Помощь спортсменов: физкультминутка для глаз !
В) Задание: самостоятельная работа по вариантам. Рассчитайте относительные молекулярные массы веществ по формулам.
1-Вариант 2- Вариант 3- Вариант
Mr(O3) Mr(Cl2) Mr(P4)
Mr(H2) Mr(Br2) Mr(F2)
Mr(CaO) Mr(NO) Mr(MgO)
Mr(FeS) Mr(SO) Mr(CuO)
Mr (CS2) Mr(Mn2O5) Mr(Al2O3)
Mr(Fe2O3) Mr(SO2) Mr(SO3)
Mr(Al2(SO4)3) Mr(Na3PO4) Mr(Al(OH)3)
Mr(Zn(OH)2) Mr(Fe2(SO4)3) Mr(Ca3(PO4)2)
После выполнения заданий ученики обмениваются тетрадями и проверяют задания ,пользуясь ответами ( слайд 12), оценивают друг друга.
6 Подведение итогов.
Учитель: Сегодня на уроке вы углубили свои знания о химической формуле, дали определения « относительной атомной массе» и « относительной молекулярной массе»,
Развивали умения пользоваться периодической системой химических элементов и навыки проводить математические расчеты. Я думаю , что для развития ассоциативной памяти на уроке , вам удались роли химиков , математиков , лириков , геологов и спортсменов. В начале урока мы оставили знак вопроса ,давайте заменим его на число.
Ребята . заполните « Оценочный лист урока»
7 Рефлексия урока
( слайд 13) Учащиеся заполняют карточку « Личный результат», которая включает:
Я умею : объяснить……………
составлять………….
рассчитывать………..
пользоваться…………….
показать………………….
Я знаю…………………….
( приложение2)
8 Домашнее задание
Проработать параграф 7 и 11 упражнения 52, 87, 89*
Учебник Химия 7 класс Поппель Н.К.
ПРИЛОЖЕНИЕ
Приложение 1 ОЦЕНОЧНЫЙ ЛИСТ УРОКА
| Вид деятельности | Оценка группы |
| Фамилия имя ученика группы | Оценка по самостоятельной работе |
| Морской бой
|
|
|
|
|
| Аналогичная линия |
|
|
|
|
| Округление атомных масс |
|
|
|
|
| Соотношение масс элементов |
|
|
|
|
| Комментарий формулы |
|
|
|
|
| Фестиваль идей
|
|
|
|
|
| Средний балл
|
|
|
|
|
Приложение 2 ЛИЧНЫЙ РЕЗУЛЬТАТ
| Фамилия имя ученика |
|
| Я умею | Объяснить
Составить
Рассчитать
Показать
Пользоваться
|
| Я знаю |
|
| эпилог | И после плохого урожая надо сеять ( Сенека) |
АНАЛИЗ УРОКА
Тема урока Относительная атомная и молекулярная массы
Урок разработан на основе новой программы по химии для 8 классов общеобразовательных организаций ДНР.
Цель: Углубить знания учащихся о химической формуле;
Дать понятие об относительной атомной и относительной молекулярной массах.
Задачи к уроку:
Образовательная: изучить необходимость использования относительных масс в
химии; сформировать умения и навыки вычислять относитель- ную молекулярную массу вещества по формуле;
Развивающая : умение работать с ПСХЭ;
логические операции(анализ , синтез, обобщение) ,креативное
мышление, лабильное мышление ,умение находить причинно-
следственные связи;
Воспитательные: формировать осознанный подход к изучаемой дисциплине,
прививать навыки творческого и самообразовательного подхо-
да к процессу обучения;
толерантное отношение к участникам группы.
Тип урока: Изучение нового материала с элементами межпредметных связей
Я считаю , цели урока мы добились через использование технологий : мультимедиа , сотрудничества , развивающего обучения , проблемного обучения, интерактивного коллективного обучения. Которые позволили развить у гимназистов компетентности: общеучебные . информационно-коммуникативные , здоровьесберегающие . системного мышления .Мультимедийная технология была представлена тематической презентацией. Интеррактивная технология-приемами морской бой , аналогичная линия , фестиваль идей .Проблемного обучения –были созданы две проблемные ситуации. Технология коллективного обучения-работа в группах . прием ролевой игры .Технология личностно- ориентированного обучения реализовалась через использование дифференцированных , разноуровневых заданий самостоятельной работы . Самообразовательная деятельность учащихся включала работу с учебником и Периодической системой.
Входе своей самообразовательной деятельности я работаю над проблемой от знаний к метазнаниям , поэтому на уроке были использованы элементы межпредметных связей
Этап рефлексии включал личностную оценку ученика своей работе и философское напутствие .Данный урок позволил детям получить две оценки –данную учителем ( коллективная работа) и входе взимопроверки( индивидуальная работа).
-