МБОУ « Сагарчинская СОШ»
Урок по химии 8 класс на тему « Виды ковалентной связи»
Учитель Шиганаков Н.У 11.03.2016
Тип урока: изучение нового материала.
Цель: Сформировать понятия о механизме образования ковалентной полярной химической связи. Ознакомить учащихся с понятием электроотрицательности, как мерой неметоличности элементов. Продолжать формировать умения составлять схемы образования молекул соединений с ковалентной полярной связью
Планируемые результаты
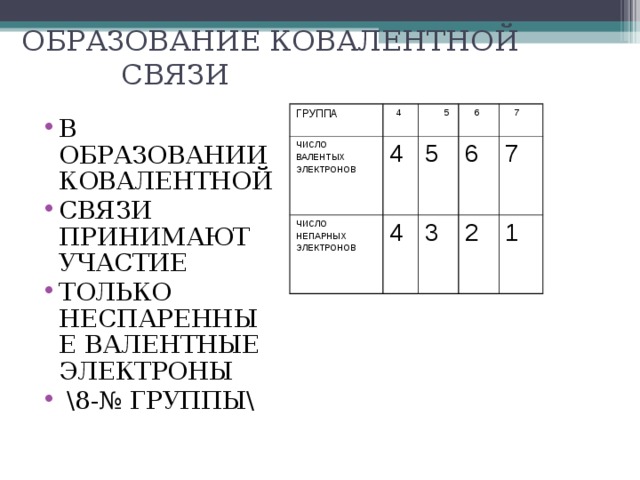
Предметные Умения объяснять понятия механизма образования «ковалентная неполярной и ковалентной полярной химических связях», электротрицательность; устанавливать различия между понятиями «ковалентная полярная связь» и «ковалентная неполярная связь», устанавливать причинно- следственные связи; состав вещества – тип химической связи
Метапредметные Познавательные УУД: умения воспроизводить информацию по памяти; работать с различными источниками информации; сравнивать и анализировать информацию, делать выводы; давать определения понятиям; свободно и правильно излагать свои мысли в устной и письменной формах.
ЛичностныеУУД: умение осознавать мотивы учебной деятельности
Регулятивные УУД: умение определять степень успешности выполнения своей работы, исходя из имеющихся критериев; навыки самооценки и самоанализа.
Коммуникативные УУД: умение отстаивать свою точку зрения, аргументируя её.
Личностные Ответственное отношение к учению
Графические приложения
Приложение № 1 Инструктивная карточка «Алгоритм составления схемы образования ковалентной полярной химической связи
Приложение № 2 Карточки-задания для групповой работы
Приложение № 3 Карточки с индивидуальными заданиями для самопроверки.
Оборудование: компьютер, проектор, электронная таблица ПСХЭ , таблица механизм образования ковалентной полярной связи, дидактический материал;
План урока:
1.Организационный момент.(доклад дежурного)
.Восстановление опорных знаний.(проверка Д/з)
2.Погружение в новую тему.
4.Закрепление нового материала.
5. Обратная связь
6. Рефлексия.
7. Домашнее задание.
ХОД УРОКА.
| Действия учителя
| Действия учеников |
| 1-ый этап урока. Подготовка к изучению нового материала, актуализация знаний. |
|
| Учитель: Здравствуйте. Садитесь. Доклад дежурного. Давайте вспомним, что нам уже известно: - | Орг. момент
|
| Учитель: А) Два ученика работают с заданием на слайде (Определить изменение Е- ион, Еср. к электр, ОЭО , дайте опредления) L  i C F i C F M  g Ca Ba g Ca Ba
В) Два ученика работают по карточкам (электронная формула) Г) Три ученика работают на доске - электронное строение атома Н, СL - механизм образования ковалентной связи 
Работающие у доски получают оценки, другие сверяют и исправляют ошибки, если они есть. | Проверка Д.з. с использованием презентации
Работа у доски |
| 2-ой этап урока. Изучение нового материала
|
|
| Учитель:
Итак, ребята определите «третий лишний» H2., N2. . HCl H2O, H2S, O2
Учитель: Ученики поочередно выходят к доске и называют выбранные вещества. Объясняют, по каким признакам они их определили. Учитель: Какую мы обозначим сегодня проблему Проблема: Как связь образуется между атомами в простых и сложных веществ(O2, HCl) . Учитель: Молодцы! Итак, тема сегодняшнего урока . Виды ковалентной связи Ученики записывают число и тему. Учитель: А теперь кто-то из вас попробует сформулировать цель сегодняшнего урока. Ребята пробуют определить цель и задачи урока.
Учитель: Итак, цель сегодняшнего урока познакомиться с ковалентной неполярной и ковалентной полярной связью, узнать о способности атомов химических элементов притягивать к себе общие электронные пары, научится составлять схемы веществ с ковалентной неполярной и ковалентной полярной связях Учитель. ЭО мера неметалличности элемента, то она изменяется вместе с нею, имеет те же закономерности в изменении свойств, в группах и в периодах.
.
| Погружение в новую тему
Беседа
Работа в тетрадях
Беседа
Ребята пробуют определить цель и задачи урока.
Работа в группах Работа с ПСХЭ, используя таблицу стр64и 63 учебника, ученики отвечают на вопросы, составляют схему в тетради (работа в парах) |
| 3-й этап урока. Поисковый.
|
|
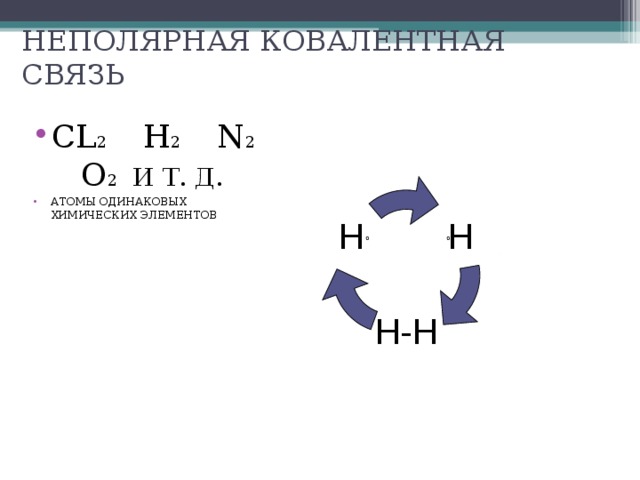
| Учитель А теперь познакомимся с механизмом образования ковалентной неполярной химической связи оставим схему образования ковалентной полярной химической связи для молекулы НCl, пользуясь алгоритмом инструктивной карточки..
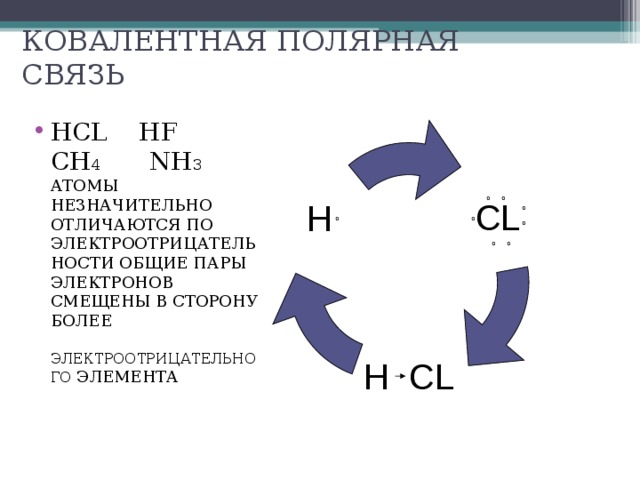
Ребята, попробуйте сформулировать определение ковалентной полярной химической связи
Сравните ваше определение, с определением, данным в учебнике, и запишите его в тетрадь Заполните таблицу Виды химической связи | Один ученик выполняет задание у доски, остальные – в тетрадях.
Устно формулируют определение: ковалентная неполярная ковалентная полярная самостоятельно в тетради заполняют таблицу
|
| 4-ий этап урока. Закрепление. Тренировка умения составлять схему образования ковалентной полярной химической связи
. 1.Учитель. Организует работу в группах по составлению схем образования ковалентной полярной связи
2.Учитель. Организует проверку выполненных заданий у доски, нацелив учеников на выполнение недостающей записи ковалентной полярной связи: 3.Учитель. Дополняет и конкретизирует знания о ковалентной неполярной и ковалентной полярных связях. | Закрепление изученного материала 1. Работают в группах по отработке умения составлять схему образования ковалентной неполярной ковалентной полярной химических связей 2.По одному ученику от каждой группы выполняют задания у доски, объясняют механизм образования связи:
3.Учащиеся слушают и дополняют запись в тетрадях
|
| 5-ый этап. Обратная связь (проверить уровень усвоения учебного материала) Учитель. Предлагает выполнить разноуровневые задания на проверку усвоенных знаний и произвести самопроверку или взаимопроверку (правильные ответы помещаются на экране).
Анализ выполнения самостоятельной работы.
– Кто выполнял задания базового уровня? Какого результата вы достигли?
- Кто выполнял задания повышенного уровня? Каков ваш результат?
- Над чем ещё надо поработать?
Поставьте в план изучения темы оценку, полученную вами за выполненную проверочную работу |
Индивидуальная работа по карточкам
Самопроверка и самооценка, взаимопроверки
Отвечают на вопросы учителя проверка |
| 6-ой этап. Рефлексия
Учитель
1. Сегодня на уроке я: ☼ Научился… ☼ Мне показалось важным… ☼ Я понял, что… ☼ Я почувствовал, что… Своей работой на уроке я: ♦ Доволен… ♦ Не совсем доволен… ♦ Я не доволен, потому что…
Посмотрите на §12 и назовите вид связи, связывающую атомы элементов металлов между собой.
На следующем уроке будет продолжено изучение химической связи. Вы узнаете ещё об одном виде – ионной связи
7-ой этап. Домашнее задание Учитель: Откроем дневники и запишем Д/з §11пересказать, упр2 по заданию
| Итог урока Фронтальный опрос
Самостоятельно подводят результат работы
Записывают домашнее задание в дневник |
| Учитель: Наш урок закончен. Спасибо ребята. До свидания.
|
|
ПРИЛОЖЕНИЕ. Приложение № 1 Инструктивная карточка «Алгоритм составления схемы образования ковалентной полярной связи.
Схема образования молекулы с ковалентной полярной связью – молекулы хлороводорода

Приложение № 2 Работа в парах
Покажите выигрышный путь, состоящий из формул веществ с ковалентной неполярной связью.
I вариант II вариант
| Br2 | NO2 | CO2 |
| Na2O | O2 | HCl |
| H2O | CuCl2 | N2 |
| Ca | I2 | H2O |
| CaO | Cl2 | HBr |
| CaCl2 | O2 | Fе |
Покажите выигрышный путь, состоящий из формул веществ с ковалентной полярной связью.
I вариант II вариант
| SCl2 | H2 | MgO |
| NaCl | HF | HBr |
| SO3 | Cl2 | NH3 |
| Br2 | O2 | CO2 |
| Na2O | HCl | NO2 |
| N2 | KI | H2O |
Вариант 1
Начертите схему образования молекул: NH3, CCI4, BeO
Укажите частичные заряды каждого атома
.2. Расположите вещества в порядке возрастания полярности связи:
NH3, PH3, N2, AsH3
Вариант 2
Начертите схему образования молекул: NH3, CCI4, BeO
Укажите частичные заряды каждого атома
2. Расположите вещества в порядке возрастания полярности связи:
H2O, CH4, NH3, H2, HF
Приложение 3. Карточки- задания для групповой проверки
Вариант 1
1.Начертите схему образования молекул: PCI3, CO2, BeF2
Укажите частичные заряды каждого атома
.2. Расположите вещества в порядке возрастания полярности связи:
NO, CO, O2, B2O3
Вариант 2
Начертите схему образования молекул: SiCI4, COCI2, BBr3
Укажите частичные заряды каждого атома
2. Расположите вещества в порядке возрастания полярности связи:
NCI3,P CI3, CI2, SiCI4, SCI2
8

 i C F
i C F
 g Ca Ba
g Ca Ba 


 Li C F
Li C F
 Mg Ca Ba
Mg Ca Ba