План-конспект открытого урока химии в 11 «Б» классе от 28.01.10 г. по теме « Факторы, влияющие на скорость химических реакций».
Тип урока – комбинированный
Форма урока – лабораторная работа
Цели и задачи урока:
образовательные: сформировать у учащихся знания о факторах, влияющих на скорость химических реакций;
развивающие: продолжить развитие умений устанавливать причинно-следственные связи, проводить эксперимент; развивать умения осуществлять самоконтроль и взаимоконтроль и формировать у учащихся ИКТ - компетентности.
воспитательные: воспитывать интерес к учению, личностные качества, обеспечивающие успешность творческой деятельности (активность, сообразительность, любознательность).
Планируемые результаты: учащиеся будут знать факторы, влияющие на скорость химических реакций, будут уметь объяснять причины зависимости скорости реакций от этих факторов, научатся осуществлять контроль и взаимоконтроль.
Методы и методологические приёмы: диалогический метод изложения знаний с элементами исследования, выполнение демонстрационного и лабораторного эксперимента, работа в группах, фронтальная беседа, тестирование, самостоятельная работа, самопроверка и взаимопроверка.
Средства обучения: - инструкция для выполнения лабораторного эксперимента; - инструкция по технике безопасности; - демонстрационное оборудование; - лабораторное оборудование; - рабочая карта урока; - тесты;
- компьютер;
- проектор.
Подготовка учащихся к уроку.
1. Деление класса на группы по 5 человек (в каждой группе есть ученик-консультант).
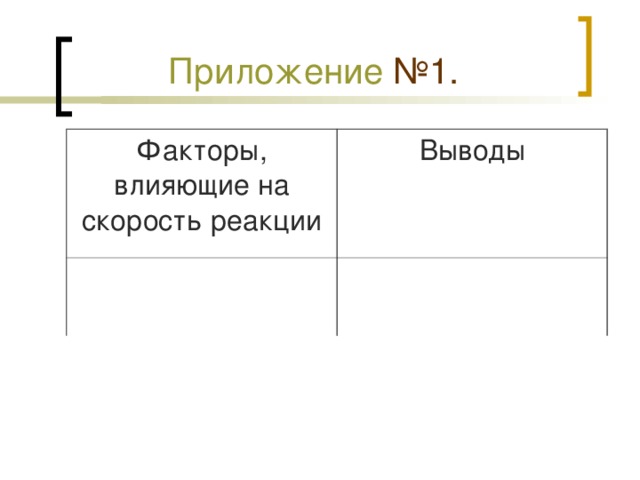
2. В тетрадях у учащихся приготовлена таблица, которая заполняется во время объяснения нового материала (Приложение №1).
3. Группа получает оборудование и реактивы для проведения эксперимента.
4. Каждый учащийся получает рабочую карту урока (Приложение №2).
Структура урока.
I. Организационный этап. Положительный настрой на урок.(1мин.)
II.Проверка домашнего задания (индивидуальная работа) (5мин.)
III. Мотивация и целеполагание (сформулировать цели и задачи урока). (1 мин.)
IV. Актуализация знаний (фронтальная форма работы). (1мин.)
V. Изучение нового материала (диалогический метод с элементами исследования, сочетание фронтальной и групповой форм работы, проведение эксперимента, самооценка и групповая оценка). (20 мин.)
VI. Закрепление знаний (работа в группах, тестирование). (8 мин.)
VII. Рефлексия (самооценка). (2мин.)
VIII. Домашнее задание. (2мин.)
Ход урока.
I. Организационный этап.
II.Проверка домашнего задания.
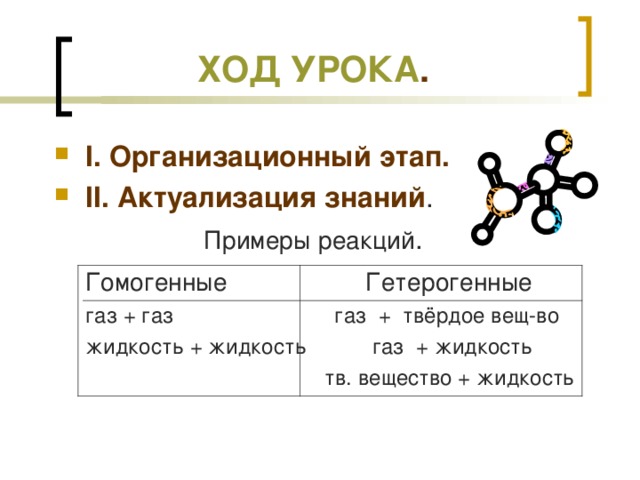
Учитель. 1.Какие системы химических реакций называются гомогенными, а какие- гетерогенными?
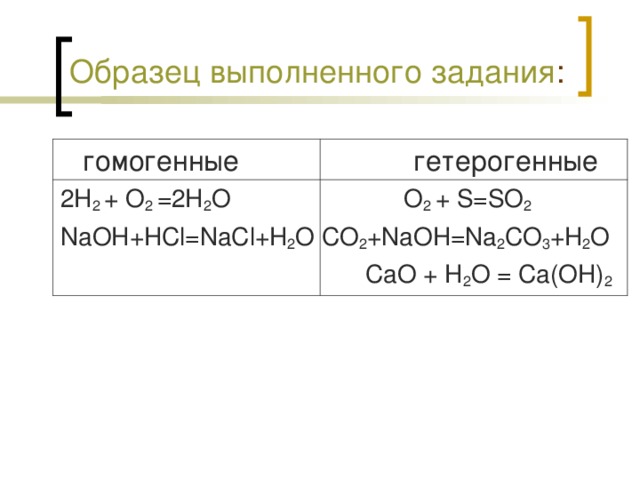
2.Составьте уравнения реакций, относящиеся к гомогенным реакциям (2 примера);
3.Ссоставьте уравнения реакций, относящиеся к гетерогенным реакциям (3 примера).
Примеры проецируем на экран с помощью проектора.
Гомогенные Гетерогенные
газ + газ газ + твёрдое вещество
жидкость + жидкость газ + жидкость
твёрдое вещество + жидкость
Класс работает в тетрадях, один ученик – за компьютером.
По окончании работы проецируем на экран составленные уравнения реакций.
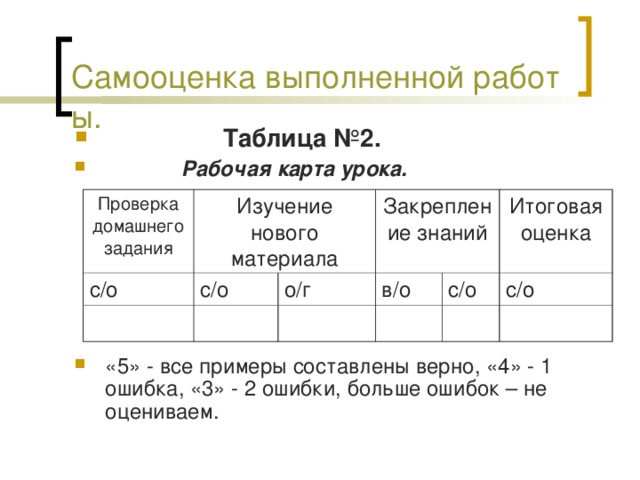
Проводим самооценку выполненной работы на данном этапе и заполняем рабочую карту. Ставим оценку «5», если все примеры составлены верно, «4» - 1 ошибка; «3» - 2 ошибки, если ошибок больше, то не оцениваем себя.
III. Мотивация и целеполагание.
Учитель. Сегодня мы будем изучать факторы, влияющие на скорость химических реакций. С помощью химического эксперимента мы выявим закономерности изменения скорости химических реакций в зависимости от условий (в тетрадях заранее приготовлена таблица, которую будем заполнять во время объяснения нового материала). Подумайте и назовите факторы, т.е. условия, которые могут влиять на скорость реакций (обсуждение в группе).
Учащиеся называют факторы: температура, концентрация.
Учитель. Кроме названных вами факторов есть ещё природа реагирующих веществ, площадь поверхности соприкосновения веществ, катализаторы.
IV. Актуализация знаний.
Учитель. На предыдущем уроке мы познакомились с понятием «скорость химической реакции». Дайте определение скорости химических реакций;
Ответ: скорость реакции - это изменение концентрации одного из веществ в единицу времени.
Учитель. Какие факторы могут влиять на скорость реакции?
Ответ: концентрация реагирующих веществ, температура, площадь соприкосновения веществ, природа реагирующих веществ, катализаторы/
Учитель. На сегодняшнем уроке мы должны выяснить, как эти факторы влияют на скорость реакции?
V. Изучение нового материала.
Тема урока проецируется на экран.
Учитель. Выполняя эксперимент (приложение №5) по группам, найдем ответ на поставленный вопрос. (Учитель в случае необходимости оказывает консультационную помощь).
1 группа. Зависимость скорости химической реакции от природы реагирующих веществ.
Оборудование: штатив с пробирками, гранулы цинка, растворы HCl и CH3COOH, мензурка.
2 группа. Зависимость скорости химической реакции от площади поверхности соприкосновения реагирующих веществ.
Оборудование и реактивы: штатив с пробирками, железный гвоздь, железные опилки, раствор CuCl2, стеклянная лопатка, мензурка.
3 группа. Влияние температуры на скорость.
Оборудование и реактивы. Штатив с пробирками, пипетка, спиртовка, пробиркодержатель, оксид меди(CuO), раствор H2SO4.
4 группа. Влияние концентрации исходных веществ на скорость.
Оборудование и реактивы: штатив с пробирками, пипетка, мензурка, 0,4% и 0,8% раствор иодида калия, раствор крахмала и перекиси водорода
Во время выполнения учащимися эксперимента на экран спроецированы правила техники безопасности (Приложение №3).
Представление результатов групповой работы.
Учащиеся (по 1 человеку от группы) выступают у доски, используя данные результатов проделанных лабораторных опытов.
Представитель первой группы: HCl-сильная кислота и в растворе легко распадается с образованием H+, которые легко восстанавливаются до свободного H2.
CH3COOH-слабая кислота и слабо диссоциирует с образованием ионов Н+.
С увеличением реакционной способности веществ, скорость химической реакции увеличивается
Представитель 2 группы. При взаимодействии хлорида меди с железными опилками площадь поверхности соприкосновения веществ больше.
Представитель 3 группы. В пробирке которую нагреваем окраска раствора изменяется быстрее, т.е.реакция протекает интенсивнее. При повышении температуры скорость реакции увеличивается.
Учитель. Зависимость скорости реакции от температуры исследовал голландский учёный Я. Вант-Гофф: при повышении температуры на каждые 100 скорость увеличивается в 2-4 раза.
V2/V1 = үt 2-t1/10
Представитель 4 группы. Во второй пробирке раствор посинел быстрее. Чем выше концентрация исходных веществ, тем быстрее протекает химическая реакция
Учитель. Зависимость скорости реакции от концентрации реагирующих веществ была установлена Гульдбергом и Вааге. По закону действующих масс скорость химической реакции аА + bB = сС может быть вычислена по формуле V=kcAacBb
Вывод из каждого лабораторного опыта все учащиеся записывают в таблицу (Приложение №1) (таблица на экране).
Учитель. Зависимость скорости реакции от катализатора понаблюдаем в демонстрационном опыте «Каталитическое разложение перекиси водорода» (проводит учитель)
Оборудование и реактивы: штатив с пробирками, мензурка, пинцет, лучинка, спички, пероксид водорода.
В 2 пробирки наливаем по 5 мл перекиси водорода. Во вторую пробирку опускаем пинцетом кусочек моркови. Вносим в пробирки тлеющие лучинки. Во второй пробирке лучинка вспыхивает, т.к. при разложении перекиси водорода выделяется кислород. Перекись водорода разлагается и без катализатора, но очень медленно. В присутствии катализатора (моркови) реакция протекает быстрее. В данном опыте в качестве катализатора используем ферменты – белковые молекулы.
Учитель. Выставьте себе оценку в рабочую карту за изучение нового материала (оценка группы + самооценка).
VI. Закрепление знаний (работа в группах, тестирование).
Каждая группа решает по 1-ой задаче на применение правила Вант-Гоффа и закона действующих масс (Приложение №6).
После выполненной работы проецируем на экран образцы решённых задач, чтобы зрительно закрепить ход решения (Приложение №6).
Проводим тест (Приложение №4). После выполнения теста - самопроверку, для этого проецируем на экран правильные ответы.
VII. Рефлексия (самооценка).
Каждый учащийся выставляет себе итоговую оценку за урок в рабочей карте.
VIII. Домашнее задание: § 13, упр. 3, 5.
Предложите способы увеличения скорости реакции в 8 раз путём изменения концентрации исходных веществ:
а) 2Н2 (газ) + О2 (газ) = 2Н2О (газ);
б) Н2 (газ) + Cl2 (газ) = 2НCl (газ).
Приложения:
Приложение № 1.
Закономерности изменения скорости химических реакций в зависимости от условий.
| Условия, влияющие на скорость химической реакции | Закономерности изменения скорости при изменении условий |
| 1. Природа веществ (строение, свойства, состав) |
|
| 2. Площадь поверхности соприкосновения веществ |
|
| 3. Температура |
|
| 4. Концентрация веществ |
|
| 5.Катализатор |
|
Приложение № 2.
Оценка работы учащихся на каждом этапе урока (рабочая карта урока).
Рабочая карта урока.
Тема.
Ф. И. учащегося.
| Проверка домашнего задания | Изучение нового материала | Закрепление знаний | Итоговая оценка |
| с/о | с/о | о/г | в/о | с/о | с/о |
|
|
|
|
|
|
|
Примечание: с/о – самооценка; в/о – взаимооценка; о/г – оценка группы.
При самопроверке учащийся оценивает себя сам по пятибалльной системе и выставляет отметку в рабочую карту.
При изучении нового материала необходимо активизировать внимание учащихся. Для этого использую самооценивание. Сообщаю критерии оценивания. Если вы были внимательны, уверены, что поняли материал и можете его воспроизвести, то поставьте себе «5», если вы были не всегда внимательны, но в целом материал поняли и можете ответить на вопросы, то поставьте себе «4», если же вы были рассеянны, поняли лишь часть материала, то поставьте себе «3», если вы были невнимательны и не поняли то, о чём мы говорили, то поставьте себе «минус».
Если работа шла по группам, то оценивается группой степень активности каждого учащегося, понимания и аргументированности.
При проверке домашнего задания и самостоятельной работы оценка выставляется по следующим критериям: если нет ошибок – «5», если 1 ошибка – «4», 2 ошибки – «3», если ошибок больше, то оценка не ставится.
Критерием итоговой оценки выступает уровень усвоения знаний и приобретённых умений.
Приложение № 3
Правила техники безопасности.
Проводите опыты лишь с теми веществами, которые указаны учителем.
Вещества нельзя брать руками и проверять их на вкус.
Без указания учителя не смешивайте неизвестные вам вещества.
Нагревая пробирку с жидкостью, держите её так, чтобы отверстие было направлено в сторону и от вас и от соседей.
Не приступайте к выполнению опыта, не зная, что и как нужно делать.
Всегда пользуйтесь только чистой лабораторной посудой.
Твёрдые вещества берите только ложкой.
При выполнении опытов пользуйтесь небольшими дозами веществ.
Особую осторожность соблюдайте при работе с кислотами. Если случайно кислота попадёт на руки или на одежду, то немедленно смойте её большим количеством воды.
Остатки веществ не высыпайте и не вливайте обратно в сосуд с чистыми веществами.
Проводите опыты только над столом и, закончив работу, приведите рабочее место в порядок.
Приложение № 4.
Вариант 1.
1. При обычных условиях с наибольшей скоростью будет взаимодействовать с водой:
а) железо; б) магний; в) натрий; г) алюминий.
2. С наибольшей скоростью протекает реакция между:
а) растворами хлорида бария и сульфата натрия;
б) оксидом кальция и углекислым газом;
в) оксидом меди и серной кислотой;
г) оловом и серной кислотой.
3. Скорость выделения водорода будет наибольшей при взаимодействии с соляной кислотой:
а) кальция; б) олова; в) цинка; г) меди.
4. Скорость разложения пероксида водорода можно увеличить, если:
а) добавить к нему оксид марганца (IV);
б) увеличить объём вещества;
в) понизить температуру реакции;
г) добавить воды.
5. На скорость реакции обжига колчедана 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q не влияет:
а) повышение концентрации кислорода;
б) наличие катализатора;
в) повышение температуры;
г) увеличение площади поверхности соприкосновения колчедана и газа.
6. Скорость реакции железа с соляной кислотой увеличится, если:
а) повысить давление;
б) повысить концентрацию хлороводорода;
в) понизить температуру раствора;
г) добавить в раствор лакмус.
Вариант 2.
1. Скорость выделения водорода будет наибольшей при взаимодействии:
а) цинка с соляной кислотой;
б) цинка с уксусной кислотой;
в) олова с соляной кислотой;
г) меди с уксусной кислотой.
2. Скорость реакции между металлом и разбавленной серной кислотой выше, если участвует:
а) цинк; б) медь; в) свинец; г) железо.
3. С наибольшей скоростью взаимодействуют:
а) NaOH (p-p) и HCl (p-p); б) Cu и O2; в) Fe и HCl (p-p); г) CuO и HCl.
4. Скорость коррозии железа уменьшится в паре с:
а) цинком; б) свинцом; в) медью; г) оловом.
5. Скорость реакции магния с соляной кислотой увеличится, если:
а) повысить давление;
б) измельчить образец металла;
в) понизить температуру раствора;
г) добавить в раствор индикатор.
6. Распиленное на куски бревно сгорает с большей скоростью, чем целое, потому что:
а) уменьшается площадь поверхности дерева;
б) понижается температура горения;
в) увеличивается доступ кислорода к каждому куску;
Приложение № 5 Лабораторная работа по группам
Лабораторный опыт №1 (выполняет 1 группа)
Зависимость скорости химической реакции от природы реагирующих веществ.
Оборудование: штатив с пробирками, гранулы цинка, растворы HCl и CH3COOH, мензурка.
| Ход работы | Наблюдения | Выводы |
| Поместите в 2 пробирки гранулы цинка равной массы и одинаковой площади поверхности. Добавьте в первую пробирку 2 мл HCI,а во вторую пробирку 2 мл CH3COOH. |
. |
|
Лабораторный опыт №2 (выполняет 2 группа)
Зависимость скорости химической реакции от площади поверхности соприкосновения реагирующих веществ.
Оборудование и реактивы: штатив с пробирками, железный гвоздь, железные опилки, раствор CuCl2, стеклянная лопатка, мензурка.
| Ход работы | Наблюдение | Выводы |
| Поместите в первую пробирку железный гвоздь длинной 2см, во вторую пробирку-с помощью лопатки железные опилки. Добавьте в каждую пробирку по 2мл раствора СuCl2. |
|
. |
Лабораторный опыт №3 (выполняет 3 группа)
Влияние температуры на скорость.
Оборудование и реактивы. Штатив с пробирками, пипетка, спиртовка, пробиркодержатель, оксид меди(CuO), раствор H2SO4.
| Ход работы | Наблюдение | Выводы |
| В 2 пробирке поместите по одной грануле CuO , добавьте 6-8 капель раствора серной кислоты. Первую пробирку нагрейте. |
|
. |
Лабораторный опыт №4 (выполняет группа 4)
Влияние концентрации исходных веществ на скорость.
Оборудование и реактивы: штатив с пробирками, пипетка, мензурка, 0,4% и 0,8% раствор иодида калия, раствор крахмала и перекиси водорода.
| Ход работы | Наблюдения | Выводы |
| В две пробирки поместите раствор иодида калия:1пробирка 0,4% раствор иодида калия, 2 пробирка 0,8% раствор иодида калия. Добавьте в каждую пробирку по 2 капли крахмала и по 2 мл одновременно перекиси водорода. |
. |
|
Приложение № 6
Как изменится скорость реакции синтеза аммиака, если концентрацию реагирующих веществ увеличить в 3 раза.
2. При повышении температуры на 100 скорость реакции возрастает в 3 раза. Во сколько раз возрастёт скорость реакции, если температуру повысить с 200 до 800.
3.Во сколько раз увеличится скорость реакции при повышении температуры от 1500 до 2000, если температурный коэффициент равен 3.
4. Как изменится скорость реакции синтеза хлороводорода, если концентрация хлора уменьшится в 2 раза, а концентрация водорода возрастёт в 4 раза.
Образец решения
1. N2 + 3H2 = 2NH3 2. V2/V1 = jt2-t1/10
V1 = kCN2C3H2 V2/V1 = 380-20/10
V2 = k3 CN2(3CH2)3 = 81kCN2C3H2 V2/V1 = 36
V2/V1 = 81kCN2C3H2/ kCN2C3H2 = 81 V2 = 729V1
V2 = 81V1
3. V2/V1 = jt2-t1/10 4. H2 + Cl2 = 2HCl
V2/V1 = 3200-150/10 V1 = kCH2CCl2
V2/V1 = 35 V2 = k(4CH2)(1/2CCl2)
V2 = 243V1 V2 = 2 kCH2CCl2
V2/V1 = 2 kCH2CCl2/ kCH2CCl2
V2/V1 = 2
V2 = 2V1
Используемая литература
1. Габриелян О.С. Химия 11.-М.: Дрофа ,2006
2. Габриелян О.С. Химия: пособие для школьников старших классов – М.: Дрофа, 2006
3. Ширшина Н.В. Общая химия (Электронный ресурс): демонстрационное : электронное пособие для учителей и учащихся 11 кл. – Волгоград: Учитель, 2006 1 диск (CD)
4. Тяглова Е.В. Исследовательская деятельность учащихся по химии –М.: «Глобус»,2007
5. Единая цифровая коллекция образовательных ресурсов: http:/school-collection.edu.ru/catalog