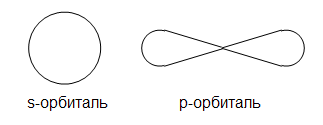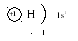| Тема урока: «Строение электронных оболочек атомов». Цель урока: Рассмотрение модели строения атома. Введение понятия «электронное облако», «электронная орбиталь» , «движение без траектории». Рассмотрение модели энергетических состояний атома. Задачи урока: Образовательные: формирование представления об электронной оболочке атома и энергетических уровнях, рассмотрение электронного строения некоторых элементов, развитие умений по составлению электронных формул атомов, определению элементов по их электронным формулам, определение состава атома. Воспитательные: рассмотрение значимости работы русского химика Д.И.Менделеева; Развивающие: формирование умений работать с периодической системой, логически мыслить и оформлять результаты логических операций, проводить параллели между химическими понятиями, изучаемыми в теме.
План урока Организационный момент 4 мин Объяснение нового материала 25 мин Закрепление и подведение итогов урока 12 мин Информация о домашнем заданий 4 мин Ход урока Организационный момент 4 мин Учитель: Доброе утро, ребята, Нам сегодня вместе предстоит продолжить постигать тайны и загадки, которыми полна наука «химия». Тема нашего урока «Строение электронных оболочек атомов» ( запишем в тетрадях). Ребята, вам хочется увидеть атомы, электроны?...Можно ли это сделать?... Можно….в воображении. Давайте попробуем. Итак, в путь! Наша общая задача на уроке – продолжить изучение темы «Атомы химических элементов», нам предстоит актуализировать знания о строении атома и познакомиться со строением электронных оболочек атомов. Объяснение нового материала 25 мин Поэт В.Брюсов в 1922 году под впечатлением от удивительных открытий физиков написал: Быть может, эти электроны- Миры, где пять материков, Искусства, знанья, войны, троны И память сорока веков! Еще, быть может, каждый атом- Вселенная, где сто планет; Там – все, что здесь, в объеме сжатом, Но также то, чего здесь нет. Учитель: Как вы понимаете эти строки? Учащиеся: Может быть… Сходство электронов и атомов с астрономическими объектами пока не подтвердилось, но того, «чего здесь нет», оказалось более чем достаточно, и об этом вы будете узнавать на уроках химии и физики. Учитель: Науке потребовалось более 2000 лет, чтобы определить, на что он похож. И даже сейчас он все еще остается для нас загадкой.Предлагаю вам заполнить анкету от имени атома. Анкета. 1. Имя Атом 2. Место обитания любое тело в газообразном, жидком, твердом агрегатном состоянии 3. Поразительные качества невероятная малость 4. Строение атома Учитель: А из чего состоит атом? (схема) Учащиеся: Атом состоит из положительно заряженного ядра и движущихся вокруг него электронов Учитель: А из чего состоит ядро атома? Учащиеся: Из протонов и нейтронов Учитель:А движущиеся вокруг ядра электроны образуют электронную оболочку. Учитель: В начале ХХ в. была принята планетарная модель строения атома, согласно которой вокруг ядра движутся электроны, как планеты вокруг солнца. Следовательно, в атоме есть траектории, по которым движется электрон. Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон. Это уже не орбита, а орбиталь. Двигаясь вокруг атома, электроны образуют в совокупности его электронную оболочку. Совокупность всех электронов, окружающих ядро, называется электронной оболочкой (записываем определение)  Учитель: Давайте выясним, как движутся электроны вокруг ядра? Учитель: Беспорядочно или в определенном порядке? Оказывается, движение электронов происходит в определенном порядке. Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Каждый электрон в зависимости от своей энергии будет находиться на определенном расстоянии от ядра. Так образуются электронные слои в электронной оболочке атома. Каждый слой состоит из электронов с близкими значениями энергии, поэтому слои электронов называют энергетическими уровнями. Электронный слой, состоящий из электронов с близкими значениями энергии, называется энергетическим уровнем. ( записываем определение) Учитель: А как же определить , сколько слоев ( энергетических уровней) в атоме того или иного элемента? Учащиеся: Число уровней определяется номером периода, в котором располагается элемент. Учитель:Например: У Na -2 энергетических уровня, т.к. он находиться во 2 периоде У N – 3, 3 период У Fe – 4 , 4 период Учитель: А сколько электронов может находиться на каждом энергетическом уровне? Принцип Паули 1925г, согласно которому в атоме не могут быть два электрона с одинаковыми квантовыми силами, т.е. на каждой орбитали может находиться не более двух электронов, с противоположными спинами. Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле N = 2n2, где N - максимальное число электронов на уровне; n – номер энергетического уровня. Например: 1 энергетический уровень, n=1, N=2 n=2, N=8 Каждый уровень вмещает не больше рассчитанного количества электронов. Если электронный слой содержит максимально возможное число электронов, то его называют завершенным или спаренным. Электронные слои, не содержащие максимального числа электронов, называют незавершенными или неспаренным. Как ранее было сказано, электрон движется не по орбите, а по орбитали и не имеет траектории. Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.( записываем определение) Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех. Первый энергетический уровень имеет один подуровень (s), второй- два (s,p), третий – три (s,p,d) и т.д. Электроны, находящиеся на одном энергетическом уровне тоже отличаются друг от друга. Электроны разных подуровней одного и того же уровня имеют разную форму 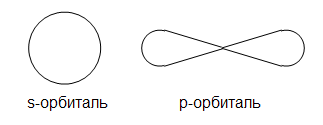 электронного облака: сферическую (s), гантелеобразную (p) и более сложную конфигурацию. S- орбиталь- это просто шарик. Путь электрона по ней напоминает путь нитки, которую наматывают на клубок. С нее начинается каждый уровень P – орбиталь похожа на объемную восьмерку или перекрученную сосиску, и вместе перекрутки расположено ядро. Таких орбиталей на каждом энергетическом уровне -3, они располагаются под углом 90 – как оси координат. D- орбиталь – это две p-орбитали , соединенные центрами – как объемная четырехлепестковая ромашка, их на подуровне может быть 5. F – орбиталь имеет более сложную форму, ее трудно описать словами. Представьте путь своей мысли при решении системы уравнений с 3 неизвестными – это примерно такой же сложности. Каждая орбиталь вмещает максимум 2 электрона с противоположными спинами. Спин - это условное направление движения электрона вокруг своей оси – оно может быть либо по часовой стрелке, либо против. Только электроны с разными спинами уживаются на одной орбитали, т.к. отталкивание их из-за одноименных зарядов частично гасится. В.М.Клечковским 1951г, сформулировал правило: заполнение электронных подуровней осуществляется в порядке возрастания суммы(n+l) – в порядке возрастания числа n. Составим схему последовательного заполнения электронами энергетических уровней. 2ē 8ē 18ē   
n=1 n=2 n=3      
s s p s p d 2ē 2ē 6ē 2ē 6ē 8ē Теперь мы можем составить схему строения электронных оболочек атомов: Определяем общее число электронов на оболочке по порядковому номеру элемента. Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент. Определяем число электронов на каждом энергетическом уровне. Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами. Пример: Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода 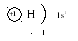
Свойства элементов изменяются периодически. У всех атомов семейств элементов (щелочные металлы, галогены, благородные газы) на внешнем энергетическом уровне одинаковое число электронов.У щелочных металлов – 1 электрон. У галогенов – 7 электронов. У благородных газов – внешний уровень их атомов завершен, 8 электронов. Вывод: свойства химических элементов периодически (через определенные промежутки – периоды) повторяются потому, что периодически повторяется одинаковое строение внешних энергетических уровней их атомов. ЗАКРЕПЛЕНИЕ И ПОДВЕДЕНИЕ УРОКОВ 12 мин Вариант 1 Заряд ядра атома АЗОТА равен а)7 б)13 в)4 г)26 д)11
Число протонов в ядре атома КРИПТОНА равно а)36 б)17 в)4 г)31 д)6
3.Число нейтронов в ядре атома ЦИНКА равно а)8 б)35 в)11 г)30 д)4
4.Число электронов в атоме ЖЕЛЕЗА равно а)11 б)8 в)56 г)26 д)30
Вариант 2
Максимальное число электронов на 4 энергетическом уровне а) 32 б)36 в)16 г)24
Число электронных уровней у атома кальция равно а)1 б)2 в)3 г)4
3.Число электронов на внешнем уровне атома БРОМА равно а) 7 б) 6 в)5 г)4
4.Общее число s-электронов у атома ЛИТИЯ равно а) 1 б)2 в)3 г)4
Электронная формула внешнего уровня 2s2 2p6 соответствует атому а) кислорода б) серы в) фтора г) неона Далее учащиеся меняются вариантами с соседями по парте, и проверяют по образцу на экране (взаимопроверка). Учитель: Давайте подведем итоги урока. Что мы сегодня узнали нового? Электрон не имеет траектории и движение его происходит по орбитали. По схеме последовательного заполнения электронами энергетических уровней научились составлять электронные формулы элементов. Научились по электронным формулам определять химический элемент.
4 ИНФОРМАЦИЯ О ДОМАШНЕМ ЗАДАНИЙ 4 мин: записи в тетради, 8, упр. по карточкам 1. Изобразите строение атомов следующих элементов: 1 вариант фосфора 2 вариант магния 2. Сравните строение атомов 1 вариант бора и фтора 2 вариант кислорода и серы 3. По данным о распределении валентных электронов найдите элемент: а) 2s1 б) 2s22p4 в) 3s23p6 г) 3d104s1 д) 4s24p3 е) 4s24p5 ж) 3s23p4
|